18F-FLT检测非小细胞肺癌对特罗凯敏感性的研究
杨伯平 侯茹蓉 任瑞美
表皮生长因子受体(epidermal growth factor receptor,EGFR)自分泌途径是癌症发生发展的重要影响因素,针对EGFR的靶向药物已显示出良好的临床疗效。但Haddad等[1]发现,尽管EGFR在大多数肺鳞状细胞癌中都呈过表达,只有少数患者能从EGFR靶向治疗中获益。有研究显示,上皮型的肺癌对EGFR 酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗较发生了间质化改变的上皮细胞敏感,提示肺癌的上皮细胞间质转换 (epithelial mesenchymal transition,EMT)状态有望成为靶向治疗疗效的预测因素[2,3]。上皮细胞-间质转化是上皮细胞在与周围间质的相互作用过程中逐渐获得了某些间质细胞特有性状的现象,肿瘤细胞也因此获得较强的侵袭和移动能力。 EMT 不仅包括细胞形态学的改变,还包括其基因型的改变,肿瘤细胞的代谢活性也因此发生了改变。本实验构建Snail扩增载体,并转染SPCA-1细胞,观察细胞发生EMT的改变,并在细胞水平上,研究非小细胞肺癌发生EMT前后3-脱氧-3-18F-氟代胸苷 (3'-deoxy-3'-18F-fluorothymidine,18F-FLT)的标准摄取值(standardized uptake value,SUV)的改变,对特罗凯敏感性的关系。
1 材料与方法
1.1 细胞培养
SPCA-1细胞株由本实验室保存,用含15%血清的DMEM中培养细胞,条件为5%CO2,温度为37℃,每2~3天传代1次。
1.2 pcDNA-Snai的构建及转染提取人白细胞总RNA
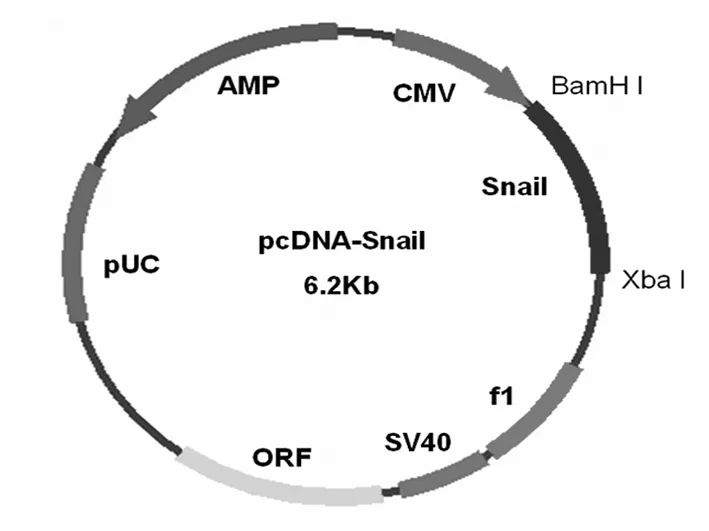
采用RT-PCR方法扩增Snail基因全长,上下游引物为Forward primer:5'-aaagagcgcggcatagtgg-3';Reverse primer:5'-tgctcaggatgtccccgctga-3',在上下游引物中分别加入BamH I和Xba I位点。将克隆产物连接到pcDNA3.1(+)上,构建成pcDNA-Snail。采用Lipofectamine 2000将pcDNA3.1- snail和空pcDNA3.1转染SPCA-1细胞株,并采用G 418进行筛选培养。
1.3 Western-blot 检测转染了pcDNA3.1- snail和空pcDNA3.1的SPCA-1细胞株中snail基因表达
倒去6个孔板中的培养液,用PBS液冲洗2次,然后将200 μl细胞裂解液加入孔中(150 mM NaCl,50 mM Tris HCl,2 mM EDTA,0.5% Triton-X100,5mM DTT,0.2 mM PMSF H2O,Aprotinin),20 min后收集,然后在4℃下13 000转离心10 min,吸取上清液,沸水浴加热上清液样品变性3 min,制备SDS 聚丙烯酰胺凝胶,并点样于胶中电泳1.5 h,在电转膜仪上将凝胶中的样品转移到硝酸纤维素滤膜上2 h左右,将硝酸纤维素滤膜于封闭液中4℃冰箱孵育过夜;将膜卷曲置于离心管中,PBS冲洗,在抗snail鼠单抗中共育30 min,TBS-T漂洗5 min 3次,用第二抗羊抗鼠抗体IgG温育半小时,加入DAB显色剂至阳性条带显色理想为止,在EDTA 缓冲液中终止显色反应。
1.4 免疫组化法检测SPCA-1细胞株中E-cadherin、vimentin、EGFR的表达
将转染1周后的细胞株与对照组SPCA-1细胞株接种于涂有多聚赖氨酸的玻片上,贴壁后,取出玻片,用预冷的丙酮固定细胞5 min,PBS冲洗3次,0.01%胰酶消化3 min,加入稀释的一抗孵育30 min,PBS冲洗3次,加入二抗孵育30 min,PBS冲洗3次加入三抗孵育30 min,PBS冲洗3次后DAB显色。计数1 000个肺癌细胞中阳性细胞数,无阳性细胞为阴性(-);阳性细胞数<1%为“+”;1%~10%为“++”;11%~50%为“+++”;>50%为“++++”[8]。
1.5 检测SPCA-1细胞株中18F-FLT的摄取值
2个6孔板3 复孔,在2组细胞株中加入74 KBq的18F-FLT,并设标准源,在培养箱中培养1 h。取出后置于冰上,快速取各孔的上清液分别滴入编号的试管中,用冷冻过的磷酸盐缓冲液冲洗各孔,将冲洗液混入原孔的上清液中。收集各孔的细胞分别放入编号的试管中,与其上清液相对应,应用γ-counting well(SY-2021定标器)计数细胞内(cell in,Cin)和细胞外(cell out,Cout)的放射性[2],计算Cin和Cout的比值(Cin/Cout),进行3次独立实验,采用台盼蓝拒染法检测活性细胞数。
1.6 MTT法检测erlotinib对细胞株的生长抑制作用
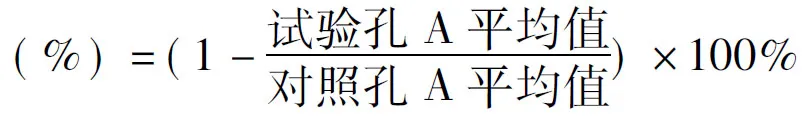
1.7 统计学分析
2 结果
2.1 表达载体pcDNA3.1- snail质粒(图1)
2.2 Wenstern-bloting 检测结果
转染了pcDNA3.1- snail和空pcDNA3.1的SPCA-1细胞株中snail基因表达见图2。

图2 Western blot检测结果
2.3 免疫组化结果
E-cadherin阳性细胞为细胞膜呈棕黄色染色,vimentin阳性细胞为胞质呈棕黄色染色,EGFR阳性细胞为胞质呈片状或颗粒状棕黄色染色,实验组细胞株中E-cadherin表达水平较对照组下降,vimentin表达水平较对照组下降,均有统计学差异,EGFR表达水平无明显变化。
2.4 实验组和对照组细胞株18F-FLT的摄取值
实验组和对照组细胞株内加入74 KBq的18F-FLT,并设标准源,3个复孔,在培养箱中培养1 h。实验组细胞株的摄取值[( 4.8±0.5)%],高于对照组细胞株[(2.3±0.5)%],有统计学差异,P=0.003。
2.5 MTT法检测erlotinib对实验组和对照组细胞株的生长抑制作用
实验组细胞株抑制率为(20.6%±3%),明显低于对照组细胞株(50%±2%),P=0.008。
3 讨论
目前在多种实体瘤如乳腺癌、肺癌、结肠癌、前列腺癌、肾癌、膀胱癌、头颈癌、卵巢癌、脑肿瘤中均发现EGFR过表达。Haddad等[1]研究也发现,尽管EGFR在大多数头颈部鳞状细胞癌中都有过表达,但只有少数患者能从EGFR抗体治疗中获益。
另有研究发现对特罗凯(erlotinib)敏感的细胞E-cadherin具有较高的表达水平,且浸润和转移能力较低,相反对erlotinib抗拒的细胞,E-cadherin表达水平低,且浸润和转移能力强,因此,E-cadherin有可能成为判断EGFR活性和靶向EGFR药物治疗疗效的生物学指标之一[3]。Fuchs等[4]根据E-cadherin和Vimentin的表达不同将12种细胞株分为上皮型和间质型,研究发现上皮型细胞对靶向EGFR的治疗各种药物均敏感,而间质型往往表现为抗拒且易发生浸润和转移。
EMT的概念改变了上皮细胞一成不变的观念,认为上皮细胞是一群具有高度可塑性的细胞。而调控上皮细胞进行EMT的动力,主要是来自于与上皮细胞有密切交互作用的细胞黏附分子,其中以钙黏蛋白(E-cadherin)一类的细胞黏附分子的调控最为重要。Eastham等[5]以干细胞为研究对象,结果发现,人类胚胎干细胞的分化程度主要决定于E-cadherin和N-cadherin的转变,增加vimentin 表达,上调E-cadherin抑制分子,细胞会出现运动,如果用抗体破坏介导干细胞之间互相连接的E-cadherin,细胞也会出现移动,细胞之间的有序结构消失出现间质变的现象。Lang等[6]认为vimentin表达参与调控上皮细胞的运动,在需要细胞移动的生理(如修复)及病理过程(如肿瘤转移)中上皮细胞往往表达vimentin 。Rho等[7]用肿瘤生长因子(TGF-beta1)作用肺鳞癌细胞株(A549)72h后出现EMT的改变,而去掉TGF-beta1后细胞回到以前的状态。另有研究发现对特罗凯敏感的细胞E-cadherin具有较高的表达水平,且浸润和转移能力较低,相反对特罗凯抗拒的细胞,E-cadherin表达水平低,且浸润和转移能力强,因此,EMT是细胞的1种状态,如有非创性的手段发现细胞组织处的状态,将对指导靶向EGFR药物治疗提供理论依据。
Kudo-Saito等[8]研究发现Snail基因是调控EMT的主要基因。本研究发现,扩增Snail后,E-cadherin表达降低,vimentin表达升高,即细胞发生EMT改变。同时细胞的形态发生了改变,细胞变得细长,细胞融合度降低,并且MTT法结果显示细胞对特罗凯的敏感性降低。在体内病变的组织器官出现结构变化之前,18F-脱氧葡萄糖正电子发射断层显像术(18F-fluoro-2-deoxy-D-glucose positron emission tomography,18F-FDG- PET)可从分子水平检测和识别所发生的代谢改变。用PET检查肿瘤的代谢,已有很多报道,18F-FLT被认为是反映肿瘤细胞增殖的1种新型示踪剂,Atkinson 等[9]结果显示,erlotinib应用3天后,SUV下降18%,安慰剂组下降1%。在鳞状细胞移植瘤检测西妥昔单抗(cetuximab)的疗效,cetuximab应用后1周,SUV下降62%,安慰剂组下降16%。因此认为,18F-FLT-PET可以早期检测肿瘤对靶向EGFR治疗的反应。本研究结果也显示,细胞发生EMT改变后,对18F-FLT的摄取增加。
本研究从细胞水平,探讨了E-cadherin、vimentin、EGFR表达的变化和18F-FLT的SUV等指标与肿瘤对erlotinib的敏感性的关系,为应用功能影像进行非小细胞肺癌靶向治疗的个体化选择提供理论基础,以指导临床应用。
[1]Haddad Y,Choi W,McConkey DJ.Delta-crystallin enhancer binding factor 1 controls the epithelial to mesenchymal transition phenotype and resistance to the epidermal growth factor receptor inhibitor erlotinib in human head and neck squamous cell carcinoma lines〔J〕.Clin Cancer Res,2009,15(2):532.
[2]Thomson S,Buck E,Petti F,et al.Epithelial to mesenchymal transition is a determinant of sensitivity of non-small-cell lung carcinoma cell lines and xenografts to epidermal growth factor receptor inhibition〔J〕.Cancer Res,2005,65(20):9455.
[3]Yauch RL,Januario T,Eberhard DA,et al.Epithelial versus mesenchymal phenotype determines in vitro sensitivity and predicts clinical activity of erlotinib in lung cancer patients〔J〕.Clin Cancer Res,2005,11(24):8686.
[4]Fuchs BC,Fujii T,Dorfman JD,et al.Epithelial-to-mesench-ymal transition and integrin-linked kinase mediate sensitivity to epidermal growth factor receptor inhibition in human hepatoma cells〔J〕.Cancer Res,2008,68(7):2391.
[5]Eastham AM,Spencer H,Soncin F,et al.Epithelial-mesenchymal transition events during human embryonic stem cell differentiation〔J〕.Cancer Res,2007,67(23):11254.
[6]Lang SH,Hyde C,Reid IN,et al.Enhanced expression of vimentin in motile prostatecell lines and in poorly differentiated and metastatic prostate carcinoma〔J〕.Prostate,2002,52:253
[7]Rho JK,Choi YJ,Lee JK,et al.Epithelial to mesenchymal transition derived from repeated exposure to gefitinib determines the sensitivity to EGFR inhibitors in A549,a non-small cell lung cancer cell line〔J〕.Lung Cancer,2009,63(2):219.
[8]Kudo-Saito C,Shirako H,Takeuchi T,et al.Cancer metastasis is accelerated through immunosuppression during Snail-induced EMT of cancer cells〔J〕.Cancer Cell,2009,15(3):195.
[9]Atkinson DM,Clarke MJ,Mladek AC,et al.Using fluorodeoxythymidine to monitor anti-EGFR inhibitor therapy in squamous cell carcinoma xenografts〔J〕.Head and Neck,2008,30(6):790.

