刺山柑多糖提取及其抗炎镇痛作用研究
张瑜,张华,韩博,陈文
(石河子大学药学院/新疆特种植物药资源省部共建重点实验室,石河子832002)
刺山柑多糖提取及其抗炎镇痛作用研究
张瑜,张华,韩博,陈文
(石河子大学药学院/新疆特种植物药资源省部共建重点实验室,石河子832002)
本文主要目的是测定刺山柑中多糖的含量并研究其抗炎镇痛活性。采用水提醇沉法提取多糖,用Sevage法除蛋白、双氧水脱色,并用透析法富集多糖,用苯酚-硫酸显色法测定多糖含量。建立二甲苯致小鼠耳肿胀试验模型,观察多糖的抗炎作用;通过醋酸致小鼠扭体试验和热板试验,观察多糖的镇痛作用。经测定,纯化后刺山柑多糖的含量达36.86%;多糖外敷给药对小鼠耳肿胀的抑制率为71.6%;热板镇痛抑制率为50.1%;扭体反应抑制率为44.4%。本文建立的测定多糖含量的方法简便、准确、重现复好;且刺山柑多糖对急性炎症有明显的抑制作用,对热和化学刺激引起的疼痛具有一定的抑制作用。
刺山柑;多糖;含量测定;抗炎镇痛
刺山柑(Capparis spinosaL.)为白花菜科山柑属植物,又名槌果藤、老鼠瓜、野西瓜,在我国主要分布在新疆、甘肃和西藏等地,在国外主要分布在地中海湾地区。刺山柑是维吾尔医常用药材,具有清除体内异常体液、消肿止痛、祛风、散寒、除湿、畅通阻滞等功效。临床主要用于痛风、风湿性关节炎等骨关节疾病的治疗。在土耳其、印度及中东地区作为一种传统的草药用于滋补、抗炎、抗高血压、降血糖、痛风、化痰、驱虫、利尿、通便等[1-3]。
刺山柑显著的抗风湿疗效,引起人们极大的研究兴趣。目前,国内外对刺山柑化学成分的研究较多[4-7],但究竟是何物质在发挥抗炎镇痛活性尚未可知。高莹莹等[8]研究了刺山柑醇提液具有抗炎镇痛作用,但其抗炎镇痛活性部位尚不明确。文献[9]报道,植物绿舒筋中的多糖具有抗炎镇痛作用,且国内外未见有关刺山柑中多糖的药理活性报道,故本文对刺山柑中的多糖进行研究,期望能够为其治疗风湿寻找到突破口。
本文对刺山柑多糖进行了提取及含量测定,并对多糖液、水提液及醇沉液进行了抗炎镇痛药效比较。观察上述各部分提取物药效差别,试图寻找抗风湿的活性部位,从而为刺山柑多糖的作用机制及其它潜在的药理作用提供基础实验数据,最终为将刺山柑开发成药用制剂服务。
1 材料与方法
1.1 材料
刺山柑干燥果实,购买于石河子济仁堂药店,经石河子大学中药鉴定教研室成玉怀教授鉴定为白花菜科山柑属植物刺山柑(Capparis spinosaL.),标本保存于石河子大学药学院。昆明种小鼠(20±2)g,由石河子大学动物饲养中心提供。TP-300型超声波清洗器(北京天鹏新技术公司)、电子天平(美国奥豪斯科技有限公司)、透析袋(美国联合碳化物公司,相对分子截留量10000)、UV-2401紫外分光光谱仪(日本岛津)、6 mm打孔器、智能热板仪(成都泰盟科技有限公司)。阴性对照液(0.5%CMC-Na)、双氯芬酸二乙胺乳胶剂(北京诺华制药有限公司)、多糖液(自制)、水提液(自制)、醇沉液(自制)、美肤脱毛膏。冰醋酸、二甲苯等试剂均为分析纯。
1.2 方法
1.2.1 刺山柑多糖的提取
通过单因素试验确定的最佳方案为:称取过20目筛的刺山柑粉末50.0 g,用95%乙醇超声提取3次 ,物料比分别为 1∶10、1∶10、1∶8,提取时间分别为 40、30、20 min。过滤 ,合并滤液 ,弃去。滤渣在干燥箱内(50℃)挥干溶剂,称得干燥滤渣38.4 g。滤渣用水超声提取3 次 ,物料比为1∶10、1∶10、1∶8,提取时间分别为40、30、20 min。用纱布滤过,收集滤液,得棕黄色的水取液。将提取液减压浓缩至166 mL,加入95%乙醇调节其浓度至80%,4℃冰箱放置48 h。抽滤,沉淀物依次用适量的无水乙醇、丙酮和石油醚抽洗,置于干燥箱内(50℃)干燥,得灰白色的刺山柑粗多糖4.9 g,得率为9.8%。
1.2.2 粗多糖的纯化
将制得的粗多糖4.9 g溶于100 mL水中,加入40 mL Sevage液(氯仿∶正丁醇 =4∶1),剧烈振荡5 min后,5000 r/min离心10 min。除去蛋白及有机相,剩余水相重复操作5次。除蛋白后的多糖溶液浓缩至50 mL,加入50 mL 10%的 H2O2溶液,置4℃冰箱中放置48 h脱色。将脱色后的多糖溶液装入处理好的透析袋(截留相对分子质量10000),用流动的蒸馏水透析72 h,检测无低聚糖为止。将透析过的多糖液经60℃减压浓缩至25 mL,待自然冷却后加入95%的乙醇调节其浓度为80%,得精制后的多糖0.78 g,得率为1.56%。
1.2.3 多糖的含量测定
对照品溶液的配制:称取105℃下干燥至恒重的无水葡萄糖对照品约0.10 g,精密称定。置250 mL容量瓶中,加水溶解并稀释至刻度,摇匀。即得416.40μg/mL的葡萄糖对照品溶液备用。
苯酚溶液的配制:称取苯酚100.0 g,加铝片0.1 g,和碳酸氢钠 0.05 g,常压蒸馏,收集(180±2)℃馏分。取馏分6.0 g,用蒸馏水定容至100 mL容量瓶中,得6.0%的苯酚溶液。
含量测定方法:精密移取对照品溶液2.0 mL至具塞试管中,加入1.0 mL 6%的苯酚溶液摇匀,垂直悬空加入5.0 mL浓硫酸,室温下放置20 min,取2.0 mL的蒸馏水同法做空白。
最大吸收波长及显色时间的考察:在紫外分光光度计400~800 nm范围内进行扫描,确定最大吸收波长在489 nm处,取葡萄糖对照品溶液按含量测定项下的方法,每隔10 min测定1次,吸光度在50 min内稳定。
标准曲线的制备:精密移葡萄糖取对照品溶液1.2、2.0、2.8、3.6、4.4、5.2、6.0 mL,蒸馏水定容至50 mL容量瓶中,摇匀。分别从各容量瓶中精密移取2.0 mL至具塞试管中,按含量测定方法项下测定多糖含量,以葡萄糖浓度(C)为横坐标,吸光度(A)为纵坐标,进行线性回归。
稳定性:精密移取稀释至一定浓度的刺山柑粗多糖溶液 ,分别于 0、2、4、6、8、10 h,测定其吸光度。
重复性:精密移取稀释至一定浓度的刺山柑粗多糖溶液,按照含量测定项下的方法测定多糖含量,连续测定6份。
加样回收率:向9只试管中分别加入1.0mL的样品液(含多糖20.24μg),再依次加入高、中、低剂量的葡萄糖对照品溶液1.0 mL,各剂量平行做3份。按照含量测定项下的方法测定含量。
样品的测定:精密移取稀释后的粗多糖溶液及透析后的多糖溶液各2.0 mL,按照含量测定的方法重复测定3次,求粗多糖及精制多糖中多糖含量。
1.2.4 刺山柑多糖对二甲苯致小鼠耳肿胀的影响
选取(20±2)g小鼠60只,随机分为5组,雌雄各半,每组12只。第一组:0.5%CMC-Na为阴性对照组;第二组:双氯芬酸二乙胺乳胶剂(扶他林)为阳性对照组;第三组:多糖液组(1 mL相当于0.8 g生药);第四组:水提液组(1 mL相当于0.8 g生药);第五组:醇沉液组(1 mL相当于0.8 g生药)。各组小鼠右耳两面涂抹药液(0.1 mL/耳),1 h后用蒸馏水洗去药液用干棉球擦净,再将每组动物右耳两面涂0.02 mL二甲苯致炎。致炎1 h后,将动物颈椎脱臼致死,沿耳廓基线剪下两耳,用直径6 mm打孔器分别在两耳同一部位打下圆耳片,用分析天平称重。右耳片减去左耳片的重量即为肿胀度[10]。计算各组小鼠耳肿胀度,肿胀抑制率(%)经方差分析做q检验,比较给药组和对照组的差异情况。
抑制率=

1.2.5 刺山柑多糖对热刺激小鼠痛阈值的影响
动物实验前筛选:将小鼠,♀,放在预热至50℃的金属板上,恒温,以小鼠舔后足反应为痛阈指标,将反应潜伏期小于5 s或者大于30 s的小鼠剔除[11]。
将筛选合格的小鼠,♀,随机分为5组,每组12只。第一组:0.5%CMC-Na,为阴性对照组;第二组:双氯芬酸二乙胺乳胶剂(扶他林)为阳性对照组;第三组:多糖液组(1 mL相当于0.8 g生药);第四组:水提液组(1 mL相当于0.8 g生药);第五组:醇沉液组(1 mL相当于0.8 g生药)。逐只置于热板仪上测试给药前的痛阈值2次,取其平均值作为基础痛阈值。将小鼠四足涂抹药液(0.05 mL/足),分别于给药1、2、3 h后测定痛阈值,超出60 s按60 s计。计算镇痛百分率(%)经方差分析做q检验,比较给药组与对照组的差异情况。
镇痛百分率=

1.2.6 刺山柑多糖对醋酸诱发小鼠扭体反应的影响
选取(20±2)g的小鼠60只,雌雄各半,随机分为5组,每组12只。第一组:0.5%CMC-Na为阴性对照组;第二组:双氯芬酸二乙胺乳胶剂(扶他林)为阳性对照组;第三组:多糖液组(1 mL相当于0.8 g生药);第四组:水提液组(1 mL相当于0.8 g生药);第五组:醇沉液组(1 mL相当于0.8 g生药)。实验前12小时,用脱毛膏将小鼠腹毛脱掉,露出光滑的皮肤。各组外敷给药0.25 mL/只,2次。1 h后,每组按0.1 mL/10 g腹腔注射新配制的0.6%的冰醋酸。注射后即开始计时,前3 min为反应潜伏期扭体次数不计,3 min后开始计算扭体次数,持续记录15 min,得出15 min内的扭体次数[12]。计算抑制率(%)经方差分析做q检验,比较各组和对照组的差异情况。

2 结果与分析
2.1 方法学考察结果
标准曲线的回归方程为:A=0.0175C-0.0231,r=0.9994。葡萄糖浓度在9.99μg/mL~49.97μg/mL范围内时,浓度与吸光度呈良好的线性关系。
稳定性:RSD为0.61%(n=6),且吸光度在10 h内稳定。
重复性:RSD为1.7%(n=6),证明本法具有良好的重复性。加样回收率实验结果见表1。
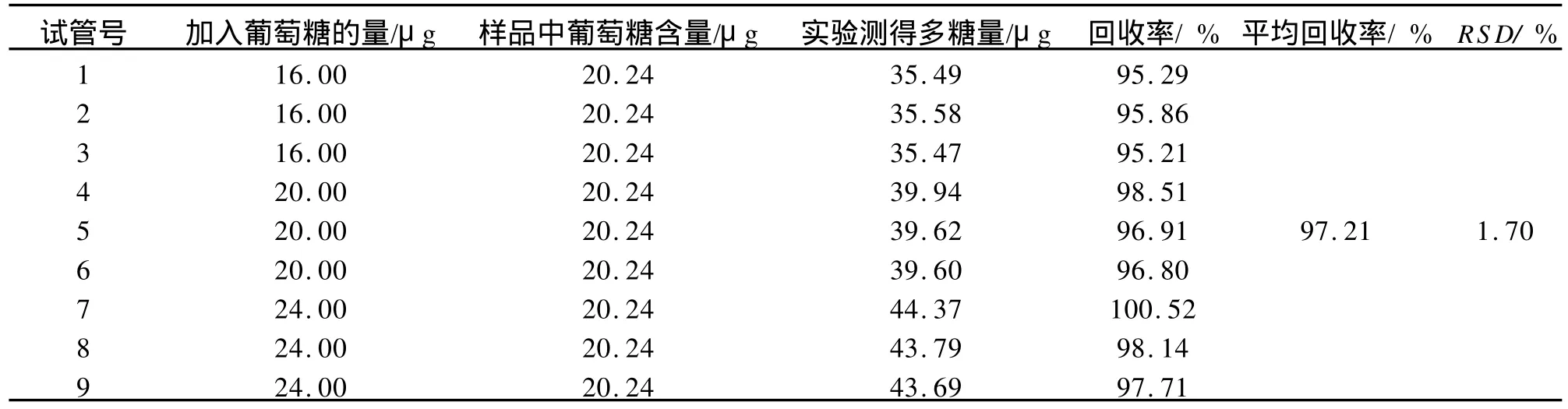
表1 回收率实验结果n=9Tab.1 Consequence of coefficient of recovery n=9
样品含量测定:粗多糖及精制多糖中多糖的含量分别为14.38%、36.86%。
2.2 刺山柑多糖对二甲苯致小鼠耳肿胀实验结果
由表2可知,致炎后,各组小鼠右耳均可见高度红肿。刺山柑多糖对二甲苯致小鼠耳肿胀有明显的抑制作用,抑制率可达到71.6%。水提液及醇沉液的结果说明将水提液醇沉后去除了杂质,药效大大提高,可见多糖有可能为抗炎的活性部位。
通过重复试验表明,阳性药扶他林外敷给药时抗炎效果很差。研究表明扶他林腹腔注射给药具有一定的抗炎作用[9]。本实验给药方式为外敷,可能对其药效发挥有影响,但其根本原因有待进一步研究。建议以后抗炎实验采用外敷给药时,可不选取扶他林做阳性药。
表2 刺山柑多糖对二甲苯致小鼠耳肿胀实验结果 ,n=12Tab.2 Inhibitory effects of polysaccharides from Capparis spinosa L.on xylene-induced auris swellings in mice ,n=12
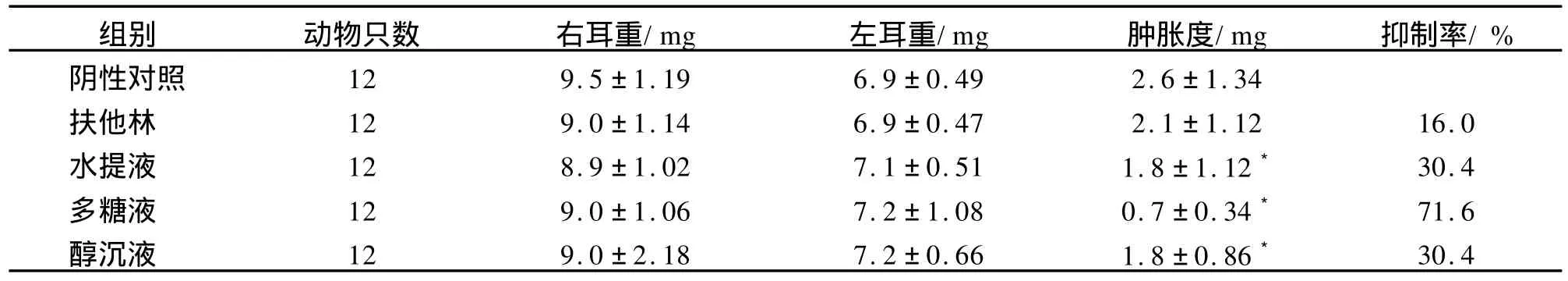
表2 刺山柑多糖对二甲苯致小鼠耳肿胀实验结果 ,n=12Tab.2 Inhibitory effects of polysaccharides from Capparis spinosa L.on xylene-induced auris swellings in mice ,n=12
注:*与阴性对照组比较 P<0.05。
组别 动物只数 右耳重/mg 左耳重/mg 肿胀度/mg 抑制率/%阴性对照 12 9.5±1.19 6.9±0.49 2.6±1.34扶他林 12 9.0±1.14 6.9±0.47 2.1±1.12 16.0水提液 12 8.9±1.02 7.1±0.51 1.8±1.12* 30.4多糖液 12 9.0±1.06 7.2±1.08 0.7±0.34* 71.6醇沉液 12 9.0±2.18 7.2±0.66 1.8±0.86* 30.4
2.3 刺山柑多糖对热刺激小鼠痛阈值实验结果
由表3可知,表面结果表明,刺山柑水提液、多糖液和醇沉液均能提高小鼠热刺激体表的痛阈,水提液的镇痛效果最明显与阳性药扶他林相当。多糖液及醇沉液也具有一定的镇痛作用,但都不及水提液,说明水提液为镇痛活性部位,多糖并非镇痛活性最有效的部位。
表3 刺山柑多糖对热刺激小鼠痛阈值实验结果 ,n=12T ab.3 Analgesic effects of polysaccharides from Capparis spinosa L.on the pain threshold of mice in the hot-plate test ,n=12
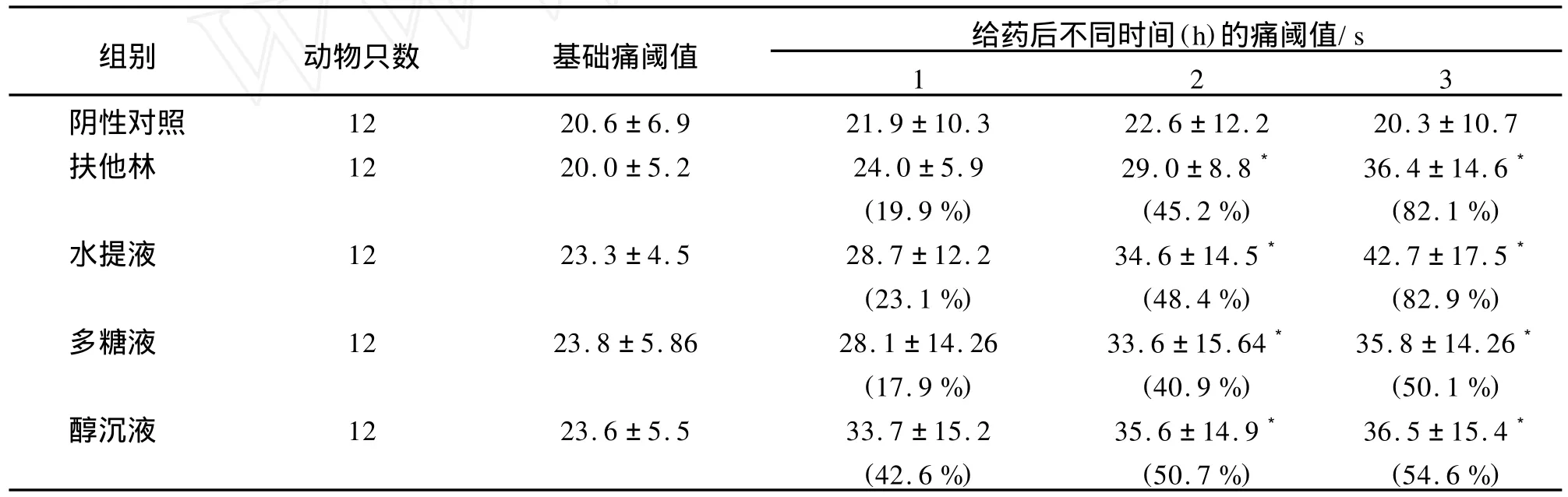
表3 刺山柑多糖对热刺激小鼠痛阈值实验结果 ,n=12T ab.3 Analgesic effects of polysaccharides from Capparis spinosa L.on the pain threshold of mice in the hot-plate test ,n=12
注:括号内的值为给药后镇痛百分率,*与阴性对照组比较 P<0.05。
组别 动物只数 基础痛阈值 给药后不同时间(h)的痛阈值/s 1 2 3阴性对照 12 20.6±6.9 21.9±10.3 22.6±12.2 20.3±10.7扶他林 12 20.0±5.2 24.0±5.9 29.0±8.8* 36.4±14.6*(19.9%) (45.2%) (82.1%)水提液 12 23.3±4.5 28.7±12.2 34.6±14.5* 42.7±17.5*(23.1%) (48.4%) (82.9%)多糖液 12 23.8±5.86 28.1±14.26 33.6±15.64* 35.8±14.26*(17.9%) (40.9%) (50.1%)醇沉液 12 23.6±5.5 33.7±15.2 35.6±14.9* 36.5±15.4*(42.6%) (50.7%) (54.6%)
2.4 刺山柑多糖对醋酸诱发小鼠扭体反应实验结果
由表4可知,腹腔注射醋酸溶液后,各组小鼠均出现腹部收缩、躯体扭曲、后肢伸展及蠕行等扭体反应,水提液对醋酸诱发小鼠扭体反应有明显的抑制作用,刺山柑多糖及醇沉液的效果不及水提液的明显,说明将水提液醇沉后,镇痛活性成分有所损失,建议从水提物中继续寻找镇痛的活性成分。
表4 刺山柑多糖对醋酸诱发小鼠扭体反应实验结果,n=12T ab.4 Analgesic effects of polysaccharidesfrom Capparis spinosa L.on the acetic-induced writhing inmice,n=12

表4 刺山柑多糖对醋酸诱发小鼠扭体反应实验结果,n=12T ab.4 Analgesic effects of polysaccharidesfrom Capparis spinosa L.on the acetic-induced writhing inmice,n=12
注:*与阴性对照组比较 P<0.05。
组别 动物只数 15 min内扭体数 抑制率/%阴性对照 12 40±14扶他林 12 6±3* 86.3水提液 12 12±6* 69.4多糖液 12 22±9* 44.4醇沉液 12 28±14* 29.2
3 讨论
本研究在刺山柑多糖提取过程中,除蛋白时多糖提取液浓度过高会造成多糖的损失,因此操作过程中应注意控制多糖提取液的浓度;双氧水脱色时室温或更高温度会使双氧水分解,导致脱色不彻底,控制温度在4℃时效果最佳;醇沉时应慢加快搅使其充分沉淀,避免多糖损失。
本文采用苯酚-硫酸显色法测定多糖的含量,此方法简便、准确、重复性好,是测定刺山柑多糖的理想方法。本方法中苯酚必须采用新蒸馏的(180±2)℃的馏分,浓硫酸要快速垂直悬空加入,显色才够稳定,测得的多糖含量才最高。
高莹莹等[8]报道的刺山柑醇提液对二甲苯致小鼠耳肿胀的抑制率为55.46%;本实验中多糖的抑制率达到71.6%,表明刺山柑多糖具有显著的抗炎作用,可能为刺山柑抗炎的活性部位。对于醋酸诱发小鼠扭体反应和热板法,刺山柑多糖均有一定的抑制作用,但都不及刺山柑水提液的抑制效果明显,说明水提液对物理和化学刺激引起的疼痛均有较好的抑制作用。而对于热板法高莹莹等[8]研究的醇提物的抑制率达到90.7%,表明醇提液对于物理刺激引起的疼痛有较好的抑制作用。本结果初步明确了刺山柑中抗炎镇痛的活性部位,为继续确定活性成分以及将刺山柑开发成为抗炎镇痛的外用制剂奠定了基础。
[1]新疆植物志编辑委员会.新疆植物志(第二卷,第二分册)[M].乌鲁木齐:新疆科技卫生出版社,1995:35.
[2]Li Maoteng,Wang Yanting,Gan Lu,et al.Establishment of hypocotyls regeneration system of Capparis spinosa L[J].Journal of Huazhong Agricultural University,2007,26(1):25-29.
[3]Chalak L,Elbitar,A.Micropropagation ofCapparis spinosaL.subsp rupestris Sibth.&Sm.by nodal cuttings[J].Indian Journal of Biotechnology,2006,5(4):555-558.
[4]Yili A,Wu T,Sagdullaev B T,et al.Lipids and carbohydrates from Capparis spinosa roots[J].Chem NatCompds,2006,4(1):100.
[5]Calis I,Kuruuzum A,Ruedi P.1H-Indole-3-acetonitrile glycosides from Capparis spinosa fruits[J].Phytochemistry,1999,50:1205.
[6]Yoshikawa K,Kobayashi M,Arihara S.Flower fragrance precurors from flower buds of Citrus unshiu Marcov[J].Natural Medicines,1996,50:176-178.
[7]Matthaus B,Zcan M.Glucosionlate composition of Young shoots and flower bud of Capers(Capparisspecies)growing wild in Turky[J].Agric Food Chemistry,2002,50:7323-7325.
[8]高莹莹,敖明章,万军梅,等.维药刺山柑醇提物抗炎镇痛作用的实验研究[J].中药材,2007,6(30):70-74.
[9]范颖,曾凡波,崔小瑞,等.绿舒筋多糖的抗炎镇痛作用[J].中国药学杂志,2004,39(1):33-35.
[10]王淑英,吴银萍,钱昕,等.炎痛舒搽剂抗炎镇痛的实验研究[J].时珍国医国药,2008,19(10):2460-2461.
[11]孙晓波,李会芳,代竹青.藏药桑当的抗炎镇痛实验研究[J].四川中医,2005,23(4):18-19.
[12]任结梅,卖思慧,郭王利,等.痹痛宁颗粒抗炎镇痛的实验研究[J].海峡药学杂志,2008,20(7):41-43.
Research on the Extraction of Polysaccharides inCapparis spinosaL.and anti-inflammatory and Analgesic Effects
ZHANG Yu,ZHANG Hua,HAN Bo,CHEN Wen
(College of Pharmacy Shihezi University/Key Laboratory of Phytomedicine Resources Modernization of TCM,Shihezi University,Shihezi 832002,China)
The aim of this paper is to determine the content of polysaccharides inCapparis spinosaL.and the anti-inflammatory and analgesic effects of polysaccharides.The polysaccharides were extracted by water and precipitated by alcohol,using sevage to deprotein and dioxogen to decolor,using dialysis to enrich the polysaccharides and henol-sulphuric acid colorimetry to determine the content of polysaccharides.Xylene-induced mouse ear edema model was established to observe the anti-inflammatory effect;acetic acid-induced writhing and hot-plate methods were used to observe the analgesic effects.The polysaccharides content reached to 36.86%after purification;the inhibition rate of auris swellings model in mice,hot-plate test and body contortion were 71.6%,50.1%and 44.4%respectively.The established method of assaying for polysaccharides is simple,accurate and repeatable.The polysaccharides in Capparis spinosa L.showed obvious anti-inflammatory effects on acute inflammatory reactions.The pains induced by heat and chemical stimulus were significantly relieved.
Capparis spinosaL.;polysaccharides;content measurement;anti-inflammation and analgesia
R971+.1
A
1007-7383(2011)02-0205-05
2010-04-25
新疆兵团科技攻关计划项目(2008 GG34),科技人员服务企业行动项目(SQ2009GJ G4101543),新疆兵团科技支疆计划项目(2008ZJ14)
张瑜(1985-),女,硕士生,专业方向为药物新制剂与新剂型。
陈文(1967-),男,教授,从事药物新剂型的研究;e-mail:cw_pha@shzu.edu.cn。

