NK-1受体在慢性砷中毒大鼠背根神经节的表达
赵明,石文艳,曹玉文,朱贺,李丽,马克涛,司军强
(石河子大学医学院,石河子832002)
NK-1受体在慢性砷中毒大鼠背根神经节的表达
赵明,石文艳,曹玉文,朱贺,李丽,马克涛,司军强
(石河子大学医学院,石河子832002)
为探讨慢性砷中毒对大鼠背根神经节(DRG)神经激肽-1(NK-1)受体的表达影响,以此了解砷中毒引起神经损伤的机制。将清洁级2~3月龄SD大鼠30只,体重180~230 g,随机分为正常对照组和砷中毒组,每组15只,雌雄不拘。将NaAsO2配制成浓度为100 mg/L的水溶液供砷中毒组大鼠自由饮用,正常对照组自由饮用自来水,连续喂养3个月后,采用冰冻切片和ABC免疫组化技术,观察NK-1在大鼠DRG神经元的表达。结果显示,NK-1受体在大鼠DRG神经元细胞膜分布广泛,在正常对照组和慢性砷中毒组细胞膜着色呈浅黄色和棕黄色,DRG神经元表达阳性率分别为67.23%±6.31%和96.66%±0.96%,阳性细胞半定量光密度均值分别为0.118±0.012和0.153±0.018,两组比较均差异显著,有统计学意义(P<0.05)。由此可知,慢性砷中毒大鼠背根神经节NK-1受体表达上调,揭示了NK-1受体在砷中毒致神经损伤痛觉信息传递中发挥重要作用。
砷中毒;神经;SP;NK-1
砷是一种在自然界广泛存在神经毒性物质,砷化合物按存在形式分为无机砷和有机砷,通常认为无机砷的毒性大于有机砷化合物,而无机砷中又以三价砷毒性最强。砷中毒可以导致中枢和周围神经系统的损害,各种伤害性刺激都会影响 P物质(Substance P,SP)在各神经系统的合成与释放。1931年,Von Euler和 Gaddum在研究马各组织中乙酰胆碱的分布时,首次发现了一种能引起肠道平滑肌收缩、血管舒张和血压下降的物质SP[1]。SP作为一种肽能递质,它参与神经源性炎症反应、伤害性刺激、免疫调节,并具有痛觉传递及镇痛效应[2]。SP在这两个系统的最终作用位点是脊髓后角,并通过其特异性受体发挥生理作用[3]。SP能作用于多种类型的受体,速激肽家族的神经激肽-1(neurokinin-1)、N K-2和N K-3受体都能与SP相结合,但与N K-1受体的结合力最强,在脊髓水平,SP主要通过N K-1受体传递伤害性信息。
本实验主要采用免疫组织化学技术,观察N K-1受体在慢性砷中毒对DRG神经元细胞膜表达的变化。为阐明N K-1受体在慢性砷中毒致神经损伤机制以及在痛觉信息传递中的作用提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 将清洁级2~3月龄SD大鼠30只(新疆地方病研究所动物饲养中心提供),体重180~230 g,随机分为正常对照组和砷中毒组,每组15只,雌雄不拘。将NaAsO2用蒸馏水配制成浓度为100 mg/L的水溶液供砷中毒组大鼠自由饮用,正常对照组自由饮用自来水。两组均自由采食普通饲料。动物房室温为(20±4)℃,湿度40%~60%,连续喂养大鼠3个月。
1.1.2 试剂 DMEM/F12(GIBCO),兔抗N K1受体(1∶1000),(ABCAM),SP-9002试剂盒(购自北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 取材及标本制备 饲养3个月后,两组大鼠随机各取15只,将大鼠击昏,断头后迅速切开背部皮肤,沿脊柱两侧剪断与之相连的肋骨,取出胸腰段脊柱,从正中将脊柱剖成两半,置于氧饱和的DMEM(Dubecco′s Modified Eagle′s Medium) 内。该液的p H为7.4,渗透压为340 mOsm/kg.H2O。在剖开的椎管内侧取出神经节,在体视显微镜下用精细的角膜剪及游丝钳仔细剪掉相连的神经和周围结缔组织被膜[4]。冰冻切片:(1)包埋:在标本托盘上先铺一层OCT(opti-mum cutting temperature compound)包埋剂待包埋剂即将变白时,把修好的标本置在托盘中间,沿标本四周均匀涂上包埋剂,使组织深埋其中。(2)切片:将切片机置速冻状态,使组织标本快速达到预定温度,用冰冻切片机切取30张,切片厚度为4μm。
1.2.2 免疫组化染色 将固定处理后的玻片(选用同一批次)用3%过氧化氢作用10 min以阻断内源性过氧化物酶干扰,PBS洗涤3遍后10%山羊血清工作液封闭30 min。将玻片分为正常对照组和砷中毒组各15张玻片,PBS洗涤5 min×3次后滴加一抗体50μL,稀释浓度为1∶800,放置于4 ℃冰箱内过夜。PBS洗涤5 min×3次后滴加生物素标记的通用二抗工作液,37℃温箱孵育30 min,PBS洗涤5 min×3次,滴加辣根酶标记的链霉卵白素在玻片上,置于37℃温箱孵育30 min。PBS洗涤5 min×3次,用DAB显色约4 min后自来水冲洗,苏木素复染30 s,梯度酒精脱水、二甲苯透明、待室温下干燥后再用中性树胶封片,显微镜下观察。
1.2.3 结果判定 N K-1受体在大鼠DRG神经元细胞中阳性细胞染色定位于细胞膜,镜下观察玻片显示环绕胞膜有浅黄、棕黄、或更深的棕褐色连续线状染色为阳性细胞标志,根据染色强度和(或)阳性细胞数占所观察视野细胞总数的百分比,判断结果分为3个等级,强阳性(+++)细胞着色呈深棕黄色和(或)阳性细胞数>50%,弱阳性(+)细胞着色呈淡黄色和(或)仅个别细胞染色,阳性细胞数为<5%,中度阳性(++)即阳性细胞数及显色强度介于弱阳性与强阳性之间[5]。阴性(-)未见阳性染色细胞。每张切片在高倍镜下(×200)至少观察5个视野。
1.3 统计学方法
用高清晰HP-9001病理分析处理软件进行分析处理。实验数据均用()表示,用 SPSS 13.0统计分析软件进行数据处理,组间比较用t检验。
2 结果
经冰冻切片和免疫组化,发现N K-1受体在大鼠DRG神经元细胞膜分布广泛,正常对照组和砷中毒组在细胞膜着色呈浅黄色和棕黄色,DRG神经元表达阳性率分别为67.23%±6.31%、96.66%±0.96%(表1),两组阳性率差异无统计学意义。

表1 两组DRG神经元NK-1表达阳性细胞率、光密度均值比较T ab.1 Comparison of Neurokinin-1 receptor’s masc rate and demi-quantitation optical density mean between two group
在免疫细胞化学染色的切片中,正常与对照的切片均为淡黄色,根据染色程度和染色细胞数目判定为轻度染色(图1),呈弱阳性表达。砷中毒组N K-1受体表达阳性细胞的胞浆呈棕褐色,均质状,呈强阳性表达(图2),本实验结果具有免疫学特异性。正常对照组和砷中毒组DRG神经元阳性细胞的半定量光密度均值分别为 0.118±0.012和0.153±0.018,两组比较均有统计学意义,(P<0.05)。

图1 正常对照组 ×200Fig.1 Normal group×200
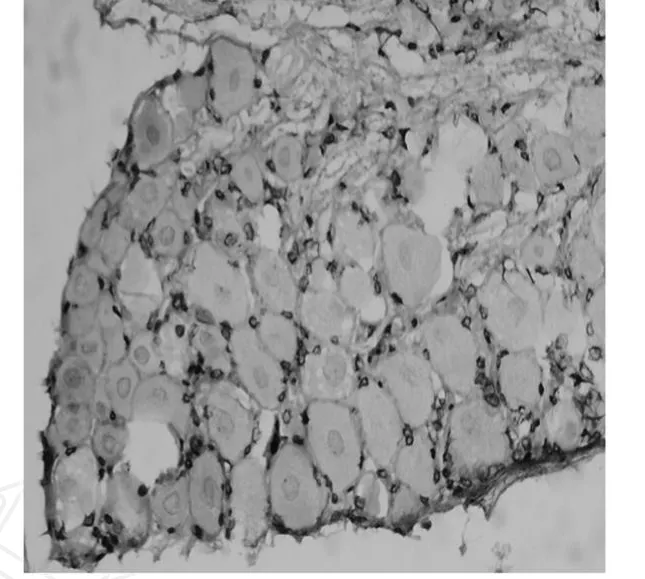
图2 慢性砷中毒组 ×200Fig.2 Chronic arsenic poisoning group×200
3 讨论
本实验应用免疫组织化学方法发现NK-1受体在大鼠DRG神经元细胞膜分布广泛,正常对照组细胞膜着色呈浅黄色,砷中毒组呈棕黄色,正常对照组和砷中毒组DRG神经元表达阳性率分别为67.23%±6.31%和96.66%±0.96%,阳性细胞的半定量光密度均值分别为0.118±0.012和0.153±0.018,两组比较均差异显著,有统计学意义(P<0.05)。研究发现NK-1受体上调,揭示了NK-1受体在砷中毒致神经损伤痛觉信息传递中发挥重要作用。通过检测NK-1受体上调幅度,可以了解砷中毒致神经损伤的程度,有助于早期诊断和及时治疗砷中毒性周围神经病。研究发现,各种电、热、化学等伤害性刺激及脊髓损伤均可引起脊髓背角P物质的释放[6],神经系统不同部位、不同程度的损伤,SP的含量也随着发生变化,SP主要与N K-1受体相结合发挥作用,通过测定N K-1受体的动态变化,可在一定程度上推测神经损伤和功能的恢复情况。本实验发现在砷中毒致神经损伤中N K-1受体上调,揭示在痛觉信息的传递过程中与N K-1受体发挥着重要的作用有关。目前,对慢性砷中毒对神经损伤过程中N K-1受体在痛觉信息传递各环节调制作用的研究资料还比较少,我们需要加强这方面的研究工作,不仅有助于了解N K-1受体在神经损伤中的作用,而且有助于临床对慢性砷中毒的治疗,已有研究证明,N K-1受体非肽类拮抗剂L-703,L-606能减轻创伤,促进病情恢复[7]。因此研究N K-1受体痛觉传递的机制十分必要,有助于我们对慢性砷中毒致神经系统损伤的机制的了解,但砷中毒致神经损伤的机制相当复杂,有待我们进一步研究。
[1]Euler Usv,Gacklam J H.An unidentified depressor substance in certain tissue extracts[J].Journal of Physiology,1931,72:74-87.
[2]Papadopoulos M C,Verkman A S.Aquaporin-4 and brain edema[J].Pediatr Nephrol,2007,22(6):778-784.
[3]Boer P A,Gontijo J A.Nuclear localization of S P,CGRP,and NKI R in a subp-opulation of dorsal root ganglia subpopulation cells in rats[J].Cell Mol Neurobiol,2006,26(2):191-207.
[4]Wu,X-P,Li,Z-W,and Fan,Y-Z.In hibitory effent of substance P on GABA-activation currnets in nerons acutely isolated from rat dorsal root ganglion[J].Chinese Journal of Physiological Sciences,1994,10(4):371-375.
[5]Hu chun-peng,Xu zhen-shan,Song li-hua.The study of P185 protein on the expression of T6-17 cell membrane[J].AnhuiM edical and Pharm aceutical Journal,2010,14(2):178-179.
[6]Vink R,Van den Heuvel C.Substance P Antagonists as a Therapeutic Approach to Improving Outcome Following Traumatic Brain Injury[J].Neurotherapeutics.2010,7(1):74-80.
[7]Tao Ke,Chen Bi,Hu Da-hai,et al.Effects of nonpeptide NK1 receptor an tagon ist L-703,606 on early-stage pathological changes of substance Pimmunoreactive(SP-IR)positive nerves of rats after deep partial-thickness skin scalding[J].Med J Ndfnc,2007,28(1):56-59.
Expression of NK-1 Receptor in Dorsal Root G anglia Neuron of Chronic Arsenism Rats
ZHAO Ming,SHI Wenyan,CAO Yuwen,ZHU He,LI Li,MA Ketao,SI Junqiang
(School of Medicine,Shihezi University,Shihezi 832002,China)
To discuss the expression of Neurokinin-1 receptor in the dorsal root ganglion(DRG)after chronic arsenism for exploring the mechanism of nerve damages included by arsenic,30 SD(weight:180~230g)rats were randomly divided into 2 groups(15 rats in each group):the control group and the arsenic poisoning group.The normal group drank tap water,and the chronic arsenic poisoning group drank tap water containing 100 mg/L NaAsO2.All rats died 3 months later,observe Neurokinin-1 receptor expression in DRG was detected by immunohitochemical method on frozen sections.Neurokinin-1 receptor were distributed widely in DRGcell membrane.The expression is buff and buffy on cell membrane.Compared with its masc rate(67.23%±6.31%,96.66%±0.96%)and demi-quantitation optical density mean(0.118±0.012,0.153±0.018)in two groups respectively.There were significant differences between the normal group and the chronic arsenic poisoning group(P<0.05).The chronic arsenism is concomitant with the significant increase of Neurokinin-1 receptor expression in dorsal horn,and Neurokinin-1 receptor might play an important role in the transmisson of pain information in arsenic poisoning induces nerve damages.
Arsenic Poisoning;nervous;SP;NK-1
R337.3
A
1007-7383(2011)02-0198-03
2010-10-29
赵明(1981-),男,硕士生,专业方向为神经生理和血管生理学。
司军强(1965-),男,教授,从事神经生理和血管生理学研究;e-mail:sijunqiang11@hotmail.com。

