布鲁氏菌 WboA基因的原核表达与鉴定
张艳,陈创夫,张辉,张沾,陈瑞花,张钰,李志强,张俊波
(石河子大学动物科技学院/新疆地方与民族高发病教育部重点实验室,石河子832003)
布鲁氏菌 WboA基因的原核表达与鉴定
张艳,陈创夫,张辉,张沾,陈瑞花,张钰,李志强,张俊波
(石河子大学动物科技学院/新疆地方与民族高发病教育部重点实验室,石河子832003)
为了在大肠杆菌中表达布鲁氏菌的WboA蛋白,并对其进行纯化和鉴定,采用 PCR方法扩增得到WboA基因DNA片段,将其克隆于pET-28a(+)载体中,构建重组表达载体pET-WboA,转化 E.coliBL21,IPTG诱导表达。表达产物经Ni-NTA Agarose亲和层析纯化后,进行 Western blot鉴定及测序。结果显示:重组表达质粒pET-WboA经双酶切及测序鉴定证明构建正确。经 IPTG诱导后,进行SDS-PAGE、western blot分析鉴定,可见约45 ku的外源蛋白带,表明WboA基因在大肠杆菌中得到了表达。用Ni-NTA Agarose试剂盒进行蛋白纯化,获得纯化的WboA蛋白。
布鲁氏菌;WboA基因;原核表达
布鲁氏菌病(Brucellosis),简称布病,是一种由布鲁氏菌引起的人兽共患传染病[1]。在世界200多个国家和地区中,有170多个国家和地区有人、畜布鲁氏菌病的存在和流行。人感染布鲁氏菌病后主要症状表现为长期发热、多汗、关节疼痛及肝脾肿大,动物感染布鲁氏菌病后以不孕、母畜流产和公畜睾丸炎为主要特征。布鲁氏菌分为光滑型和粗糙型两种表现型,主要在于其LPS是否具有O链(光滑型具有O链),一般来说,光滑型布鲁氏菌的LPS含有O链多糖其毒力比粗糙型布鲁氏菌毒力强,并且会干扰血清学诊断[2],这也是目前进行疫苗免疫中的一个瓶颈,而将光滑型布鲁氏菌通过基因工程方法变为粗糙型布鲁氏菌是使其毒力下降的一个有效方法。
布鲁氏菌的WboA基因编码的糖基转移酶与光滑型布鲁氏菌脂多糖的O链合成相关[3-4],WboA基因的缺失或突变将导致光滑型布鲁氏菌的表现型或毒力的改变,从而具有良好的免疫特性[3],WboA基因可作为开发新疫苗的靶基因,其编码的蛋白可能会成为布病鉴别诊断的靶抗原。为此,本实验拟构建了布鲁氏菌WboA基因的原核表达载体,对WboA蛋白进行纯化并研究了其免疫原性,以期为今后建立布鲁氏菌鉴别诊断方法和开发布鲁氏菌新型疫苗提供新材料。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌 E.coliDH5α和 E.coliBL21(DE3)感受态细胞,均购自天根生化(北京)科技有限公司;pET-28a(+)质粒、布鲁氏菌疫苗株M5-90均由本实验室保存。
1.1.2 主要试剂
Taq DNA聚合酶、琼脂糖凝胶DNA回收试剂盒均购自天根生化(北京)科技有限公司;限制性内切酶 EcoR I和 Sal I、DNA Marker、pMD18-T simple载体连接试剂盒购自TaKaRa公司;辣根过氧化物酶标记兔抗羊 IgG-HRP、蛋白Marker均购自上海生工生物工程技术服务有限公司;布鲁氏菌阳性血清为本实验室保存。
1.2 方法
1.2.1 引物设计与合成
根据布鲁氏菌参考株16M的WboA基因序列(GenBank登录号:A Y065979)设计引物,上游引物含有限制性内切酶 EcoR I,下游引物含有Sal I酶切位点。
P1:5′-GAATTCAGTA TGGCTCCGAGACATA TTACA-3′;
P2:5′-GTCGACTATAGCCGATAAACACGCCGAG-3′。
引物由上海生工生物工程技术服务有限公司合成。
1.2.2 目的基因的PCR扩增及产物的纯化
以80℃作用30 min热灭活布鲁氏菌疫苗株M5为模板,用 PCR方法扩增得到 WboA基因片段。
在20.0μL PCR反应的体系中加入:10×反应缓冲液(含 15.0 mmol/L MgCl2)2.0μL,dNTP(各2.5 mmol/L)0.8μL,上游引物 P1(25μmol/L)0.2 μL,下游引物 P2(25μmol/L)0.2μL,模板 1μL,Taq DNA聚合酶(2.5 U/μL)0.5μL,补水至20.0 μL;PCR反应条件:95℃4 min;94℃40 s,57℃40 s,72℃1 min 40 s,30个循环;最后72℃延伸7 min。PCR产物进行1.5%琼脂糖凝胶电泳分析,并以琼脂糖凝胶DNA回收纯化试剂盒进行纯化,操作方法按产品说明书进行。
1.2.3 pMD18-T-WboA的构建及鉴定
将纯化的PCR产物与pMD18-T simple载体4℃连接过夜后,转化 E.coliDH5α感受态细胞。提取质粒,用 PCR和 EcoR I、Sal I双酶切方法鉴定pMD18-T-WboA重组质粒,对鉴定正确的质粒送北京华大基因公司进行DNA测序分析。
1.2.4 pET28a-WboA重组表达质粒的构建
分别将pET-28a(+)质粒和pMD18-T-WboA质粒用 EcoR I和 Sal I双酶切,分别回收pET-28a(+)载体片段和WboA基因片段。将pET-28a(+)载体片段和WboA基因片段4℃连接过夜后,转化E.coliBL21(DE3)感受态细胞。挑取单菌落进行培养,提取质粒,用 PCR和 EcoR I、Sal I双酶切方法进行鉴定。
1.2.5 重组WboA蛋白的诱导表达、检测及纯化
1.2.5.1 重组WboA蛋白的诱导表达
将鉴定正确的阳性重组菌在液体培养基中培养,37℃培养至OD600nm=0.6左右时,加入 IPTG至终浓度为1 mmol/L进行诱导表达。分别于0、2、4、6 h取样,进行 SDS-PAGE电泳分析。
1.2.5.2 重组WboA蛋白的纯化
重组蛋白纯化操作按Ni-NTA Agarose试剂盒说明书进行。将沉淀的菌体重悬于裂解液中,超声破碎-冻溶处理 4次;超声破碎每次10 s,间歇10 s,90次/周期。4℃12000 r/min离心20 min,收集沉淀后用8 mol/L Urea溶解,加入用裂解液Buffer B平衡过Ni-N TA琼脂糖珠,4℃轻柔震荡60 min;用漂洗缓冲液Buffer C、D依次清洗 Ni-N TA琼脂糖珠;最后用Buffer E对Ni-NTA琼脂糖珠进行洗脱,收集洗脱液,进行SDS-PAGE电泳检测。
1.2.5.3 Western blot检测
使用半干式电转印仪,将SDS-PAGE凝胶上的蛋白样品转印到NC膜上;用western blot膜封闭液进行封闭,37℃作用1 h;TBST洗涤3次,每次10 min,加入1∶500稀释的布鲁氏菌阳性血清,37℃作用1 h;TBST洗涤3次,加入1∶5000稀释的辣根过氧化物酶(HRP)标记的兔抗羊IgG,作用1 h,TBST洗涤3次,加入DAB底物显色液进行显色反应。用水终止反应。
2 结果
2.1 目的基因的PCR扩增
以绵羊布鲁氏菌M5株的基因组DNA为模板,进行 PCR扩增,琼脂糖凝胶电泳结果显示与WboA基因(1233 bp)大小相符,约1230 bp核酸条带(图 1)。
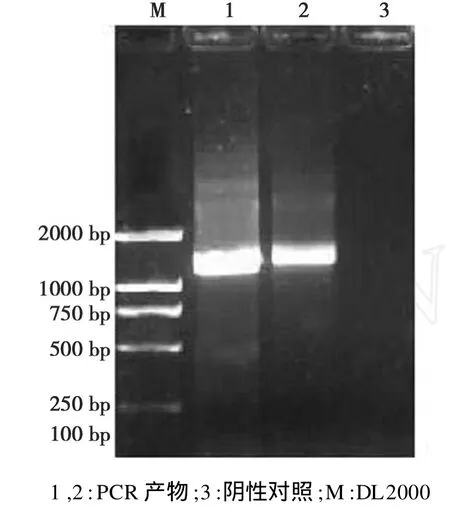
图1 WboA基因的PCR扩增Fig.1 Amplification of WboA gene by PCR
2.2 pMD18-T-WboA的PCR及酶切鉴定
用PCR方法获取WboA基因片段后,将其克隆到pMD18-T simple载体中,转化 E.coliDH5α,提取质粒,用PCR方法和限制性内切酶 EcoR I和Sal I双酶切方法鉴定,DNA序列测定结果表明,扩增所获得的 WboA基因片段与 GenBank登录的WboA基因序列同源率为99.69%。
2.3 pET28a-WboA重组表达质粒的构建及鉴定
pET-28a(+)质粒和pMD18-T-WboA重组质粒分别经EcoR I和Sal I双酶切,回收目的片段4℃连接后,转化 E.coliBL21(DE3)感受态细胞。提取的重组质粒用PCR方法可扩增到约1230 bp的目的条带;用限制性内切酶 EcoR I和Sal I双酶切得到1条约1200 bp的目的条带和1条约5300 bp的pET-28a(+)片段(图 2)。
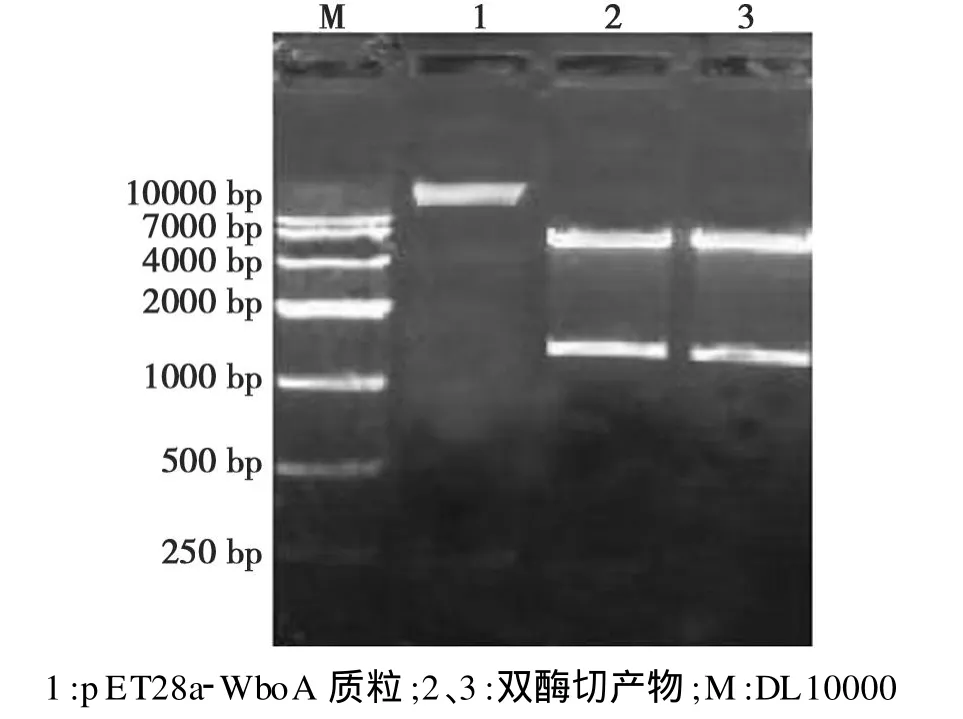
图2 pET28a-WboA质粒酶切鉴定Fig.2 Identification of pET28a-WboA by restriction endonuclease digestion
2.4 重组蛋白WboA的诱导表达
将鉴定正确的含有pET28a-WboA的 E.coli BL21(DE3)经 IPTG诱导培养;分别于0、2、4和6 h取样,进行12%SDS-PAGE电泳分析,结果发现重组蛋白WboA的相对分子量约为45 ku,大小与预期的蛋白分子量基本一致(图3)。
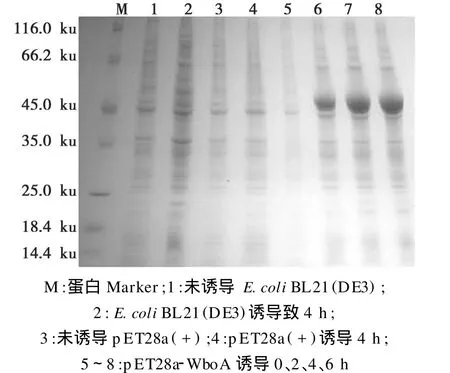
图3 重组蛋白WboA的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expressed WboAfusion protein
2.5 重组蛋白WboA的纯化及western blot分析
采用QIAGEN公司Ni-NTA亲和纯化试剂盒对重组融合蛋白进行纯化,将收集的洗脱液进行SDS-PAGE电泳检测,在约 45 ku处可见纯化的WboA融合蛋白条带(图4);western blot结果显示(图4),表达的重组蛋白WboA具有良好免疫原性。
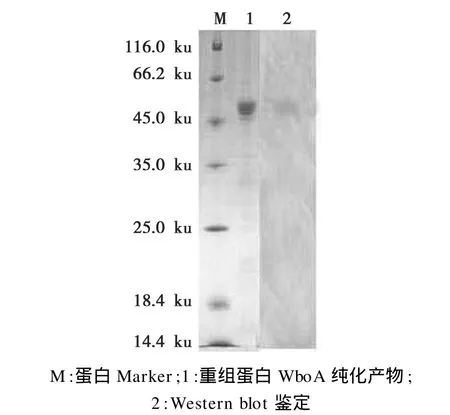
图4 重组蛋白WboA的纯化及western blot鉴定Fig.4 Purification of WboA fusion protein and identification by western blot
3 讨论
布鲁氏菌是一种兼性胞内寄生的致病菌,侵袭力强、传染途径多,布鲁氏菌病是世界五大人畜共患病之一[5],目前对该病尚无根治方法,疫苗接种是预防该病最积极的方法[6]。由于目前使用的弱毒疫苗毒力强,返祖现象严重,甚至引起所接种免疫动物发病;并且存在无法区分自然感染和人工免疫的缺陷,从而影响对该病疫源的探查,使得该病近几年呈回升之势。开发布鲁氏菌病新型疫苗及建立配套的快速检测方法成为目前控制布鲁氏菌病的关键,本研究对布鲁氏菌WboA基因进行了原核表达和纯化,并鉴定了其免疫原性,为今后建立布鲁氏菌鉴别诊断方法提供了新材料。
LPS是布鲁氏菌重要的毒力因子之一[7]。LPS含有O链多糖,使得现在的疫苗因存在血清学干扰而无法推广使用。目前,针对与布鲁氏菌LPS合成有关的基因进行研究成为进一步改造疫苗或建立诊断方法的新方向。布鲁氏菌的WboA基因编码的糖基转移酶,与布鲁氏菌脂多糖的 O链合成相关[3-4],WboA基因的缺失或突变将导致光滑型布鲁氏菌的表现型或毒力的改变。Winter等[8]将布鲁氏菌M16和猪型4号株的WboA基因进行断裂突变后,得到了粗糙型突变株疫苗,其毒性低于它们的原始株,能诱导产生较强的细胞介导的免疫应答,但并不产生O链抗体。Anne等[9]证实去除WboA基因的牛种布鲁氏菌变异株,其毒力要比原代菌株S2308株明显减弱,且在体内其产生抗体抵抗布鲁氏菌的能力要比RB51弱菌苗要强。丁家波等[10]通过同源重组将氯霉素抗性基因完全替代S2株的WboA基因,获得重组粗糙型布鲁氏菌rS2-WboA株。本研究中的小鼠试验显示了rS2-WboA株与原始株S2相似的保护性和更高的安全性。
新型疫苗的发展是当前清除疫病的关键,建立与之配套的检测方法,是新型疫苗推广使用的前提。为此,本实验对布鲁氏菌的WboA基因的原核表达及纯化,证实了 WboA蛋白表达量高,并经过免疫学试验检测该基因具有较好的免疫原性,具备了作为免疫学活性抗原的潜力和优势,这为疫苗的开发和免疫学检测方法的建立提供了候选抗原。
[1]张红星,陈创夫,王远志,等.羊种布鲁氏菌M5290 om p31蛋白原核表达[J].石河子大学学报:自然科学版,2009,27(5):593-596.
[2]王加兰,胡森,郑孝辉,等.光滑型布鲁氏菌LPS单克隆抗体的制备及鉴定[J].中国预防兽医学报,2009,31(8):642-645.
[3]Carmen M F P,Mikeljon N,Ramesh V,et al.Deletion of WboA enhances activation of the lectin pathway of complement in Brucella abortus and Brucella melitensis[J].Infection and Immunity,2001,69(7):4407-4416.
[4]Forestier C,Deleuil F,Lapaque N,et al.Brucella abortus lipopolysaccharide in murine peritonealmacrophages acts as a down-regulator of T cell activation[J].Infect Immun,2000,165:5202-5210.
[5]刘辉,陈创夫,许程剑,等.新疆绵羊种布鲁氏菌 GroEL基因的克隆及序列分析[J].石河子大学学报:自然科学版,2005,23(6):683-686.
[6]唐丽燕,陈创夫,王远志,等.布鲁氏杆菌bp26基因的原核表达及BP26-间接ELISA方法的初步建立[J].石河子大学学报:自然科学版,2009,27(4):437-440.
[7]Lapaque N,Moriyon I,Moreno E,et al.Brucella lipopolysaccharide acts as a virulence factor[J].Curr Opin Microbiol,2005,8:60-66.
[8]Winter A S,Schuring G G,Boyle S m,et al.Protection of BALB/c mice against homologous and heterologous species of Brucella by rough strain vaccines derived from Brucella melitesis and Brucella suis biovar[J].Am J vet Res,1996,57:677-683.
[9]Anne Tibor,Valerie Wansard,Valery Bielartz.Effect of omp10 or omp19 deletion on Brucella abortus outer membrane properties and virulence in mice rose-may delrue[J].Vet Microbio1,2002,27:257-262.
[10]丁家波,程君生,牟巍,等.布鲁氏菌 S2WboA基因缺失株的构建及免疫效果[J].中国农业科学,2008,41(8):2448-2453.
Expression and Identification ofWboAGene of Brucella
ZHANG Yan1,CHENG Chuangfu1,ZHANG Hui1,ZHANG Zhan1,CHEN Ruihua1,ZHANG Yu1,LI Zhiqiang1,ZHANGJunbo1
(College of Animal Science and Technology,Shihezi University/Key Laboratory of Xinjiang Endemic and Ethnic Disease,Shihezi 832003,China)
To express WboA fusion protein inE.coliBL21 and purify and identify the expressed product,the full-length WboA gene was synthesized by PCR and cloned into vector pET-28a(+).The constructed recombinant plasmid pET-WboA was transformed to competentE.coliBL21 expression under induction of IPTG.The expressed protein was purified with Ni-NTA Agaros,identified by Western blot,and the full-lengthWboAgene was sequenced.Results showed that both restriction analysis and sequencing proved that recombinant plasmid pET-WboA was constructed correctly.The SDS-PAGE and western blot analysis indicated that the recombinant protein induced by IPTG was about 45 ku.The recombinant protein was purified with Ni-NTA Agaros.
Brucella;WboAgene;prokaryotic expression
S858.235.7;Q78
A
1007-7383(2011)02-0189-04
2010-10-25
(1973)计划国家重点基础研究发展项目(2010CB530203),国家自然科学基金项目(30960288、31001046)
张艳(1984-),女,硕士生,专业方向为布鲁氏菌致病机理;e-mail:jingsi1000@163.com。
陈创夫(1962-),男,教授,博士生导师,从事布鲁氏菌致病机理研究;e-mail:ccf-xb@163.com。

