库尔勒香梨mRNA差异显示技术体系的建立
张飞,牛建新,叶春秀,刘娜,高静涛,朱天丁
(石河子大学农学院园艺系,石河子832003)
库尔勒香梨mRNA差异显示技术体系的建立
张飞,牛建新,叶春秀,刘娜,高静涛,朱天丁
(石河子大学农学院园艺系,石河子832003)
为了研究库尔勒香梨萼片脱落与宿存的本质,试验以库尔勒香梨盛花前期的同一时间同一棵树同一花序的第2位序花和第4序位花为试验材料,采用mRNA差异显示的方法进行研究。扩增体系为20μL:cDNA 2.0μL,10μmol/L 锚定引物2.0μL,10μmol/L 随机引物2.0μL,2.5 mmol/L dNTPs 2.0μL,5 U/μL Taq 0.25μL,10×PCR buffer 2.5μL,ddH2O 9.25μL。结果显示,扩增产物经6%的非变性聚丙烯酰胺凝胶电泳、银染,获得了比较清晰的差异条带,回收并克隆差异条带,分离得到一些差异表达的片段,优化了库尔勒香梨mRNA差异显示技术,为克隆差异表达基因的全长cDNA奠定了良好基础。
库尔勒香梨;萼片;体系;mRNA差异显示
mRNA差异显示(differential display reverse transcription-PCR,DDRT-PCR)技术是根据高等生物成熟的mRNA都带有polyA的特性,用特定的锚定引物反转录后,进行 PCR扩增,建立起来的可将不同细胞系、不同组织间,或同一细胞系、同一组织不同条件下差异表达基因分离和克隆的PCR技术[1]。现已被广泛的用于植物的各类激素诱导的特异基因[2-4]、胁迫诱导的特异基因[5-10]、杂种优势机理[11-13]和植物个体发育的分子机制[14-16]等方面的研究。
库尔勒香梨(Pyrus brestschneideri Rehd),属新疆梨种,是一个古老的地方优良品种,其果实大小适中,皮薄肉脆,细嫩多汁,维生素C含量丰富且耐贮藏,尤以芳香味最为独特。已出口至美国、澳大利亚、欧盟等十多个国家和地区。但是,由于受到遗传特性的影响,同一棵树上同一花序不同序位的花萼片脱落比率有较大差异,而宿萼果对库尔勒香梨的商品品质影响较大[17-18]。前人在花序序位、植物生长调节剂、砧木类型、授粉、修剪以及光照等生理因素影响库尔勒香梨萼片脱落与宿存上进行了研究[19-27],但尚未见有关萼片宿存和脱落机理方面的研究。库尔勒香梨有萼片脱落和宿存之分,同一花序中基部花朵形成的果实花萼多为宿存,随着序位升高,花萼脱落能力增强,因此,根据mRNA差异显示研究脱萼和宿萼的差异表达基因,对阐明脱萼机理具有重要的意义。
本试验通过对DDRT-PCR技术进行了优化研究,获得了适合库尔勒香梨DDRT-PCR体系和程序,旨在为筛选控制库尔勒香梨萼片脱落相关基因的片段以及全长基因奠定良好的基础。
1 材料
1.1 材料
1.1.1 试材
试验所用材料为采至新疆库尔勒沙依东园艺场的库尔勒香梨花序。在香梨的盛花前期采样,采样时只采同一棵树的第2序位花和第4序位花,并且不同序位的花都做标记,箔纸包好液氮速冻,带回实验室-70℃保存。
1.1.2 试剂
锚定引物(B0327-B0329)和随机引物(B0301-B0326)以及RNasin购于上海生工生物工程技术服务有限公司(表 1)。DNase I(RNase Free)及 MMLV购于宝生物工程(大连)有限公司,Taq酶和dNTPs购于广东东盛生物科技有限公司。
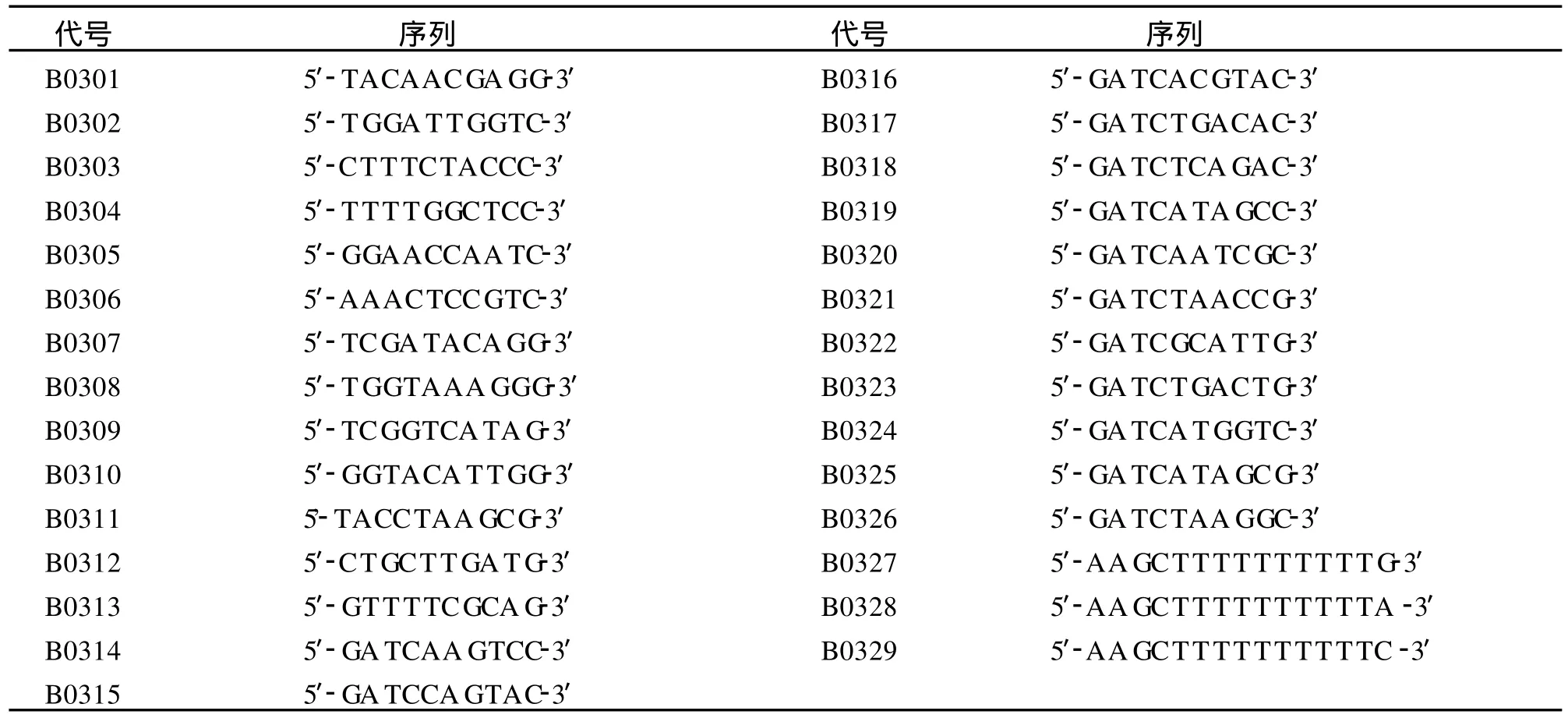
表1 DDRT-PCR引物Tab.1 The primers of DDRT-PCR
1.2 方法
1.2.1 花总RNA的提取、纯化、完整性及质量检测
RNA的提取方法参照文献[28]中的试验方法,并做一定的改进,在原有的基础上多抽提1次。总RNA的纯化参照文献[29]中的实验方案。用1.2%琼脂糖凝胶电泳检测RNA的完整性,同时利用核酸蛋白仪(NANODrop 2000)测定总 RNA OD260/OD280的比值。
1.2.2 cDNA第1链的合成
合成体系为25μL体系:总 RNA 5.0μg,DEPC·H2O 8.5μL,互补引物 10μmol/L 2.0μL,70 ℃水浴5 min,冰浴5 min;在冰上依次加入5×M-MLV buffer 5.0μL,dNTPs(2.5 mmol/L)2.5μL,RNasin(40 U/μL)1.0μL,42 ℃水浴5 min,离心5 s,加入 MMLV(200 U/μL)1.0μL,42 ℃水浴1 h,立即放入92℃水浴4 min灭活,冰浴4 min,即可获得cDNA,立即进行PCR或者-20℃保存。
1.2.3 DDRT-PCR及其产物的琼脂糖凝胶电泳检测
20μL的扩增体系:10×PCR buffer 2.5μL,2.5 mmol/L dNTPs 2.0μL,10μmol/L锚定引物2.0μL,10μmol/L随机引物 2.0μL,cDNA 2.0 μL,5 U/μL Taq 0.25μL,ddH2O 9.25μL。PCR扩增程序为:94℃4 min,94℃1 min,42℃2 min,72℃2 min,40个循环,72℃10 min,4℃保存。用2.0%琼脂糖凝胶电泳检测 RT-PCR产物,如果实验组和对照组的条带适中清晰,就可以进行下一步的聚丙烯酰胺凝胶电泳。
1.2.4 6%聚丙烯酰胺凝胶电泳及其银染
6%聚丙烯酰胺凝胶厚度为0.2 mm,面积为18 cm×14 cm。电极缓冲液为l×TBE,800 V电压预电泳30 min后,取5.0μL PCR扩增产物与1.0μL甲酰胺上样缓冲液混合均匀,上样,相同条件下电泳至二甲苯青到距凝胶底部1/3处,电泳结束后立即对凝胶进行银染。
银染步骤如下:
1)固定。在10%冰乙酸溶液中固定,在水平摇床上充分振动至二甲苯青完全褪色,然后用去离子水快速冲洗2次;
2)银染。用1.0 L 1.0 g/L的AgNO3溶液(现配)染色20 min,为了染色均匀,将胶板放入染色液后在水平摇床上充分振动。20 min后用去离子水迅速清洗凝胶2次。
3)显色。在1.0 L 30.0 g/L的NaOH溶液中加5.0 mL甲醛作为显色液(现配),水平摇床上充分振动直到所有条带显出来为止。
4)终止。10%冰乙酸终止显色5 min,再用去离子水冲洗干净。
1.2.5 差异带的回收、二次扩增以及琼脂糖电泳检测
用95%的酒精洗净凝胶表面,用手术刀将差异条带切下,移至1.5 mL离心管中。加入30μL TE溶解,用灭菌的枪头将凝胶捣碎,-20℃冷冻20 min,沸水浴20 min,-20℃冷冻20 min,12000 r/min离心10 min,吸取上清作为二次 PCR的模板。二次PCR的体系和程序同一次PCR的一样。
取二次扩增后的反应液,用2.0%的琼脂糖凝胶进行电泳检测,对二次扩增后得到单一条带的或主带很亮的并且和聚丙烯酰胺凝胶电泳大小一致的PCR产物进行纯化回收,用于阳性克隆鉴定。
2 结果与分析
2.1 库尔勒香梨总RNA的提取结果
用1.2%琼脂糖凝胶电泳检测RNA的完整性,电泳时出现了清晰的28 S、18 S、5 S谱带,表明提取的总RNA没有发生降解。同时利用核酸蛋白仪(NANODrop 2000)测得总 RNA的含量 OD260/OD280(μg/μL)为 1.8~2.0,说明提取的总 RNA 基本无杂蛋白、多糖和酚类等杂质的干扰,符合本试验的要求。
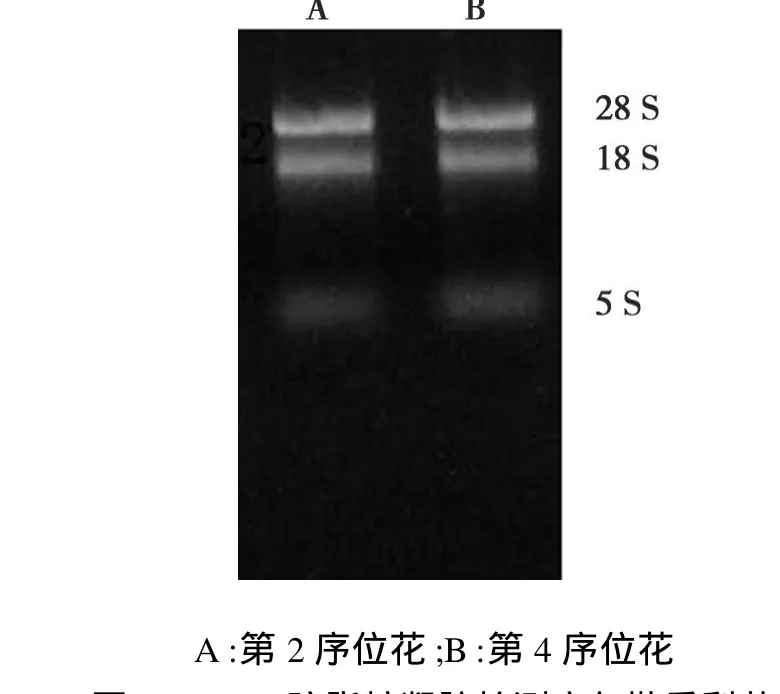
图1 1.2%琼脂糖凝胶检测库尔勒香梨花的总RNA提取结果Fig.1 Gel electrophoresis map(1.2%)of total RNAfrom the same tree and same time of K orla Fragrant Pear
2.2 反转录cDNA的PCR扩增
本实验所采用的M-MLV及其 Taq酶可以获得很好的扩增效果。本实验以库尔勒香梨花的总RNA为模板,进行cDNA第一链的合成,经过对Taq酶的种类与浓度的比较、模板的用量、dNTPs浓度、引物浓度、退火温度等因素进行摸索筛选,得到了优化的 PCR反应体系。扩增产物在2.0%的琼脂糖凝胶上显示,由同一对引物扩增的实验和对照样品的cDNA条带清晰,而且条带数量适中,基本上相似(图2、图3),说明扩增的结果较理想,没有出现非特异性扩增,这样有利于在聚丙烯酰胺凝胶上分离得到真正的差异条带。

图2 锚定引物B0328的DDRT-PCR琼脂糖凝胶电泳Fig.2 Agarose gel eletrophoresis of DDRT-PCR by anchored primer B0328
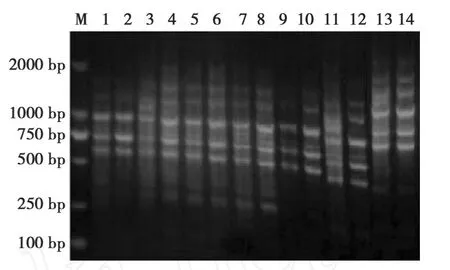
图3 锚定引物B0329的DDRT-PCR琼脂糖凝胶电泳Fig.3 Agarose gel eletrophoresis of DDRT-PCR by anchored primer B0329
2.3 6%聚丙烯酰胺凝胶电泳及银染
本实验根据mRNA差异显示的原理,选择了3个锚定引物和26种随机引物,共78个引物组合进行mRNA差异显示实验。将PCR产物在6%聚丙烯酰胺凝胶上电泳后银染显色,显色效果较好(图4),可以比较容易挑选差异条带,能够满足本实验,初步筛选了一些差异条带。将差异条带直接从凝胶上切下来,通过反复冻融的方法回收差异片段,统计分析的结果表明,多数引物之间组合的cDNA扩增条带数目为100~750 bp的20~50条。从扩增出来的条带来看,各对引物组合扩增效果较好,每个泳道的cDNA条带均匀清晰,表明本实验建立的mRNA差异显示方法适用于库尔勒香梨的DDRT-PCR分析。

图4 部分引物组合的DDRT-PCR的聚丙烯酰胺凝胶(6%)电泳图Fig.4 Part of mRNA differential display gels showing the differences in mR NAfrom the secondflower and the fourthflower
2.4 差异条带cDNA的重扩增
对回收后的差异条带用相同的条件进行二次PCR扩增,将重扩增的产物在2.0%琼脂糖凝胶上进行电泳,大部分回收的差异片段都能重新扩增成清晰的单一条带(图5),回收片段大小大部分为100~750 bp,可以用于进一步的克隆和分析。但也有一些回收的差异条带重扩增不理想,有部分差异在扩增出主带的同时,还扩增出一些弱带,可能是cDNA中包含随机引物结合位点或差异条带中包含分子量相等的其它片段。
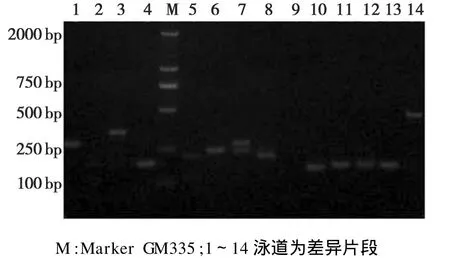
图5 部分差异片段的二次扩增结果g.5 Reamplification of partial differential cDNA segments
3 讨论与结论
利用差异表达分离基因的方法较多。基因表达连续性分析(serial analysis of gene expression,SAGE)[30],缺点:需要大量的测序工作,建立 SA GE库所需要的mRNA量较大;差减杂交(subtraetire hybridization,SH)[31],缺点:需要 mRNA的量较大,不易于分离到表达丰度低的转录本;抑制性消减杂交法(suppressionsubtractivehybridization,SSH)[32],缺点:1次只能比较2个样品之中仅在tester中表达的基因,仅能分离在tester中表达,而在driver中不表达的基因,不能反映2个样品之间基因在表达最上的差异;表达序列标签(expressed sequence tag,EST)[33],缺点:仅可以来比较cDNA文库间基因表达的有或无的差异,无法比较基因表达量上的差异,必须用未均一化的cDNA文库;微阵列杂交(microarray hybridization,MH)[34],缺点:价格昂贵,使用该方法的成本与其他方法相比较高,而且需要大量的RNA,需要完善的基因数据信息,无法获得未知基因,需要一系列克隆或已知基因的寡核苷酸,对于未完成测序工作的生物样本不适用该方法。然而,本实验只能从库尔勒香梨的单个花中提取RNA,每次只能获得少量的RNA,对于以上需要大量mRNA的方法无法满足。所以,实验中所用的DDRT-PCR方法对于mRNA低表达量的库尔勒香梨比较适合。一次试验只需要5.0μg的总RNA即可。由于具有简便、高效等优点,DDRTPCR技术已被广泛应用于不同组织或细胞,以及同一组织不同时期新基因的鉴定研究中。DDRTPCR技术原理简单、操作简便,通过逆转录、PCR和电泳,实验步骤简单,差异条带的获得时间比较快;理论上,通过3条锚定引物和26条随机引物组合,即可显示几乎所有的mRNA。实验过程中可以步步验证和比较,及时发现实验过程中的问题。本实验采用mRNA差异显示技术结合改进的银染显色法,初步筛选获得了一些和激素调节有关的差异条带,在后面的试验中通过 RT-PCR验证,表明重复性较好。
本实验以库尔勒香梨花的总RNA为模板,进行cDNA第一链的合成,经过对 Taq酶的种类与浓度的比较、模板的用量、dNTPs浓度、引物浓度、退火温度等因素进行摸索筛选,得到了优化的PCR反应体系和程序,每对适合的引物组合都能扩出适量清晰的cDNA条带。鉴于以上条件的摸索结果,本实验建立了库尔勒香梨花的mRNA差异显示技术的体系,电泳后cDNA带型比较清晰,数量适中,而且重复性好。实验回收得到的差异条带主要是有和无的选择,个别的是表达强弱的选择,结合银染法能很明显看到差异条带分布,而且也方便回收。这说明扩增的结果比较理想,这样有利于在聚丙烯酰胺凝胶上分离得到真正的差异条带。
[1]Peng Liang,Pardee A B.Differential display of eukaryotic messenger RNA by means of polymerase chain reaction[J].Science,1992,257:967-971.
[2]Mazeyrat F,Mouzeyar S,Nicolas P,et al.Cloning,sequence and characterization of a sunflower(Helianthus annuusL.)pathogen-induced gene showing sequence homology with auxin-induced genes from plants[J].Plant Molecular Biology,1998,38(5):899-903.
[3]Camille Roux,Jürg Bilang,Benjamin H,et al.Identification of new early auxin markers in tobacco by mRNA differential display[J].Plant Molecular Biology,1998,37(2):385-389.
[4]Chen X,Wang B,Wu R.A gibberellin-stimulated ubiquitinconjugating enzyme gene is involved inα-amylase gene expression in rice aleurone[J].Plant Mol Biol,1995,29(4):787-795.
[5]Zhang C K,Ping Lang,Fenny Dane,et al.Cold acclimation induced genes of trifoliate orange(Poncirus trif oliata)[J].Plant Cell Rep,2005,23(10/11):764-769.
[6]Turgay Unver,Osman Bozkurt,Mahinur S Akkaya.I-dentification of differentially expressed transcripts from leaves of the boron tolerant plantGypsophila perf oliataL[J].Plant Cell Rep,2008,27(8):1411-1422.
[7]Zhou B J,Wang X P,Wang YJ.cDNA cloning,expression,protein purification,and characterization of a novel glyoxal oxidase related gene fromVitis pseudoreticulata[J].Biologia Plantarum,2007,51(3):458-466.
[8]Wang C L,Fan J J.Using mRNA differential display technology separating rice bacterial blightresistance-related genes[J].Acta Agronomica Sinica,2005,31(10):1373-1376.
[9]Jacobs A.Molecular analysis of cold resistance in chilean potato species[J].Swedish University of Agriculture Science,1996,305:15.
[10]Mario Houde,Jean Danyluk,Jean-Francois Laliberté,et al.Cloning,characterization,and expression of a cDNA encoding a 50-kilodalton protein specifically induced by cold acclimation in wheat[J].Plant Physiol,1992,99:1381-1387.
[11]程宁辉,杨金水,高燕萍,等.玉米杂种一代与亲本基因表达差异的初步研究[J].科学通报,1996,41(5):451-454.
[12]Sun Q X,Ni Z F,Liu Z Y.Differential gene expression between wheat hybrids and their parental inbreds in seedling leaves[J].Euphytica,1999,106:117-123.
[13]Wang Z K,Ni Z F,Wu H L,et al.Heterosis in root development and diVerential gene expression between hybrids and their parental inbreds in wheat(Triticum aestivumL.)[J].Theor Appl Genet,2006,113:1283-1294.
[14]Cui K R,Xing G S,Qin L,et al.Differential expression of the gene in early somatic embryogenesis ofL ycium barbarumL.by modified mRNA Differential Display[J].Gene,1998,20(5):16-19.
[15]王学德,朱英国.水稻雄性不育与可育花药的mRNA差别显示和cDNA差别片段的分析[J].中国科学(C辑),1998,28(3):257-263.
[16]Cho J K,Koo D H,Nam Y W,et al.Isolation and characterization of cDNA clones expressed under male sex expression conditions in a monoecious cucumber plant(Cucumis sativusL.cv.Winter Long)[J].Euphytica,2005,146:271-281.
[17]亚合甫·木沙,牛建新,席万鹏.影响库尔勒香梨宿萼果率因素的调查[J].中国果树,2007(4):13-15.
[18]亚合甫·木沙,热洋古丽·木沙.PBO对库尔勒香梨果形与品质的影响试验[J].山西果树,2007(1):9.
[19]任莹莹,李 疆,覃伟铭,等.库尔勒香梨萼片脱落与宿存特性及其调控的初步研究[J].新疆农业大学学报,2007,30(1):25-29.
[20]何子顺,牛建新,邵月霞.库尔勒香梨果实萼片脱落与宿存研究概述[J].中国果菜,2006(2):10-11.
[21]井春芝,王允栋.库尔勒香梨矮化中间砧的筛选试验初报[J].北方果树,2002(1):13.
[22]徐庆岫.授粉条件对库尔勒香梨果实性状的影响[J].果树科学,1997,14(2):113-114.
[23]梅龙珠,成垒,周杰民.多效唑对库尔勒香梨幼树生长和结果的影响[J].中国果树,1995(2):20-21.
[24]邵月霞,牛建新,何子顺.库尔勒香梨果实脱萼与宿萼的研究概述[J].现代农业科技,2007(10):46,49.
[25]阮晓,王强,周疆明.香梨的果表突起和落果裂果与果实中内源激素之间的关系(简报)[J].植物生理学通讯,2001,37(3):220-221.
[26]李林,何晓霞.植物生长调节剂对库尔勒香梨脱落与宿存调控的研究[J].新疆林业,2008(1):29-30.
[27]张大海.库尔勒香梨果形变化规律研究[J].新疆农业科学,1999(6):261-262.
[28]何梅,赵英,牛建新等.库尔勒香梨总 RNA的快速提取方法[J].石河子大学学报:自然科学版,2004,22(6):474-476.
[29]余远.利用mRNA差异显示技术分离西瓜核雄性不育基因相关cDNA片段的研究[D].杨凌:西北农林科技大学,2006.
[30]Velculescu V E,Zhang L,Vogelstein.Serial analysis of gene expression[J].Science,1995,270(5235):484-487.
[31]Sargent T D,Dawid I B.Differential gene expression in the gastrula of Xenopus laevis[J].Science,1983,222(4620):135-139.
[32]Eisen M B,Spellman P O,Brown P O.et al.Cluster analysis and display of genome-wide expression paterns[J].Proc Natl Acad Sci USA,1998,95(25):14863-14868.
[33]Adams M D,Kelly J M,Gocayne J D,et al.Complementary DNA sequencing:expressed sequence tags and human genome project[J].Science,1991,252(5013):1651-1669.
[34]Walter Lorenz W,Jeffrey F D Dean.SAGE profiling and demonstration of differential gene expression along the axial developmental gradient of lignifying xylem in loblolly pine(Pinus taeda)[J].Tree Physiology,2002,22(5):301-310.
Establishing the System of Korla Fragrant Pear mRNA Differential Display Technology
ZHANG Fei,NIU Jianxin,YE Chunxiu,LIU Na,GAO Jingtao,ZHU Tianding
(Department of Horticulture,College of Agriculture Shihezi University,Shihezi 832003,China)
In this study,DDRT-PCR was used to study the nature of calyx leaving and persistent from fruit of Korla fragrant pear.We chose the flowers of early full bloom,and total RNA was extracted from the second flowers and the fourth flowers of the same inflorescence of the same tree at the same time.PCR reactions(20μL)were performed with 2.0μL RT reaction first strand,10μmol/L anchor primer 2.0μL,10μmol/L arbitrary primer 2.0μL,2.5 mmol/L dNTPs 2.0μL,5 U/μL Taq DNA polymerase 0.25μL,10×PCR buffer 2.5μL,ddH2O 9.25μL.The PCR product was confirmed by 6%non-denaturing polyacrylamide gel electrophoresis followed by silver staining,access to a relatively clear-cut difference between bands,and then recovering differential bands and cloning,preliminary isolating and getting some of differential genes between the second flowers and the fourth flowers.Finally,the Korla fragrant pear mRNA differential display was established,so this research laid a foundation for cloning full length of relative cDNAs.
Korla fragrant pear;calyx;system;DDRT-PCR
S661.23;Q781
A
1007-7383(2011)02-0173-06
2010-11-29
国家科技攻关计划引导项目(2003BA546C),国际科技合作(2009YD32),新疆兵团“科技人员服务南疆专项”(2010GG59)
张飞(1984-),男,硕士生,从事果树生物技术研究;e-mail:zhangfei.1984@163.com。
牛建新(1962-),男,教授,博士生导师,从事果树与生物技术研究;e-mail:njx105@163.com。

