可循环的FeCl3·6H2O/乙醇催化体系催化mannich反应
邵鸿斌,郭红云
(浙江工业大学 化学工程与材料学院,杭州 310032)
可循环的FeCl3·6H2O/乙醇催化体系催化mannich反应
邵鸿斌,郭红云
(浙江工业大学 化学工程与材料学院,杭州 310032)
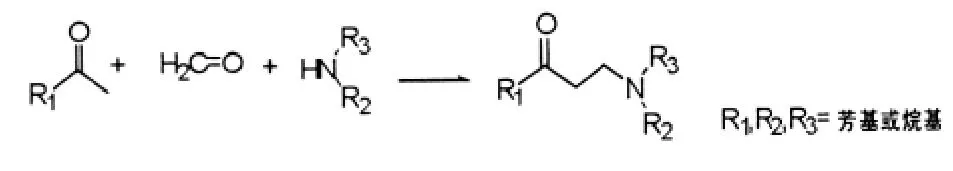
实验以FeCl3·6H2O为催化剂、乙醇为溶剂的绿色可循环催化体系,催化醛、胺和酮的一锅法Mannich反应。反应在室温条件下进行,完成后,产物通过过滤、重结晶即可得到,产率高达85%。滤液可作为催化体系循环使用。与传统的酸催化剂相比,FeCl3·6H2O相对稳定,安全,毒性较低,廉价易得。FeCl3·6H2O/乙醇催化体系未经进一步处理可连续循环催化反应四次,效率稍微降低,但是产率没有明显下降。
一锅法;FeCl3·6H2O;乙醇;催化; Mannich 反应;循环
Mannich及Mannich类型反应是一种重要的构建C-C键反应,也是制备β-氨基酮的经典反应。Mannich碱及其衍生物是许多药物和天然产物的重要中间体[1,2],也广泛应用于炸药、农药、医药、染料、涂料、缓蚀剂[3](反应式 1)等方面。
反应式1 Mannich碱缓蚀剂的合成
因此,发明新的Mannich反应催化剂在过去几十年里引起了科学工作者的广泛兴趣[4]。目前有 Lewis酸[5,6]、Brönsted 酸[7]、杂多酸[8]、trögers 碱[9]、 碱 性 离 子 液 体[10]、 酸 性 离 子 液 体[11]、 金 属 盐[12]、金属[13]和有机催化剂[14]等已被开发。 同时,有些 则 需 要 超 声 波[15]和 微 波 辐 射[16]辅 助 反 应 的 进行。在这些已经发表的文章中,有的催化剂制备步骤复杂,价格昂贵,不能循环使用;有的毒性较强;有的操作过程繁多,不利于工业化等等。所以寻求低毒无毒的催化剂且操作过程简单安全的反应是一种必然趋势。
近年来,采用低毒低污染、绿色无污染的有机反应减少或代替有害物质的排放越来越受到人们的关注。例如:利用可循环的催化剂、无毒无挥发的溶剂等。Lewis酸六水三氯化铁可以作为催化剂,也可作为弱氧化剂。它是一种价廉、易得的固体,腐蚀性和污染小,使用方便、安全的绿色催化剂[17]。 因此,我们尝试用六水三氯化铁催化Mannich反应。所有产物经红外、核磁1H确认。
1实验部分
1.1 试剂与仪器
1.1.1 试剂
无水乙醇;苯甲醛;正丁醛;对甲基苯甲醛;对甲氧基苯甲醛;间溴苯甲醛;对氟苯甲醛;环己酮;对硝基苯乙酮;甲氧基苯乙酮;FeCl3·6H2O。它们均为分析纯。
1.1.2 仪器
熔点仪 X-4(北京泰克仪器有限公司);傅立叶变换红外光谱仪Nicolet 6700(美国Thermo公司);核磁共振波谱仪AVANCEⅢ(500M)(瑞士Bruker公司)。
1.2 实验操作
1.2.1 Mannich反应
以模型反应(苯甲醛、苯乙酮和苯胺)为例,在25 mL的圆底烧瓶中投入苯甲醛5.0 mmol、苯乙酮 5.0 mmol、苯胺 5.0 mmol、FeCl3·6H2O 0.5 mmol、乙醇3 mL,室温下搅拌,反应结束后(TLC跟踪)过滤,滤饼在乙醇中重结晶得产物,滤液回收待用(反应式 2)。

反应式 2 FeCl3·6H2O催化的Mannich反应
1.2.2 催化剂重复使用
在 25 mL的圆底烧瓶中投入苯甲醛 5.0 mmol、苯乙酮 5.0 mmol、苯胺 5.0 mmol。 随后将上一步的滤液倒入反应瓶中。于室温下搅拌。反应结束后(TLC跟踪)过滤,滤饼在乙醇中重结晶得产物,滤液回收待用。
产物数据
[1,3-Diphenyl-3-phenylamino-propan-1-one] 4aIR νmax(KBr): 3386 cm-1, 1671 cm-1,1599 cm-1.1H NMR (500 MHz, TMS, CDCl3): δ 3.396(dd, J1=2.5 Hz , J2= 7.5Hz,1H), 3.484 (dd, J1= 5.0Hz , J2=11.0 Hz,1H), 4.154 (brs, 1H),4.990 (dd, J1=5.5 Hz , J2= 2.5Hz, 1H), 6.549(dd,J1=0.5 Hz ,J2= 7.5Hz, 2H) 6.641-6.674(m, 1H), 7.066-7.097 (m,2H),7.212-7.249 (m,1H), 7.300 -7.330 (m,2H), 7.421 -7.455 (m,4H),7.535-7.569 (m,1H),7.892-7.915 (m,2H)
[1,3-Diphenyl-3-p-tolylamino-propan-1-one] 4bIR νmax(KBr) 3403 cm-1, 1680 cm-1,1620 cm-1.1H NMR (500 MHz, TMS, CDCl3): δ 2.170 (s, 3H), 3.379 (dd, J1=7.5 Hz , J2=10.5Hz, 1H), 3.468 (dd, J1=5.0 Hz , J2=11.0Hz, 1H), 4.445 (brs,1H), 4.953 (dd,J1=5.5 Hz , J2= 2.0Hz, 1H), 6.467 (m, 2H), 6.880(d, J = 8.5 Hz, 2H), 7.201-7.238 (m, 1H),7.290-7.321 (m, 2H), 7.411-7.441 (m, 4H),7.525-7.559 (m, 1H), 7.885 (t, 2H),
[1-Phenyl-3-phenylamino-3-p-tolylpropan-1-one] 4cIR νmax(KBr) 3389 cm-1,1668 cm-1, 1603 cm-1.1H NMR (500 MHz, TMS,CDCl3): δ 2.301(s, 3H), 3.380-3.514 (m, 2H),4.528 (brs, 1H),4.960 (dd, J1=7.5 Hz , J2=10.5Hz, 1H, ), 6.522 (d, J = 7.5 Hz, 2H),6.637-6.666 (m, 1H), 7.063-7.095 (m, 2H),7.112 (d,J = 8.0 Hz,2H),7.310 (d, J = 8.0 Hz, 2H), 7.418-7.449 (m, 2H), 7.531-7.563(m,1H).7.894-7.912(m, 2H).
[3 -(4 -Methoxy -phenyl) -1 -phenyl-3 -phenylamino-propan-1-one] 4dIR νmax(KBr)3377 cm-1, 1667 cm-1, 1603 cm-1.1H NMR (500 MHz, TMS,CDCl3): δ 3.376-3.423 (dd,J1=7.5 Hz , J2= 9.0Hz,1H), 3.459-3.502 (dd, J1=5.5 Hz , J2= 10.5Hz,1H), 3.762 (s, 3H), 4.501(brs, 1H), 4.949 (dd, J1=5.5 Hz , J2= 1.5Hz,1H), 6.550 (d, J = 8.0 Hz, 2H), 6.639 (t, J =7.5Hz,1H),6.830-6.860 (m, 2H), 7.068-7.100(m, 2H), 7.338-7.355 (m, 2H), 7.420-7.451(m, 2H), 7.533-7.565 (m, 1H), 7.890-7.909(m,2H)
[3 -(3 -bromophenyl) -1 -phenyl -3 -(phenylamino)propan-1-one] 4eIR νmax(KBr)3397 cm-1,1671 cm-1, 1600 cm-1.1H NMR (500 MHz, TMS, CDCl3): 3.388 (dd, J1=7.5 Hz , J2=10.5Hz Hz, 1H), 3.453 (dd, J1=5.0 Hz , J2=11.5Hz,1H),4.403 (brs,1H),4.940 (dd,J1=5.0 Hz , J2= 2.5Hz, 1H), 6.530-6.553 (m, 2H),6.672-6.705 (m, 1H), 7.083-7.115 (m, 2H),7.164 (t, J = 8.0 Hz, 1H), 7.348-7.386 (m,2H), 7.436-7.467 (m, 2H), 7.552 -7.600 (m,2H), 7.893-7.916 (m, 2H)
[1 -(4 -methoxyphenyl)-3 -phenyl-3 -(phenylamino)propan-1-one] 4fIR νmax(KBr)3382 cm-1,1659 cm-1,1600 cm-1.1H NMR (500 MHz, TMS, CDCl3): 3.318 (dd, J1=7.5 Hz , J2=8.0Hz, 1H), 3.423 (dd, J1=5.0 Hz , J2=11.0Hz,1H), 3.848 (s, 3H), 4.528 (brs, 1H), 4.950(dd, J1=5.0 Hz , J2= 2.5Hz, 1H), 6.540-6.557(m, 2H), 6.632-6.661 (m, 1H), 6.885-6.914(m, 2H), 7.056 (dd, J1=7.5 Hz , J2= 1.0Hz,1H), 7.206 -7.246 (m, 1H), 7.295 (t, J =7.5Hz, 2H), 7.425 (d, J = 7.5Hz, 2H),7.869-7.898 (m, 2H).
[1 -(4 -Nitro -phenyl) -3 -phenyl-3 -phenylamino-propan-1-one] 4gIR νmax(KBr)3409 cm-1, 1690 cm-1, 1600 cm-1, 1518 cm-1.1H NMR (500 MHz,TMS,CDCl3):δ 3.527 (t, J =6.0 Hz, 2H), 5.029 (t, J = 6.5 Hz, 1H), 6.580(d, J = 8.0 Hz, 2H), 6.682 (t, J = 6.5 Hz, 1H),7.092-7.124 (m, 2H), 7.224-7.255 (m, 1H),7.303-7.333 (m, 2H), 7.407-7.424 (m, 2H),7.986-8.012 (m, 2H), 8.246-8.272 (m, 2H).
[2-(phenyl-phenylamino-methyl)-cyclohexanone] 6aIR νmax(KBr) 3382 cm-1(NH),3330 cm-1, 2938 cm-1, 2863 cm-1, 1701 cm-1,1602 cm-1.1H NMR (500 MHz,TMS, CDCl3): δ 1.637-1.732 (m, 2H), 1.803-1.940 (m, 4H),2.293-2.348 (m, 1H), 2.399-2.450 (m, 1H),2.727-2.767 (m, 1H), 4.612 (d, J = 7.0 Hz,1H), 4.812 (brs, 1H), 6.521 (t, J = 7.5 Hz,2H), 6.602 (t, J = 7.5 Hz, 1H), 7.036-7.067(m, 2H), 7.186 (t, J = 7.5 Hz, 1H), 7.275 (t, J= 7.5 Hz, 2H), 7.335-7.371 (m, 2H).
[2 -((4 -fluorophenyl) (phenylamino)methyl)cyclohexanone] 6bIR νmax(KBr) 3382 cm-1, 3375 cm-1, 2950 cm-1, 1691 cm-1, 1603 cm-1,1509 cm-1.1H NMR (500 MHz,TMS, CDCl3): δ 1.637-1.821 (m, 2H), 1.860-1.978 (m, 4H),2.297-2.354 (m, 1H), 2.393-2.443 (m, 1H),2.715-2.755(m, 1H), 4.596 (d, J = 6.5Hz, 1H),4.743 (brs, 1H), 6.506-6.532(m, 2H), 6.626-6.665 (m, 1H), 6.947-6.994 (m, 2H), 7.045-7.088(m,2H),7.306-7.353 (m, 2H)
[(2 -(4 -Methoxyphenyl) -phenylamino -methyl)-cyclohexanone] 6cIR νmax(KBr) 3382 cm-1,3325 cm-1, 2930 cm-1,1695 cm-1, 1605 cm-1.1H NMR (500 MHz, TMS, CDCl3): δ 1.637-1.814 (m, 2H), 1.863-1.988 (m, 4H), 2.298-2.388 (m, 1H), 2.340-2.445 (m, 1H), 2.717-2.758 (m, 1H), 3.848 (s, 3H), 4.621 (d, J =6.5Hz, 1H), 4.891 (brs, 1H), 6.530 (t, J = 7.5 Hz, 2H), 6.611 (t, J = 7.5 Hz, 1H),7.045-7.076 ( m, 2H), 7.195 (t, J = 7.5 Hz, 1H),7.285 (t,J = 7.5 Hz, 2H),7.344-7.380 (m,2H).
2 结果与讨论
2.1 不同的催化剂对反应的影响
实验采用了常见的lewis酸对反应进行催化。所用的催化剂都能重复使用,催化活性差异较大,如表1所示。虽然ZnCl2的产率只有41%,但第二次产率较第一次产率低很多;其余反应的重复产率和首次产率差不多。我们选择了产率最高的FeCl3·6H2O 作为催化剂。

表1 不同的催化剂对反应的影响
2.2 催化剂用量对反应的影响
以模型反应为例,实验采用乙醇作溶剂。催化剂FeCl3·6H2O的用量从0 mol%到20 mol%。从表2中可以看出,没有加催化剂的空白反应经过了10 h没有得到目标产物,产率随着催化剂的增加而增大。当用量在10 mol%时,产率已经达到了85%,而当继续增加催化剂的用量时,反应的产率并没有很大的提高,反应效率有所提高。所以我们选择10 mol%的用量。

表2 催化剂FeCl3·6H2O的用量对反应的影响
2.3 溶剂对反应的影响
实验考察了不同的溶剂对反应的影响。首先,在无溶剂的情况下。常温下固态的醛或酮使反应体系很难被搅拌起来。原料混合不均匀,反应不易进行。在水、乙醇,氯仿和二氧六环中分别做了测试。具体结果如表3。结果发现,以乙醇作溶剂的反应产率最高,达到85%,其次是水,达到78%。可能是由于原料在水中的溶解性很差,当反应过程中一部分固体产物形成后,这些油状液体原料粘附在产物固体表面,原料之间,原料和溶解在水中的催化剂之间的接触不充分,导致产率下降。反应在氯仿和二氧六环中的产率均低于60%。在质子型溶剂中反应的产率明显高于在非质子型溶剂中的。与非质子型溶剂相比,可能是由于在质子型溶剂中原料苯乙酮比较易形成烯醇式中间体,因而使得产率较高。所以我们选择了乙醇为溶剂。

表3 不同的溶剂对反应的影响
2.4 反应的适用性
对不同的底物做了考察。正丁醛、苯胺和苯乙酮的反应没有得到分离产物,同样是脂肪族的苄胺、苯甲醛和苯乙酮的反应也没有得到分离产物。芳香族的醛或胺优于脂肪族的醛或胺。对于相同条件具有吸电子基团的芳香醛优于推电子基团的芳香醛。脂肪族的环己酮和芳香酮的反应产率并没有太大的差别。与具有取代基芳香酮相比较,苯乙酮为底物的反应,产率较高。具体结果如表4。

表4 催化剂FeCl3·6H2O对不同底物的Mannich反应
2.5 催化体系重复使用性
我们对催化反应体系 (FeCl3·6H2O/乙醇)进行了模型反应(苯甲醛、苯乙酮和苯胺)的重复实验。每一次重复,催化体系没有进一步的纯化、干燥处理。发现经过4次的循环反应,产率没有明显降低。第二次的产率最高,达到89%,第三次和第四次的产率分别是84%和80%。但是第三次和第四次反应时间有所增加,反应效率逐步降低。
3 结论
本研究用FeCl3·6H2O作催化剂、乙醇作溶剂的可循环催化体系顺利地进行了Mannich反应。这个体系对芳香醛和芳香胺的催化优于脂肪醛和脂肪胺,具有吸电子基团的芳香醛优于推电子基团的芳香醛。芳香酮和脂肪酮的差异不明显。反应在室温下进行,条件温和,催化剂毒性低,催化体系FeCl3·6H2O/乙醇可以在没有进一步纯化干燥处理的情况下循环四次反应,反应效率逐步降低,但是催化产率没有明显变化。
[1] KAORI I, TAKAKAZUK.A Novel Approach for Mannich-Type Bases Having a Terminal Olefin: Zinc Triflateand Water -Promoted Cyclization/C -N Bond Cleavage Process [J].J.Org Chem.,2000, 65: 8395-8398.
[2] SPECKAMP WN,MOOLENAAR MJ.New developments in the chemistry of N-acyliminium ions and related intermediates[J].Tetrahedron ,2000,56: 3817.
[3]杨永飞,姚军,赵修太,赵晓珂.曼尼希碱和季铵盐高温酸化缓蚀剂性能对比[J].西南石油大学学报(自然科学版),2009,31(2):121-124.
[4] RISCH N,AREND M,Westermann B.Modern variants of the Mannich reaction[J].Angew Chem Ind Ed.,1998, 37: 1044-1070..
[5] TAKHASHI E,FUJISAWA H,MUKAIYAMA T.Lithium acetate -catalyzed Mannich -type reaction between trimethylsilyl enolates and aldimines in a water-containing DMF[J].Chem Lett.,2004, 33: 936-937.
[6] RAMALINGAM S, KUMAR P.Multi-component carbon–carbon bond forming Mannich reaction catalyzed by yttria–zirconia based Lewis acid [J].Catal Commun.,2008, 9:2445–2448.
[7] IIMURA S,NOBUTOU D,MANABLE K,et al.Mannich-type reactions in water using a hydrophobic polymer-supported sulfonic acid catalyst [J].Chem Commun.,2003,14:1644-1645.
[8] AZIZI N,TORKIYAN L,SAIDI MR.Highly efficient one-pot three-component Mannich reaction in water catalyzed by heteropoly acids [J].Org Lett.,2006,8:2079-2082.
[9] WU Hui,CHEN Xiu-mei,Wan Yu,et al.Stereoselective Mannich reactions catalyzed by tr?gers base derivatives in aqueous media [J].Tetra Lett.,2009,50:1062 –1065.
[10] GONG Kai,FANG Dong,Wang Hua -lan,et al.Basic Functionalized Ionic Liquid Catalyzed One-pot Mannich-type Reaction:Three Component Synthesis of b-Amino Carbonyl Compounds [J].Monatshefte für Chemie, 2007,138:1195–1198.
[11]方东,刘祖亮.新型功能化离子液体催化水相Mannich 反应[J].南京航空航天大学学报,2007,39 (4):540-543.
[12] WANG Li-ming,HAN Jian -wei,SHENG Jia,et al..Rare earth perfluorooctanoate [RE (PFO)3] catalyzed one-pot Mannich reaction:three component synthesis of beta-amino carbonyl compounds [J].Catal Commun., 2005, 6:201-204.
[13] MAZAAHIR K,NEERAJ K M,VIKAS B,et al.Novel one-pot Cu-nanoparticles-catalyzed Mannich reaction[J].Tetra Lett.,2009,50:1355–1358.
[14] LIST B,POJARLIEV P,BILLER WT,et al.The proline-catalyzed direct asymmertric three -component mannich reaction:scope, optimization, and application to the highly enantioselective synthesis of 1,2-amino alcohols [J].J Am Chem Soc.,2002,214:827-833.
[15] CHEN Wei-ying,LI Xin-sheng.The solvent-free vinylogous Mannich reaction of dicyanoalkylidenes with alpha-amido sulfones under ultrasound irradiation [J].CatalCommun.,2009,10:549–551.
[16] DONG Xiao -wu,LIU Tao,CHEN Jing,et al.Microwave-Assisted Mannich Reaction of 2-Hydroxychalcones[J].synth commun.,2009, 39: 733-742.
[17]俞善信,文瑞明.六水三氯化铁在有机实验中的应用[J].安徽教育学院学报, 2002,20:38-40.
10.3969/j.issn.1007-2217.2010.02.009
2010-03-03

