高效表达AIM工程菌的发酵培养基及发酵条件优化
黎 明,张俊环,周 政,牛 涛
(工业微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
载脂蛋白 AI(apoAI)是高密度脂蛋白(HDL)的最主要结构成分,在外周组织中作为游离胆固醇的受体,促进HDL对外周组织中胆固醇的摄取;在脂蛋白表面作为卵磷脂胆固醇酰基转移酶(Lecithin-cholesterol acyltransferase,LCAT)的辅助激活因子,参与胆固醇的酯化;在肝脏表面介导HDL与B族Ⅰ型清道夫受体(scavenger receptor class B type Ⅰ,SR-BI)的作用,将HDL中胆固醇酯转移到肝脏进行代谢,从而降低胆固醇在外周组织的沉积;另外,apoAI通过其抗炎、抗血栓形成和内皮功能保护等多种作用抑制动脉粥样硬化的发生和发展.动物和临床实验证明血浆中apoAI和HDL的含量与动脉粥样硬化心脑血管病的发生呈负相关性[1],apoAI具有明显的抗动脉粥样硬化的生物学效应[2].因此,apoAI基因已经成为预防和治疗动脉粥样硬化症的靶基因[3].
载脂蛋白AI米兰突变体(AIM)是第一个被发现的 apoAI的天然半胱氨酸突变体[4].至今 AIM 携带者无一人被检出动脉粥样硬化的临床或病理表征,这主要是由于 AIM 具有独特的结构[5]和功能特性[6–7],从而高度保护其携带者免于发生心脑血管疾病.与apoAI相比较,AIM 的构象更稳定,在血浆中的半衰期延长;而且链间二硫键使 AIM 二硫键 C末端 40多个氨基酸残基形成一个新的结构域,呈环状突出于HDL颗粒表面,结合脂的能力大大增强[8],能更有效地排出细胞中的胆固醇,且较少的底物就可激活LCAT;同时,AIM 游离的巯基具有抗脂类氧化的作用[7].因此 AIM 比 apoAI的抗动脉粥样硬化的能力更强[7,9].
大量动物和临床实验证明,重组人 AIM 不仅能在短时间内显著“逆转”动脉粥样硬化,而且临床研究也未见明显的毒副反应.但是,由于AIM的临床剂量在克级水平,临床用量很大,因此AIM用于临床治疗不可能从血液中提取,可依赖基因工程技术将AIM基因在微生物中表达.前期工作已经构建了高效表达AIM的工程菌,为了进一步提高表达量,降低发酵成本,本文对 AIM 工程菌的培养基和培养条件进行优化,为其应用研究和工业化发酵生产奠定基础.
1 材料与方法
1.1 菌株
含质粒pET22b-AIM的重组E.coli BL21,本实验室保存.
1.2 培养基
种子培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10,氨苄青霉素 0.05,pH 7.0.
原始发酵培养基(g/L):葡萄糖 10,蛋白胨 10,NaCl 10,氨苄青霉素 0.05,pH 7.0.
1.3 培养方法
种子培养:从平板上挑取重组 E.coli BL21单菌落,接种到装有 30,mL种子培养基的 250,mL摇瓶中,37,℃、200,r/min 培养 14,h,制成种子液.
原始发酵培养:按 6%的接种量将种子液接种到装有 30,mL原始发酵培养基的 250,mL摇瓶中,37,℃、200,r/min培养 2~3,h,当 A600为 0.8时,加入IPTG至终浓度为0.6,mmol/L,诱导4,h.
1.4 发酵培养基优化
基于微生物对营养利用情况及成本的比较,在文献[10]的基础上,运用单因素实验筛选出最适碳、氮源及最适浓度.
1.4.1 碳源的选择
以10,g/L的蛋白胨为氮源,10,g/L的NaCl为无机离子,分别加入 10,g/L的葡萄糖、蔗糖和甘油进行发酵,筛选出最适碳源;再以 10,g/L的蛋白胨为氮源,10,g/L的 NaCl为无机离子,加入 5、10、15,g/L的最适碳源,筛选出最适碳源的最适浓度.
1.4.2 氮源的选择
以最适浓度的最适碳源和 10,g/L的 NaCl为培养基基本组分,分别加入 10,g/L的酵母粉、蛋白胨、黄豆饼粉,经发酵筛选出最适有机氮源;再以最适浓度的最适碳源和10,g/L的NaCl为培养基基本组分,加入 5、10、15,g/L的最适有机氮源,筛选出最适有机氮源的最适浓度.
以最适浓度的最适碳氮源和 10,g/L的 NaCl为培养基基本组分,分别加入含氮量为0.56,g/L的不同无机氮源(g/L):硫酸铵 2.64、硝酸铵 1.60和氯化铵2.12,筛选出最适无机氮源;再以最适浓度的最适碳氮源和10,g/L的NaCl为培养基基本组分,分别加入2、3、4,g/L的最适无机氮源,筛选出最适无机氮源的最适浓度.
1.4.3 正交实验
利用 L9(33)正交实验筛选出蔗糖、酵母粉和硫酸铵的最佳配比.
1.5 发酵条件优化
1.5.1 装液量的确定
以原始发酵培养为基础,分别将种子液接种到不同体积的最适发酵培养基中,筛选出最适装液量.
1.5.2 接种量的确定
以原始发酵培养为基础,分别按不同的接种量进行接种,筛选出最适接种量.
1.5.3 诱导时机的确定
以原始发酵培养为基础,分别在 A600为 0.4、0.6、0.8、1.0、1.2、1.4时加入 IPTG 进行诱导,筛选出最适诱导时机.
1.5.4 诱导剂量的确定
以原始发酵培养为基础,加入 IPTG至终浓度分别为 0.2、0.4、0.6、0.8、1.0、1.2,mmol/L,筛选出最适诱导剂量.
1.5.5 诱导时间的确定
以原始发酵培养为基础,分别诱导 3、4、5、6、7、8,h,筛选出最适诱导时间.
1.6 分析方法
1.6.1 生物量的测定
以未接种的发酵培养基为空白对照,测定不同培养时期发酵液在 600,nm 波长下的吸光度,使其在0.10~0.65之间,经稀释后测得的 A600乘以稀释倍数即为生物量的值.
1.6.2 SDS-PAGE蛋白电泳
收集发酵菌体,完全超声破碎后离心取上清液,用 15%分离胶和 5%浓缩胶进行 SDS-PAGE.电泳完毕后分别用考马斯亮蓝染色液和脱色液进行染色和脱色.
1.6.3 AIM表达量的测定
以不含质粒的 E.coli BL21为对照,采用改良的Bradford蛋白质定量检测试剂盒测定 AIM 的表达量.操作方法:取 4 µL蛋白标准液(牛血清白蛋白溶液)加 PBS稀释至 100,µL(一般可用 PBS稀释标准品),使终浓度为 200,µg/mL;将稀释后标准品按 0、1、4、6、8、10、15,µL 分别添加到 96 孔板中,加 PBS 补足至 20,µL,每孔蛋白含量分别为:0、0.2、0.4、0.8、1.2、1.6、2.0、3.0,µg;加适当体积样品到 96 孔板中,加 PBS至 20,µL;各孔加 200,µL Bradford Reagent,混匀,室温放置 5,min;用预热的酶标仪测定 A595并绘制标准曲线,计算样品中的蛋白浓度.
2 结果与讨论
2.1 发酵培养基优化
2.1.1 碳源
由表 1可知,以葡萄糖为碳源的菌体 A600最大,以蔗糖为碳源的菌体 A600稍低,但是 AIM 的表达量最高,故选用蔗糖作为碳源.蔗糖最适浓度实验结果表明,质量浓度为 10,g/L时 AIM 表达量最高,达1.625,g/L.
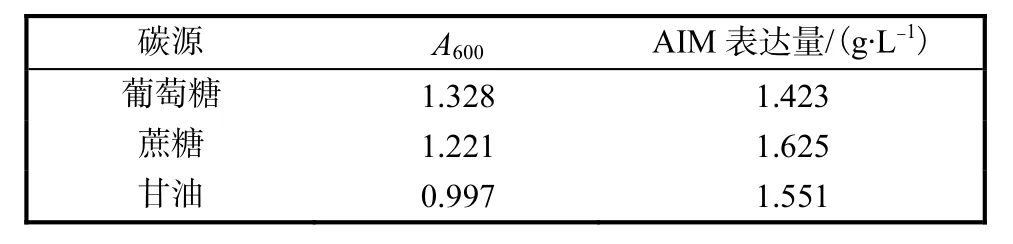
表1 不同碳源下工程菌的生物量及AIM表达量Tab.1 Biomass and AIM expression levels of engineering bacteria for different carbon sources
以葡萄糖为碳源的培养基AIM表达量反而不及另外两种培养基,可能是由于微生物在利用葡萄糖作为碳源时,葡萄糖降解速度较快,使得降解速度超过菌体吸收速度,一些葡萄糖代谢物如丙酮酸、乙酸等在细胞内积累,从而降低了环境的 pH,抑制了菌体代谢物的产出.
2.1.2 氮源
有机氮源在发酵培养基中不仅是菌体生长繁殖的营养,有些还是某些产物合成的前体.常用的有机氮源有酵母粉、蛋白胨、花生饼粉、黄豆饼粉等.本实验用酵母粉、蛋白胨、黄豆饼粉作试用氮源.由表 2可知,以酵母粉为氮源的菌体A600最大,且AIM的表达量最高,因此选用酵母粉作为有机氮源.酵母粉最适浓度实验结果表明,质量浓度为 10,g/L时 AIM 表达量最高,达1.648,g/L.
无机氮源吸收快、易利用、成分简单.在确定了碳源和有机氮源之后,以硫酸铵、硝酸铵、氯化铵为无机氮源,考察其对菌体生长及 AIM 表达量的影响.由表 3可知,以硝酸铵为氮源的菌体 A600最大,其次为硫酸铵,但以硫酸铵为氮源的AIM 表达量最高,因此选用硫酸铵作为无机氮源.硫酸铵最适浓度实验结果表明,质量浓度为4,g/L时AIM表达量最高,达1.772,g/L.

表2 不同有机氮源下工程菌的生物量及AIM表达量Tab.2 Biomass and AIM expression levels of engineering bacteria for different organic nitrogen sources

表3 不同无机氮源下工程菌的生物量及AIM表达量Tab.3 Biomass and AIM expression levels of engineering bacteria for different inorganic nitrogen sources
2.1.3 正交实验
由表 4可知,在蔗糖、酵母粉和硫酸铵 3种培养基组分的不同配比中,AIM 表达量最高的组合为(g/L):蔗糖 10,酵母粉 10,硫酸铵 6.极差分析结果表明硫酸铵对菌体生长的影响最大,蔗糖次之,酵母粉的影响较小.
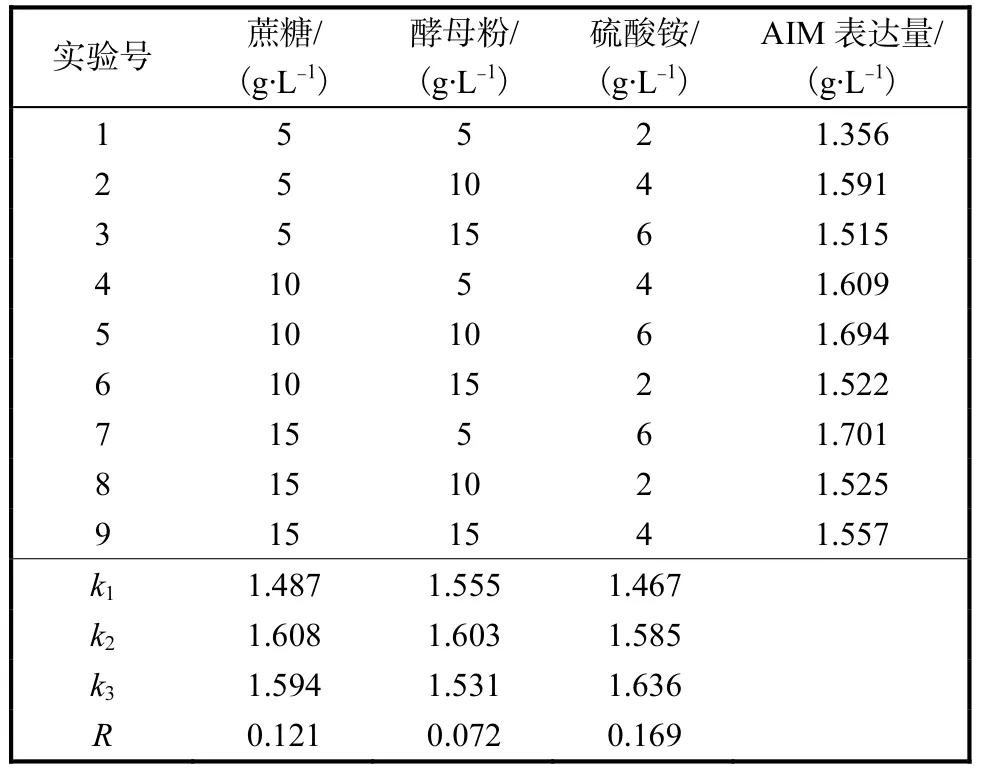
表4 正交实验Tab.4 Orthogonal test
优化后的最适发酵培养基为(g/L):蔗糖 10、酵母粉 10、硫酸铵 6和 NaCl 10.由图 1可知,重组E.coli BL21在最适发酵培养基中生长情况良好,而且AIM 的表达量达 1.775 g/L,是在原始培养基中表达量的1.247倍.
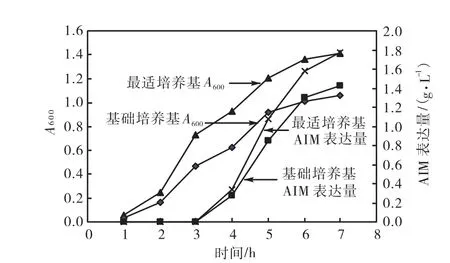
图1 发酵培养基优化前后的生物量及AIM的表达量Fig.1 Biomass and expression levels for fermentation medium optimization
2.2 发酵条件
2.2.1 装液量
由图2可知,装液量对AIM表达量的影响较大,在 10~30,mL时 AIM 表达量逐渐升高,在 40~60,mL时 AIM 表达量严重下降,表明充足的氧供应是菌体生长和高表达 AIM 的必需条件.因此,发酵时装液量应控制在30,mL.
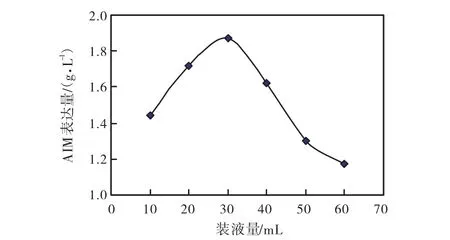
图2 装液量对AIM表达量的影响Fig.2 Effect of media volume on the expression of AIM
2.2.2 接种量
接种量的大小决定于生产菌种的生长繁殖速度,较大的接种量可以缩短菌体繁殖达到高峰的时间,使产物的形成提前到来,并可减少杂菌的生长机会.但接种量过大或者过小,均会影响发酵.过大会引起溶氧不足,影响产物合成,而且会过多产生代谢废物;过小会延长培养时间,降低生产率.由图 3可知,接种量为8%时AIM表达量最高.
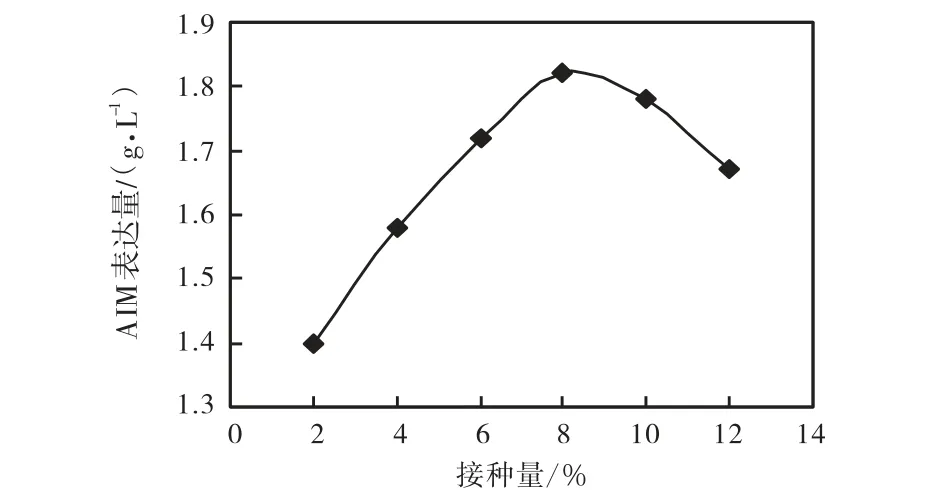
图3 接种量对AIM表达量的影响Fig.3 Effect of inoculum size on the expression of AIM
2.2.3 诱导时机
诱导时机是影响 AIM 表达量的重要工艺参数.由图 4可知,在 A600为 1.0 时诱导,AIM 的表达量最高.
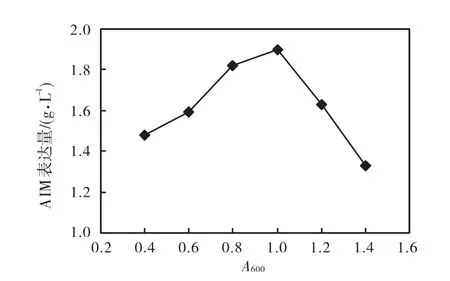
图4 诱导时机对AIM表达量的影响Fig.4 Effect of induction opportunity on the expression of AIM
2.2.4 诱导剂量
工程菌中的表达载体为 IPTG诱导型表达载体,因此 AIM 的表达必须加入 IPTG进行诱导.由图 5可知,终浓度0.8,mmol/L的IPTG诱导效果最佳.
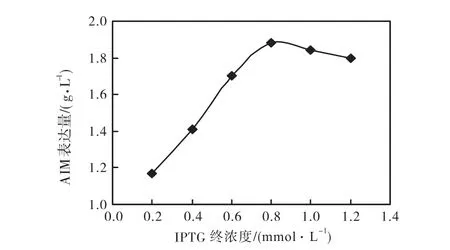
图5 诱导剂量对AIM表达量的影响Fig.5 Effect of induction concentration on the Expression Fig.5 of AIM
2.2.5 诱导时间
由图6可知,随着诱导时间从3,h到6,h,AIM表达量逐渐增加并达到最高,继续增加诱导时间,AIM并没有发生降解.因此,选择诱导时间为6,h.
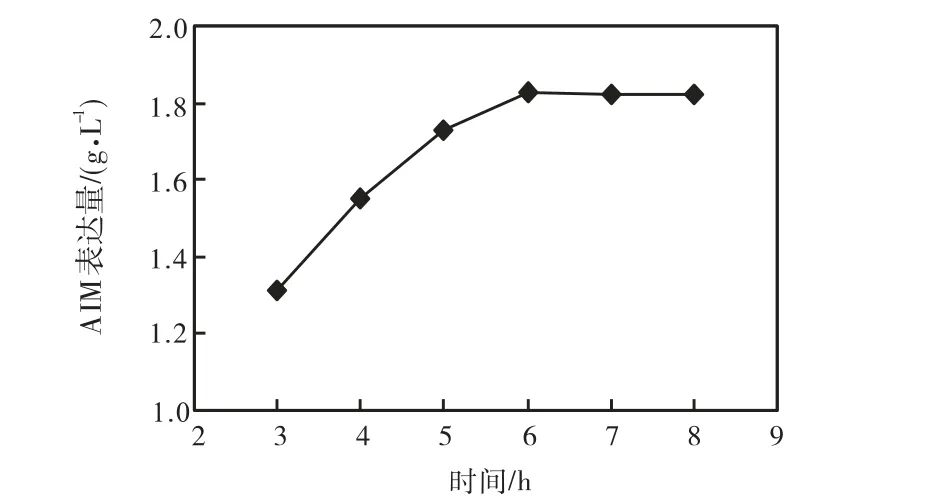
图6 诱导时间对AIM表达量的影响Fig.6 Effect of induction time on the expression of AIM
2.3 验证实验
通过对重组大肠杆菌BL21/pET22b-AIM发酵条件的研究,确定其最适发酵条件为:装液量30 mL,接种量8%,诱导时机A6001.0,诱导浓度0.8 mmol/L,诱导时间 6 h.发酵后的蛋白样品经 SDS-PAGE电泳后,在 28.0 ku有清晰明显条带(如图 7所示),和AIM的结果一致.由图8可知,在最适发酵培养基和最适发酵条件下AIM的表达量可达2.26 g/L,是优化前的1.58倍.
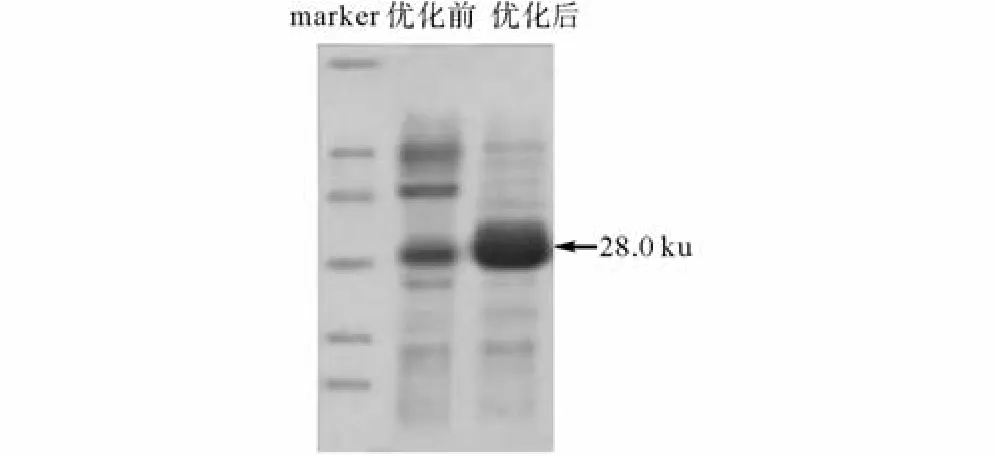
图7 发酵培养基和发酵条件优化前后的SDS-PAGEFig.7 SDS-PAGE for fermentation medium and fermentation conditions optimization
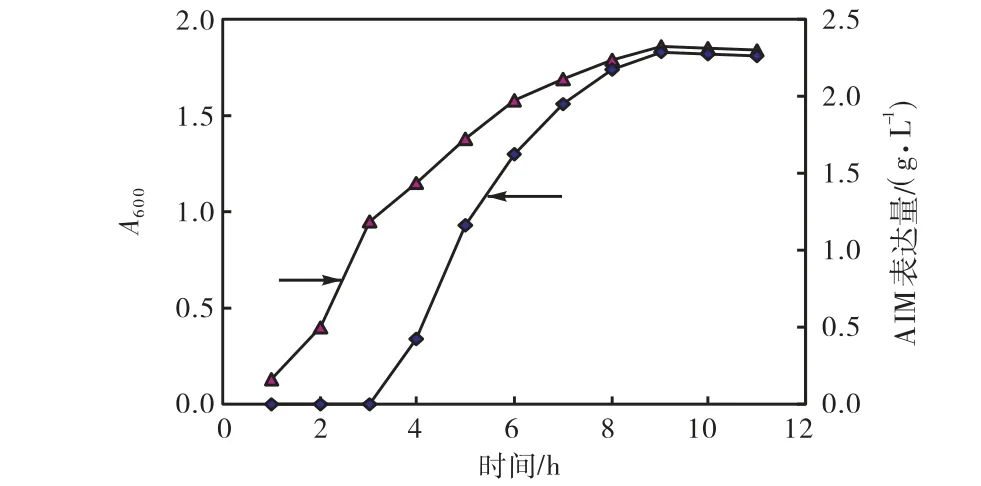
图8 最适发酵培养基和发酵条件下的生物量及AIM表达量Fig.8 Biomass and expression level in optimized fermentation medium and conditions
3 结 论
本实验基于微生物对营养利用情况及成本的比较,运用单因素实验和 L9(33)正交实验筛选出最适发酵培养基为(g/L):蔗糖 10,酵母粉 10,硫酸铵 6和NaCl 10;单因素实验筛选出最适发酵条件为:装液量30,mL,接种量 8%,诱导时机 A6001.0,诱导浓度 0.8 mmol/L,37,℃、200,r/min 诱导 6,h,AIM 的表达量达2.26,g/L,是未优化条件下的1.58倍.
[1] Sedlis S P,Schechtman K B,Ludbrook P A,et al. Plasma apoproteins and the severity of coronary artery disease[J]. Circulation,1986,73(5):978-986.
[2] Paszty C,Maeda N,Verstuyft J,et al. Apolipoprotein AI transgene corrects apolipoprotein E deficiency-induced atherosclerosis in mice[J]. J Clin Invest,1994,94(2):899-903.
[3] Fruchart J C,Duriez P. High density lipoprotein and coronary heart disease. Future prospects in gene therapy[J].Biochimie,1998,80(2):167-172.
[4] Gualandri V,Franceschini G,Sirtori C R,et al. AIMilano apoprotein indentification of the complete kindred and evidence of a dominant genetic transmission[J]. Am J Hum Genet,1985,37(6):1083-1097.
[5] Calabresi L,Franceschini G,Burkybile A,et al. Activtion of lecithin-cholesterol acyltransferase by a disulfide bridge remarkably alters apolipoprotein A-I dimmer[J].Biochem Biophys Res Commun,1997,232:345-349.
[6] Calabresi L,Franceschini G,Sirtori C R,et al. Inhibition of VCAM-1 expresson in endothelial cells by reconstituted high density lipoproteins[J]. Biochem Biophys Res Commun,1997,238(1):61-65.
[7] Bielicki J K,Oda M N. Apolipoprotein A-I(Milano)and apolipoprotein A-I(paris)exhibit an antioxidant activity distinct from that of wild-type apolipoprotein A-I[J].Biochemistry,2002,41(6):2089-2096.
[8] Calabresi L,Vecchio G,Longhi R,et al. Molecular characterization of native and recombinant apolipoprotein A-I Milano dimmer[J]. J Biol Chem,1994,269(51):32168-32174.
[9] Shah P K,Yano J,Reyes O,et al. High-dose recombinant apolipoprotein A-I(milano)mobilizes tissue cholesterol and rapidly reduces plaque lipid and macrophage content in apolipoprotein e-deficient mice. Potential implications for acute plaque stabilization[J]. Circulation,2001,103(25):3047-3050.
[10]马文峰,丁满生,郭美锦,等.重组人载脂蛋白 ApoA-I表达条件的优化[J]. 微生物学通报,2004,31(6):27-32.

