类肝素酶、VEGF-C、D2-40在甲状腺癌中的表达及临床意义
田亮 桑伟 商晓青 李淑敏 蒋金芳 郭长军 李锋 赵瑾
新疆石河子大学医学院病理教研室, 新疆 石河子 832000
甲状腺癌是头颈部最常见的恶性肿瘤,甲状腺乳头状癌(papillary thyroid carcinoma, PTC)是其最常见的病理类型,且以淋巴道转移为主。长期以来人们研究的重点多集中于血管的形成与甲状腺癌生长及转移的关系上,甲状腺癌淋巴管形成机制及其与肿瘤扩散转移的关系尚未阐明。近年来,VEGF-C/VEGFR-3信号轴可以促发肿瘤淋巴管的生成已被很多学者所认可,最近研究发现类肝素酶(heparanase,HPSE)可以诱导肿瘤细胞释放VEGF-C,从而激活淋巴管内皮细胞生长通路,进而促发淋巴管的生成。D2-40是新近发现的标记淋巴管的特异性标记物,用以估算淋巴管密度(lymphatic vessel density,LVD)。本研究应用免疫组化SP法检测HPSE、VEGF-C和D2-40在甲状腺良恶性病变组织中的表达,探讨其相互关系及其临床意义。
1 材料和方法
1.1 标本来源 收集石河子大学医学院第一附属医院和乌鲁木齐军区总院病理科存档蜡块,所有蜡块均有较完整的临床资料。其中甲状腺癌77例(男性26例,女性51例),年龄19~72岁(平均年龄44.1岁)。甲状腺良性组织32例:其中甲状腺腺瘤17例(男性7例,女性10例),年龄22~69(平均年龄43.8岁),结节性甲状腺肿15例(男性4例,女性11例),年龄15~76岁(平均年龄48.4岁)。以上病例均经HE切片并经两位教授病理确诊,外院标本使用已获得批准。
1.2 分类标准 按2004年WHO病理组织学分类标准:甲状腺乳头癌51例,甲状腺滤泡癌(follicular thyroid carcinoma,FTC)16例,甲状腺髓样癌(medullary thyroid carcinoma,MTC)10例,腺瘤(adenoma)17例,结节性甲状腺肿(nodular goiter)15例。有淋巴结转移32例,无淋巴结转移45例。临床分期按UICC颁布的甲状腺癌分期标准,分为Ⅰ~Ⅳ期。
1.3 方法 所有标本均经4%甲醛固定,常规组织处理,石蜡包埋,4 μm厚连续切片,常规HE染色。采用免疫组织化学SP法,具体操作步骤按试剂盒说明书上操作,以PBS液代替一抗作为阴性对照。兔抗人VEGF-C多克隆抗体和鼠抗人D2-40(淋巴管内皮)单克隆抗体均购于北京中杉金桥生物有限公司,兔抗人HPSE(H-80)多克隆抗体购于Santa Cruz公司。工作浓度分别为1∶100、1∶100和1∶200。S-P试剂盒购于福州迈新生物公司。
1.4 评定标准 HPSE 和VEGF-C免疫组化结果判断:染色阳性为胞质呈清晰棕黄色颗粒,当阳性胞质染色的细胞≤5%时,定为“-”,>5%~25%为“+”,>25%~50%为“++”,>50%为“+++”。另外,规定“-”与“+”为低表达,“++”与“+++”为高表达。D2-40(LVD)结果判定:参考邢光明等[1]的标准:任何被染成棕红色孤立的内皮细胞、条索状、裂隙状、管状细胞团,只要能与邻近的肿瘤细胞或其他结缔组织分开,就视为一个淋巴管。计数参考Weidner[2]的标准:先在低倍镜(×40)下观察肿瘤周边区、肿瘤中心区及相应远端切缘正常组织,选择其中淋巴管高密度区(hot spots),然后在高倍镜(×200)下计数被染色的淋巴管数目。每个染成棕色的内皮细胞或内皮细胞簇,只要与邻近脉管、肿瘤细胞或其他结缔组织分开,即视为一个淋巴管。计数5个高倍视野下的淋巴管数目,取其平均值作为该例的LVD。
2 结 果
2.1 HPSE、VEGF-C和D2-40在甲状腺癌组织中的表达 HPSE和VEGF-C均在甲状腺癌组织中的胞质中呈阳性表达(图1A-B),正常滤泡上皮细胞及间质成分也偶尔呈弱表达。由表1可见,77例甲状腺癌组织中36例HPSE呈高表达(46.8%),VEGF-C有45例呈高表达(58.4%)。D2-40主要标记位于肿瘤外周的淋巴管上皮,阳性部位为细胞膜和细胞质(图1G),而肿瘤间质内的淋巴管很少表达。有时,在标记的淋巴管内可见侵入的癌细胞。
2.2 HPSE表达与VEGF-C、淋巴结转移及LVD的关系 HPSE与VEGF-C在甲状腺癌组织中的表达呈正相关(P<0.001,r=0.616, Spearman’s系数相关分析)。在表1中列出了HPSE与VEGF-C表达之间的关系及临床病理参数,HPSE和VEGF-C在甲状腺癌组织中呈高表达,有淋巴结转移(LNM)组阳性表达率明显高于无淋巴结转移组(P值分别为0.014和0.048,χ2检验)(图1A-D)。LVD在HPSE高表达的病例中往往比低表达的要显著增高(P=0.005,秩和检验)。VEGF-C表达与LVD也是相似关系(P=0.002,秩和检验)。另外,甲状腺癌中的高临床分期(Ⅲ/Ⅳ)HPSE和VEGF-C的表达显著高于低临床分期(Ⅰ/Ⅱ)(表1)。HPSE和VEGF-C的表达与患者的年龄、性别等指标组间差异无统计学意义(P>0.05)。本实验还发现一些患者虽临床病理未确诊转移,但其HPSE、VEGF-C及LVD表达也有增高。
2.3 HPSE、VEGF-C及D2-40在甲状腺腺瘤和结节性甲状腺肿的表达情况 在良性对照组,HPSE和VEGF-C在甲状腺腺瘤和结节性甲状腺肿均低表达(图1E、F、H、I)(表1),经χ2检验,两者表达差异均无统计学意义(P>0.05 )。另外,在腺瘤和结节性甲状腺肿中的LVD明显降低(表2)。两者与各类型甲状腺癌比较均有统计学意义(P<0.05)。
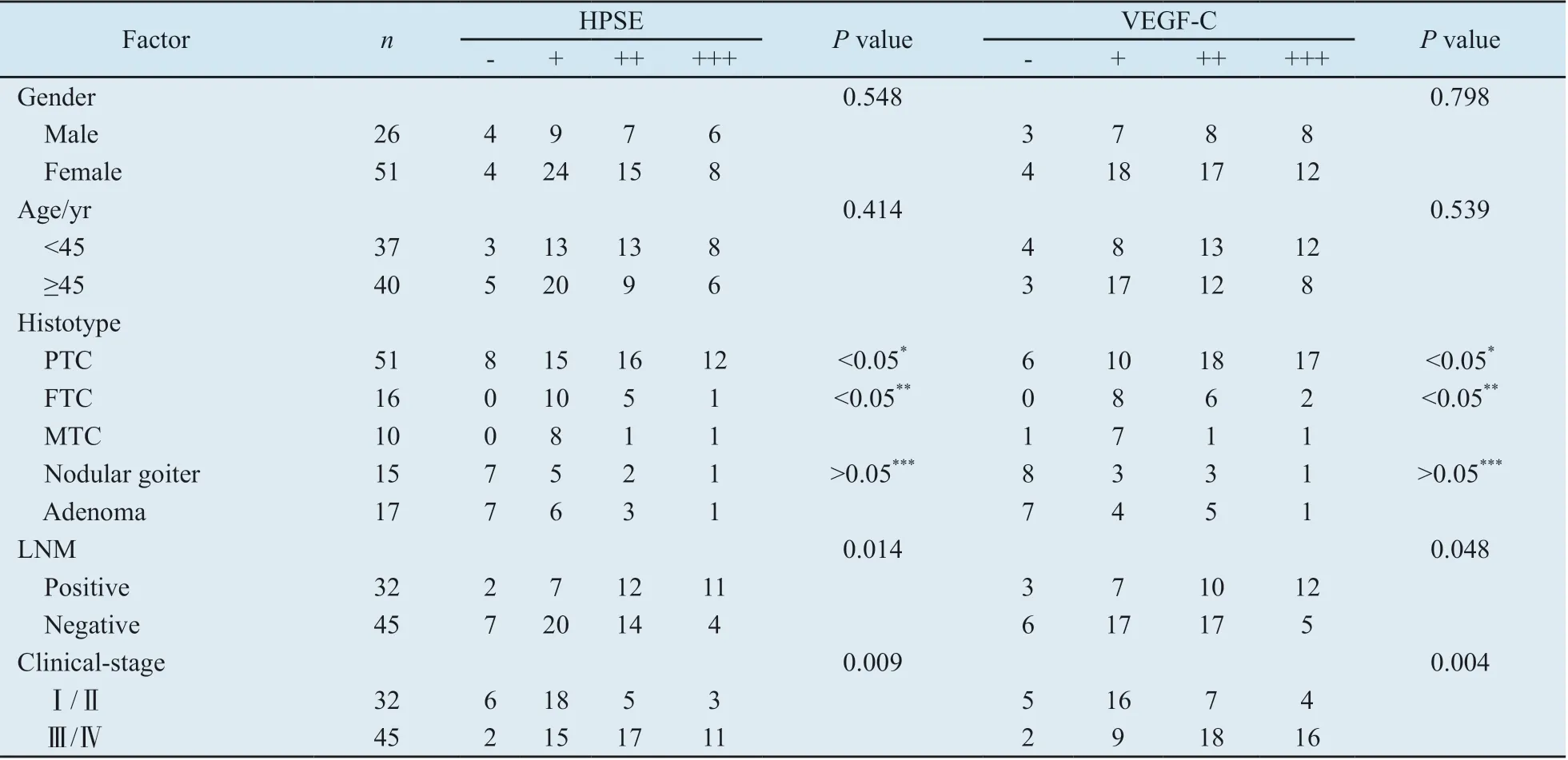
表1 HPSE和VEGF-C表达在各临床病理参数相关性比较Tab.1 Correlation of clinicopathologic parameters with HPSE and VEGF-C expressions
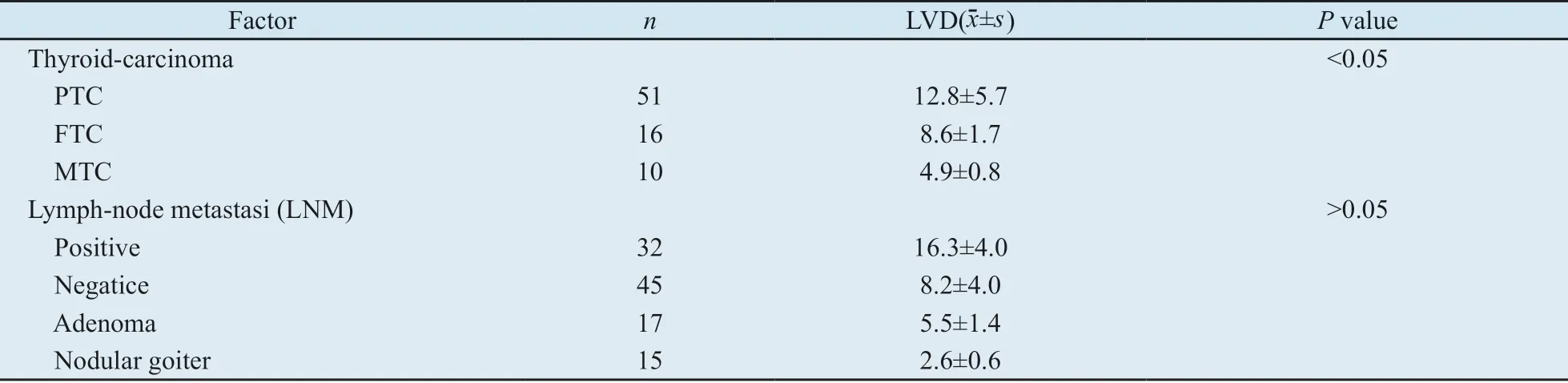
表2 D2-40在甲状腺癌、腺瘤及结节性甲状腺肿中的表达Tab.2 Expression of D2-40 in thyroid carcinoma, adenoma and nodular goiter
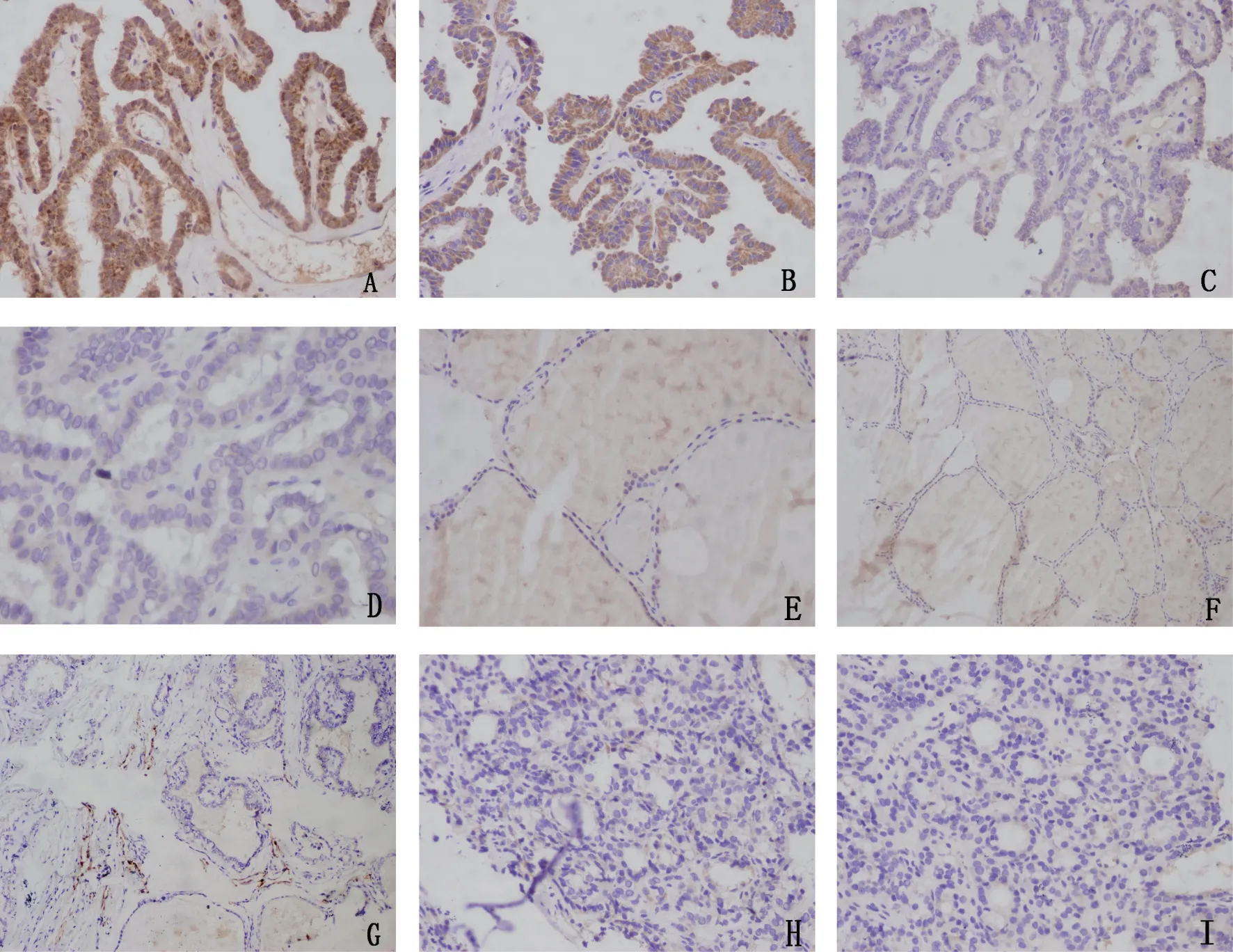
图1 HPSE、VEGF-C、D2-40在甲状腺癌、腺瘤、结节性甲状腺肿中的免疫标记图像Fig.1 Immunohistochemical staining image of HPSE, VEGF-C and D2-40 in thyroid carcinoma, adenoma and nodular goiter(SP)
3 讨 论
淋巴道转移是甲状腺癌最常见的转移方式,尤以乳头状癌为甚。近年来研究显示,淋巴道转移与淋巴管生成密切相关,随着淋巴管内皮细胞相关研究的进展及淋巴管内皮标记物的出现,淋巴管生成因子的研究取得了显著进展。VEGF-C是最先发现的淋巴管生成因子,其广泛存在于具有侵袭性的组织细胞中。VEGFR-3(即FIt-4)是VEGF-C的特异性受体,属于酪氨酸激酶受体, VEGF-C与VEGFR-3结合后,可诱导VEGFR-3酪氨酸激酶磷酸化,引起淋巴管内皮细胞增生,从而使淋巴管增生或扩张。同时还可激活Ras/有丝分裂激活的蛋白激酶信号转导通路或人组织激肽释放酶通路,刺激内皮细胞增生[3]。当前,VEGF-C/VEGFR-3淋巴管生成途径的研究多且深入,然而,学者们对是哪些物质促发肿瘤细胞分泌淋巴管生成因子却了解很少[4]。最近研究[5]表明HPSE与VEGF-C蛋白表达在头颈部肿瘤细胞呈明显正相关,尤其在淋巴结转移的肿瘤。HPSE是β-1,4葡萄糖苷内切酶,特异性地作用于硫酸肝素(heparinsullate,HS)并将其降解。HS侧链作为细胞外基质(extracellular matrix,ECM)和血管基底膜(basement membrane,BM)的主要成分,因而肝素酶对HS的降解破坏了ECM和BM的完整性[6-7]。在对于HPSE与肿瘤的侵袭和转移的相关性研究中,人们以前对于HPSE的研究主要集中在降解ECM蛋白成分和促进血管新生上。最近,Cohen-Kaplan等[5]研究得出HPSE可以促发肿瘤细胞释放VEGF-C,从而促发淋巴生成。LVD与头颈部肿瘤淋巴结转移正相关,且HPSE表达与LVD及VEGF-C水平正相关。本研究结果显示HPSE和VEGF-C在甲状腺癌组织中呈高表达,尤以乳头状癌表达为甚(P<0.05),这与乳头状癌以淋巴结转移为主,而滤泡癌和髓样癌主要以血道转移理论相一致。两者在淋巴结转移组阳性表达率明显高于无淋巴结转移组(P值分别为0.014与0.048),并且HPSE与VEGF-C在甲状腺癌组织中的蛋白表达呈正相关(P<0.001),其结果与Cohen-Kaplan等[5]报道相一致。另外,甲状腺癌中的高临床分期(Ⅲ/Ⅳ)HPSE和VEGF-C的表达显著高于低临床分期(Ⅰ/Ⅱ)。
由于淋巴管特异性标记物的缺乏,肿瘤淋巴管生成的研究落后于血管生成的研究。D2-40是新近发现的一种单克隆抗体,可识别一种相对分子质量为40×103的O-连接唾液酸糖蛋白,而该糖蛋白特异性地表达于淋巴管内皮,而不表达于血管内皮,其可以有效地评估甲醛和石蜡包埋的组织样本的淋巴管新生[8]。本研究采用免疫组织化学对同一张切片分别用血管特异性标记物CD34和D2-40进行对照试验,对相应结果进行认真比对,发现D2-40在CD34标记的管样结构中呈阴性表达,从而进一步证实了D2-40在甲状腺组织中标记淋巴管的特异性。本研究还发现,在HPSE表达高的病例中往往LVD也显著增高,VEGF-C表达与LVD也是相似关系。D2-40主要标记位于肿瘤外周的淋巴管上皮,而位于肿瘤间的小淋巴管很少表达。本研究结果与Yu等[3]结果相一致。
综上所述,本研究表明HPSE与VEGF-C在甲状腺癌淋巴结转移方面发挥了重要作用, HPSE或许是VEGF-C淋巴管新生的上游诱导物,有待进一步研究证实。由于HPSE、VEGF-C与LVD在淋巴结转移的甲状腺癌组织中表达增高,另外还发现一些患者虽临床病理未确诊颈部淋巴结转移,但其HPSE、VEGF-C及LVD表达也增高,说明这些患者有淋巴结转移潜在可能。因而,三者有望成为有效评估颈部淋巴结转移的临床病理分子指标。另外,检测肿瘤患者中三者的表达对于手术范围的选择具有重要参考价值,它可以指导确定手术切缘,防止过度治疗,从而提高患者的生活质量。
[1]邢光明, 曲明阳, 张桂平, 等.胃癌组织中血管生长因子C表达与血管和淋巴管生成及淋巴转移的关系[J].中华普通外科杂志, 2004, 19(6): 361-363.
[2]Weidner N.Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat, 1995, 36(2): 169-180.
[3]Yu XM, Lo CY, Chan WF, et al.Increased expression of vascular endothelial growth factor C in papillary thyroid carcinoma correlates with cervical lymph node metastases[J].Clin Cancer Res, 2005, 11(22): 8063-8069.
[4]Al-Raw MA, Mansel RE, Jiang WG.Molecular and cellular mechanisms of lymphangiogenesis[J].Eur J Surg Oncol, 2005, 31(2): 117-121.
[5]Cohen-Kaplan V, Naroditsky I, Zetser A, et al.Heparanase induces VEGF C and facilitates tumor lymphangiogenesis[J].Int Cancer, 2008, 123: 2566-2573.
[6]Abboud-Jarrous G, Rangini-Guetta Z, Aingorn H, et al.Sitedirected mutagenesis, proteolytic cleavage and activation of human proheparanase[J].Bio Chem, 2005, 280(14): 13568-13575.
[7]Nasser NJ, Avivi A, Shushy M, et al.Cloning, expression, and characterization of an alternatively spliced variant of human heparanase[J].Bio chem Biophys Res Commun, 2007, 354(1): 33-38.
[8]Kahn HJ, Bailey D, Marks A.Monoclonal antibody D2-40, a new marker of lymphatic endothelium reacts with Kaposi’s sarcoma and a subset of angiosarcomas[J].Mod Pathol, 2002, 15(4): 434-440.

