吉西他滨诱导胰腺癌细胞BxPC-3中XIAP基因表达的研究
张潜 王洪林
重庆医科大学附属第一医院肝胆外科,重庆 400016
胰腺癌是一种临床表现隐匿、进展迅速、早期诊断困难、手术切除率低、预后不良的恶性消化道肿瘤。吉西他滨(gemcitabine,GEM)已经成为进展期和转移性胰腺癌标准的一线化疗药物,并已逐渐成为进展期胰腺癌标准化疗方案用药,虽已具有很明显的临床获益,但生存优势却很低[1-2]。其原因是药物使用过程中的耐药现象影响其疗效[3]。凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)是细胞内一类重要的凋亡抑制因子家族,包括X染色体连锁的凋亡抑制蛋白(X-linked inhibitor of apoptosis,XIAP)、神经元凋亡抑制蛋白(neuronal apoptosis inhibitory protein, NIAP)、生存素(survivin)和黑色素瘤IAP(ML-IAP,livin)等。有研究[4]指出,XIAP是IAPs家族中最有效的内源性caspases抑制因子。也有研究[5]显示,XIAP在多种肿瘤细胞中高表达,并与肿瘤的化疗抵抗相关。国内对应用GEM作用胰腺癌后,对XIAP这一重要凋亡相关蛋白的影响研究尚少,本研究旨在探讨GEM诱导胰腺癌细胞中XIAP的表达及其与化疗耐药可能的关系。
1 材料和方法
1.1 细胞株和主要试剂
1.1.1 细胞株 胰腺癌细胞株BxPC-3购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.1.2 试剂 GEM(法国礼来公司),RT试剂盒(TAKARA公司),XIAP引物(TAKARA公司合成),兔抗人XIAP抗体、兔抗人β-actin抗体和羊抗兔IgG抗体(北京中杉生物技术有限公司分装)。
1.2 实验方法
1.2.1 细胞培养与传代 用0.25%的胰酶+0.02% EDTA的消化液消化BxPC-3细胞,用含15%胎牛血清的DMEM培养基,在37 ℃、CO2体积分数5%,饱和湿度的细胞培养箱中培养,细胞每2~3 d按1∶3传代2次。
1.2.2 B x P C-3 细胞对G E M 的中效浓度(IC50)的测定 ⑴细胞以1×104/孔接种于含200 μL上述培养液的96孔板中,在37 ℃,CO2体积分数5%,饱和湿度的细胞培养箱中培养。⑵在各孔中加入最终浓度分别为1、2.5、5、10、20和40 μg/mL的GEM 20 μL,每个浓度设6个复孔,以不加药物细胞存活率为100%的孔和没有接种细胞的试剂孔分别作为细胞对照和空白对照。⑶细胞在浓度梯度药物作用下分别继续培养24 h和48 h,每孔加入5 mg/mL噻唑蓝(MTT)溶液20 μL,继续培养4 h。⑷吸干培养基,每孔加入二甲基亚砜液200 μL,室温摇床振荡10 min使结晶充分溶解。⑸在酶联免疫检测仪570 nm波长测各孔吸光度值。⑹细胞增殖存活率(%)=[(A实验组-A空白对照组)/(A细胞对照组-A空白对照组)]×100%,根据IC50计算软件得出24 h和48 h的IC50。
1.2.3 GEM对BxPC-3胰腺癌细胞内XIAP的诱导 细胞生长状态良好时,取1×106/瓶传代接种于2个装有培养基的25 cm2培养瓶中,加入3.10 μg/mL GEM继续培养,未加入GEM的细胞作为对照组。
1.2.4 流式细胞仪分析细胞周期及早期细胞凋亡 消化各组细胞至单细胞悬液状态,300×g离心3 min去上清液后PBS清洗再离心,重复3次,70%乙醇固定4 ℃保存,以100 mg/L的碘化丙啶溶液染色后在FACSVantage SE流式细胞仪上进行检测。
1.2.5 RT-PCR检测XIAP mRNA的表达 ⑴细胞总RNA的提取:实验组和对照组细胞,消化并计数后各取1×106于EP管中,用TRIzol法提取细胞并消化总RNA,将RNA溶于25 μL DEPC水,取5 μL RNA以80 V电压下行1%琼脂糖凝胶电泳,同时稀释60倍分别测定260 nm和280 nm的吸光度值,检验纯度,以公式:RNA浓度(μg/mL)=A260nm×稀释倍数×40计算RNA浓度,立即行RT-PCR反应。⑵RT-PCR反应:RT反应体系为:5×PrimeScriptTMBuffer 2 μL,PrimeScriptTMRTEnzymeMixⅠ 0.5 μL,Oligo dT Primer(50 μmol/L) 0.5 μL,Random 6 mers(100 μmol/L) 2 μL,总RNA 4.5 μL,RNaseFree dH2O加至10 μL。RT反应条件:37 ℃15 min,85 ℃ 5 s。XIAP引物序列为:5’-CAAGTGGTAGTCCTGTTTCAGC-3’(上游),5’-GGGTTAGGTGAGCATAGTCTGG-3’(下游),扩增产物片段长度为432 bp,内参为β-actin,序列为5’-CCACGAAACTACCTTCAACTCC-3’(上游),5’-ACTCGTCATACTCCTGCTTGCT-3’(下游),扩增产物片段长度为272 bp。PCR反应体系为:Taq酶(5 U/μL) 0.25 μL,10×PCRBuffer (Mg2+Free) 5 μL,MgCl2(25 mmol/L)3 μL,dNTPMix (各2.5 mmol/L)4 μL,上游引物(20 μmol/L)1 μL,下游引物(20 μmol/L)1 μL,灭菌蒸馏水加至 50 μL。PCR反应条件:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s(30个循环),72 ℃ 10 min,4 ℃保存。反应完毕后,取产物5 μL以1%琼脂糖凝胶电泳,Bio-Rad凝胶电泳成像仪成像,Quantity one分析各条带吸光度值,计算XIAP的mRNA相对值。
1.2.6 Western blot检测XIAP蛋白的表达 RIPA裂解液提取细胞总蛋白,取样本20 μg上样进行10%聚丙烯酰胺凝胶电泳后转至PVDF膜上,用含5%脱脂奶粉的PBS封闭1 h(4 ℃过夜)。分别加入兔抗人XIAP抗体及兔抗人β-actin抗体于4 ℃温育过夜,加入1∶1000 HRP标记的羊抗兔IgG抗体。化学发光试剂盒检测显影,凝胶成像测灰度进行数据分析。
1.3 统计处理 采用SPSS 13.0统计软件进行统计学处理,MTT结果采用多因素方差分析。流式分析,RT-PCR及Western blot检测采用单因素方差分析。多个样本间的多重比较采用SNK-q检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 GEM对胰腺癌BxPC-3细胞的增殖影响 MTT法显示GEM具有显著抑制胰腺癌BxPC-3细胞增殖的作用,且随着作用时间增加及GEM浓度增加,呈明显的时间依赖性和浓度依赖性;不同浓度组间、不同时间组间的细胞存活率均有显著性差异(F=15.36,P<0.05,表1)。
2.2 胰腺癌BxPC-3细胞对化疗药物GEM的中效浓度(IC50) MTT检测结果显示,GEM对BxPC-3细胞24及48 h时的IC50分别为1.05 μg/mL和3.10 μg/mL,细胞培养液中加入终浓度为3.10 μg/mL的GEM培养24、36、48和72 h作为实验组,以不含GEM培养的细胞作为对照组。
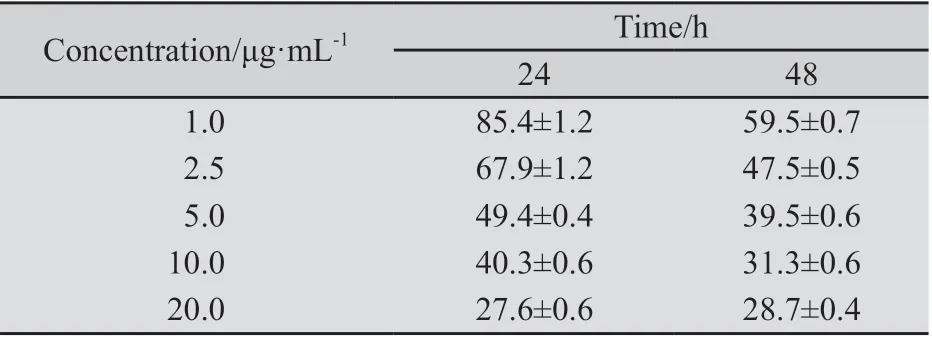
表1 GEM作用后BxPC-3细胞存活率Tab.1 The survival rate of BxPC-3 cells treated with different concentrations of GEM(%)
2.3 细胞周期分析及凋亡检测 流式细胞仪分析显示,3.10 μg/mL GEM作用24、36、48和72 h后,细胞被阻滞于G0/G1期,S期细胞比例降低。凋亡细胞比例随作用时间延长而增加,各实验组细胞G0/G1期细胞分别增至(47.5±2.1)%、(53.6±1.4)%、(57.2±2.0)%和(62.3±1.6)%,与对照组(2 7.6±1.3)%相比差异有统计学意义(P<0.05)。对照组BxPC-3细胞凋亡率较低,各实验组细胞凋亡率分别增加至(10.3±1.8)%、(14.2±1.5)%、(18.8±1.7)%和(20.3±2.0)%,实验组与对照组(1.23±1.6)%相比差异有统计学意义(F=146.24,P<0.05);24 h与36 h组间、36 h组与48 h组间比较,差异均有统计学意义(P<0.05);48 h与72 h组间比较,差异无统计学意义(P>0.05,图1)。
2.4 GEM作用胰腺癌BxPC-3细胞后XIAP mRNA的转录情况 以β-actin灰度为内参照,比较β-actin与目的基因XIAP条带灰度比值。3.10 μg/mL GEM分别作用24、36、48和72 h后,各实验组较对照组上升分别为(1.05±0.03)倍,(1.07±0.01)倍,(1.12±0.01)倍和(1.43±0.02)倍,随作用时间增加而增加,与对照组相比差异有统计学意义(F=83.72,P<0.05);提示XIAP mRNA的转录具有时间依赖性;24 h与36 h组间比较,差异无统计学意义(P>0.05),36 h组与48 h组间、48 h与72 h组间比较,差异均有统计学意义(P<0.05,图2)。
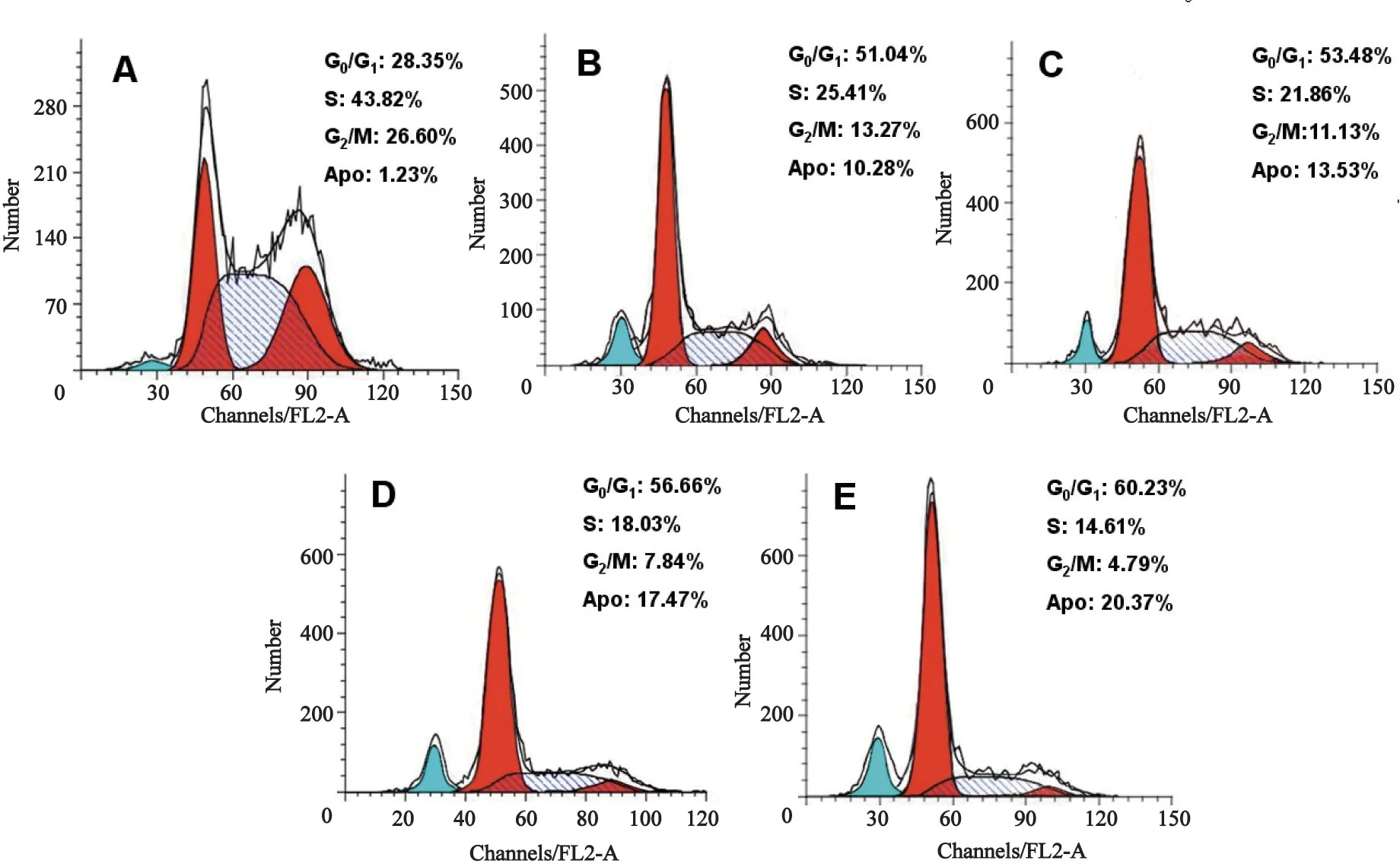
图1 细胞凋亡检测及周期分析Fig.1 Detection of cell apoptosis and analysis of cell cycle

图2 3.10 μg/mL GEM作用不同时间后BxPC-3细胞XIAP mRNA的转录Fig.2 The transcription of XIAP mRNA in the BxPC-3 cells treated with GEM at 3.10 μg/mL for variant sections
2.5 XIAP蛋白的表达 以β-actin的灰度为内参照,比较β-actin与目的基因XIAP条带灰度比值。3.10 μg/mL GEM分别作用24、36、48和7 2 h 后,各实验组较对照组上升分别为(1.82±0.13)倍,(2.04±0.18)倍,(2.60±0.12)倍和(3.95±0.06)倍,随作用时间增加而增加,不同时间组间存在显著性差异,提示XIAP的表达具有时间依赖性(F=103.58,P<0.05);24 h与36 h组间比较,差异无统计学意义(P>0.05),36 h组与48 h组间、48 h与72 h组间比较,差异均有统计学意义(P<0.05,图3)。

图3 3.10 μg/mL GEM作用不同时间后BxPC-3细胞XIAP表达Fig.3 The expression of XIAP in the BxPC-3 cells treated with GEM at 3.10 μg/mL for variant sections
3 讨 论
IAPs表达上调是大多数肿瘤细胞的一个共同特征,XIAP作为IAPs家族中备受重视的成员,在包括胰腺癌在内的多种肿瘤中均呈高表达,并与肿瘤细胞对化疗药物的耐药性相关[6-7]。Shrikhande等[8]研究发现胰腺癌患者的XIAP mRNA水平是对照组的2.1倍,分析发现胰腺癌低生存率的患者有较高的XIAP mRNA水平的趋势,通过靶向XIAP的SiRNA使Capan-1和T3M4两种胰腺癌细胞增殖降低,两细胞系对GEM敏感性都得以增加。杜冀晖等[9]通过转染胞质表达型Smac基因至化疗抵抗Panc-1细胞,发现明显下调其XIAP表达,显著提高顺铂、5-FU诱导的细胞凋亡率,得出胰腺癌细胞XIAP的表达水平下调与其化疗敏感性有关的结论,认为XIAP是克服化疗抵抗的重要靶分子,而上调Smac可拮抗XIAP的凋亡抑制作用,协同化疗药物促进胰腺癌细胞凋亡。Mcmanus等[10]和Lima等[11]均通过RNA干扰(RNAi)技术阻断了XIAP后增强了癌细胞的化疗敏感性。
GEM是细胞周期特异性抗代谢类药物,主要作用于DNA合成期的肿瘤细胞,可阻止细胞由G1期向S期的进展。GEM在细胞内转化成吉西他滨磷酸盐,后者可使DNA链合成停止,进而DNA断裂、细胞死亡,从而发挥抗癌作用。
本研究结果表明,GEM具有显著抑制胰腺癌BxPC-3细胞增殖的作用,且呈明显的浓度依赖性和时间依赖性。GEM对BxPC-3细胞的24 h及48 h的IC50分别为1.05 μg/mL和3.10 μg/mL,表明细胞对GEM的敏感性随时间的增加而降低。3.10 μg/mL GEM作用胰腺癌BxPC-3细胞后,流式细胞仪分析表明:细胞阻滞于G0/G1期,并发生凋亡,且凋亡细胞比例随作用时间的延长而增加,24 h组和36 h组间、36 h组和48 h组间比较差异均有统计学意义,但在48 h组和72 h组间比较差异无统计学意义,表明胰腺癌BxPC-3细胞对GEM有药物抵抗性,并且药物抵抗性在用药约48 h左右能够表现出来。RT-PCR及Western blot结果表明,XIAP mRNA转录及蛋白表达都随着GEM作用时间增加而增加,在24 h组和36 h组间比较差异无统计学意义,但在36 h组和48 h组间、48 h组和72 h组间比较差异有统计学意义,说明GEM能诱导XIAP的增加,呈时间依赖性,XIAP表达增加可能是胰腺癌BxPC-3细胞对GEM抵抗性的表现之一。增加的XIAP可能参与并影响了GEM诱导的细胞凋亡过程,在凋亡执行过程中XIAP增加使凋亡受阻,进而促进化疗耐药得以实现。
本研究主要探讨了GEM对胰腺癌BxPC-3细胞的作用,GEM能使细胞凋亡,但随着作用时间的延长,其对药物的敏感性减低;XIAP这一凋亡抑制蛋白家族重要成员的表达随作用时间延长而增加,XIAP表达增加可能是胰腺癌细胞逃避化疗药物杀伤的机制之一,可能参与了BxPC-3对GEM的耐药性的产生,对后续针对靶向凋亡抑制因子XIAP的抗胰腺癌研究有重要意义。
[1]Pino SM, Xiong HQ, Mc Conkey, et al.Novel therapies for pancreatic adenocarcinoma [J].Curr Gastroenterol, 2004, 6(2): 119-125.
[2]El-Rayes BF, Philip PA.A review of systemic therapy for advanced pancreatic cancer [J].Clin Adv Hematol Oncol, 2003, 1: 430-434.
[3]Sunamura M, Egawa S, Fukuyama S, et al.Chemotherapy for pancreatic cancer[J].Pancrease, 2004, 28(3): 219-230.
[4]Holeik M, Korneluk RG.XIAP, the guardian angil[J].Nat Rev Mol Cell Biol, 2001, 2(7): 550-556.
[5]Ferreira CG, van der Valk P, Span SW, et al.Assessment of IAP (inhibitor of apoptosis) proteins as predictors of reponse to chemotherapy in advanced non-small cell lung cancer patients[J].Ann Oncal, 2001, 12: 799-805.
[6]Chakravarti A, Noll E, Black PM, et al.Quantitatively determined surviving expression levels are of prognostic value in human gliomas[J].Clin Oncol, 2002, 20(4): 1063-1068.
[7]Wagenknecht B, Glaser T, Naumann U, et al.Expression and biological activety of X-linked inhibitor of apotosis (XIAP) in human malignant glioma[J].Cell Death Differ, 1999, 6(4): 370-376.
[8]Shrikhande SV, Kleeff J, Kayed H, et al.Silencing of X-linked inhibitor of apoptosis (XIAP) decreases gemcitabine resistance of pancreatic cancer cells[J].Anticancer Res, 2006, 26(5A):3265-3273.
[9]杜冀晖, 张厚德, 雷萍, 等.凋亡抑制蛋白XIAP和促凋亡因子Smac在胰腺癌化疗抵抗中的作用[J].中华微生物学和免疫学杂志, 2005, 25(10): 794-798.
[10]Mcmanus DC, Lefebvre CA, Cherton-Horvat G, et al.Loss of XIAP protein express by RNAi and antisense approaches sensitize cancer cells to functionally diverse chemoherapeutics[J].Oncogene, 2004, 23(49): 8105-8177.
[11]Lima RT, Matins LM, Guimaraes JE, et al.Specific downregulation of bcl-2 and XIAP by RNAi enhances the effects of chemotherapeutics agents in MCF-7 human breast cancer cells[J].Cancer Gene Ther, 2004, 11(5): 309-316.

