Syndecan-1和HPA-1 mRNA在胃癌组织中的表达及其与胃癌侵袭转移的关系
亓玉琴 司君利 李文利 王贺 周长宏 许琳
青岛大学医学院附属青岛市市立医院消化科,山东 青岛 266011
胃癌是消化系统最常见的恶性肿瘤之一,其死亡率居恶性肿瘤之首,肿瘤的侵袭转移是其主要原因,因此寻找引发肿瘤细胞侵袭与转移的因素并进行有效阻断一直是当前研究的热点和难点[1]。胃癌的侵袭和转移涉及多个步骤,其中穿越由细胞外基质和基底膜组成的屏障是必不可少的一步。该屏障主要由2种成分构成:一是结构蛋白,二是糖氨聚糖,后者的主要成分是硫酸乙酰肝素蛋白多糖(heparan sulphate proteoglycan,HSPG)。Syndecan-1是HSPG家族的一员,HPA-1基因编码的蛋白质是唯一降解 HSPG硫酸肝素(HS)侧链的核苷内切酶,并可促进肿瘤的侵袭转移[2]。但有关Syndecan-1 及HPA-1在胃癌的表达水平及两者与胃癌侵袭转移的关系鲜见报道。本研究利用敏感的实时荧光定量逆转录聚合酶链反应(RTPCR),检测手术切除的胃癌组织、配对的癌旁组织(距癌2 cm)及配对远离癌灶的手术切缘正常组织(距癌灶大于5 cm)中Syndecan-1及HPA-1基因的表达水平,进一步明确两者与胃癌侵袭转移的关系。
1 材料和方法
1.1 标本来源 标本取自青岛市立医院普外科2008年8月—2009年6月手术切除的肿瘤组织共58例,标本均经病理科2位以上的资深医师证实,术前均未接受任何化疗或放疗,且均进行了局部淋巴结的清扫。58例标本均为原发性胃癌,并配对癌旁组织(距癌边缘2 cm)及配对手术切缘正常组织(距癌边缘5 cm以上),手术切除的标本立即放于-70 ℃冰箱中冻存备用于实时荧光定量逆转录聚合酶链反应(RTPCR)。
1.2 临床资料 58例胃癌患者中男性33例,女性25例;年龄23~71岁,平均年龄52岁;肿瘤直径<5 cm者26例,直径>5 cm者32例;中、高分化腺癌10例,低分化及未分化腺癌48例;无淋巴结转移者3例,有淋巴结转移者55例;无血行转移者9例,有血行转移者49例;浸润深度T1/T2者3例,T3/T4者55例;胃癌患者的临床分期按国际抗癌联盟新TNM分期:Ⅰ期、Ⅱ期8例,Ⅲ期、Ⅳ期50例。
1.3 主要试剂和仪器 Simply P 总RNA提取试剂盒(杭州博日科技有限公司);RT-PCR试剂盒(TaKaRa公司)。定量PCR(Rotor-gene 3000 Real-Time PCR System)。
1.4 荧光定量PCR检测Syndecan-1 mRNA和HPA-1 mRNA
1.4.1 RNA提取 严格按照Simply P总RNA提取试剂盒的说明进行RNA提取。所得RNA A260nm/A280nm>1.7,符合纯度要求。利用琼脂糖凝胶电泳检测其完整性。
1.4.2 反转录及PCR扩增 提取的总RNA按照大连宝生物工程有限公司(TaKaRa公司)RT-PCR反应试剂盒的说明进行反转录和PCR扩增。HPA-1的引物:上游为5’- CCTTGCCACCTTTAATGGAA-3’,下游为5’-AAGCAGCAACTTTGGCATTT-3’,扩增产物的长度为105 bp;Syndecan-1引物:上游为5’-GGGACTCAGCCTTCAGACAG-3’,下游为5’-CTCGTCAATTTCCAGGAGGA-3’,扩增产物的长度为128 bp; 内参的引物:上游为5’-TCATGGGTGTGAACCATGAGAA-3’,下游为5’-GGCATGGACTGTGGTCATGAG-3’,扩增产物的长度为146 bp。PCR反应体系中含SYBR Premix Ex TaqTM10μL,上下游引物各0.8 μL,模板cDNA2 μL,ddH2O 6.4 μL。PCR反应的条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 45 s,共40个循环。实时连续测定扩增过程中产生的荧光,建立标准曲线。同时取扩增产物4 μL,2%琼脂糖凝胶进行电泳,溴化乙锭进行染色,紫外灯下观察结果。
1.4.3 结果判断 目的基因表达阳性的标本荧光定量扩增曲线呈现S型,电泳图见特异性条带;阴性标本则成不规则波浪线,未见特异性条带。△Ct=样本Ct均值-内参照Ct均值,△△Ct=△Ct-(随机阴性对照样品Ct均值-该样品内参照Ct均值),以2-△△Ct表示样品中目的基因mRNA相对表达量。样品中Ct均值<30表示为目的基因阳性表达。
1.5 统计处理 应用SPSS16.0统计软件,组间计量资料的比较采用t检验,计数资料的比较采用χ2检验。Syndecan-1和HPA-1在胃癌组织中表达的相关性用Spearman进行相关性检验分析。P<0.05为差异有显著性统计学意义。
2 结 果
2.1 不同胃组织中HPA-1及Syndecan-1的表达 胃癌组织HPA mRNA阳性表达有50例,阳性表达率为86.2%(50/58),明显高于癌旁组织27.6%(16/58)和正常组织5.2% (3/58)(P均<0.001),癌旁组明显高于正常组织(P均<0.05)(表1及表2)。正常组织Syndecan-1 mRNA阳性表达率有57例,阳性表达率为98.3%(57/58),明显高于癌旁组织25.9%(15/58)和胃癌组5.2%(3/58)(P均<0.001),癌旁胃组织明显高于胃癌组(P均<0.05)(表1及表2)。不同胃癌组织中,HPA-1 mRNA和Syndecan-1扩增曲线呈典型的S型(图1),融解曲线为单峰,排除非特异性扩增及引物二聚体的出现(图2)。电泳图可见特异性条带(图3)。
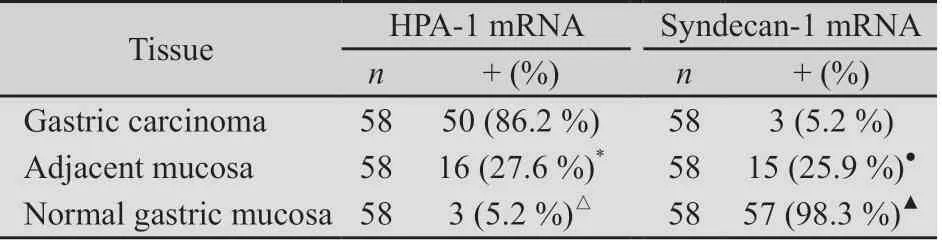
表1 HPA-1 mRNA及Syndecan-1 mRNA在不同胃组织中的表达 Tab.1 The expression of HPA-1 mRNA and Syndecan-1 mRNA in various gastric tissues
表2 不同胃组织中Syndecan-1 mRNA和HPA-1 mRNA的表达Tab.2 Comparison of the expression of HPA-1 mRNA and Syndecan-1 mRNA in various gastric tissues(±s , 2△△Ct)
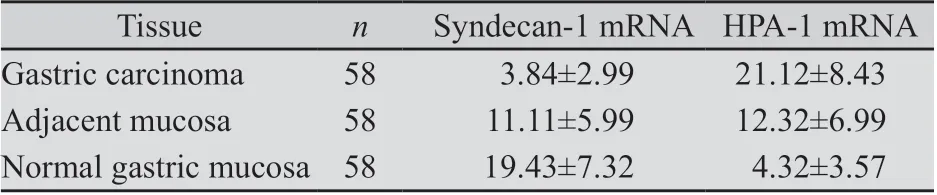
表2 不同胃组织中Syndecan-1 mRNA和HPA-1 mRNA的表达Tab.2 Comparison of the expression of HPA-1 mRNA and Syndecan-1 mRNA in various gastric tissues(±s , 2△△Ct)
?
图1 胃癌组织中HPA-1 mRNA荧光定量扩增曲线Fig.1 The amplification curves of HPA-1mRNA acquired from real-time PCR analysis in gastric carcinomas
图2 胃癌组织中HPA-1 mRNA荧光定量融解曲线Fig.2 The melt curves of HPA-1 mRNA acquired from real-time PCR analysis in gastric carcinoma
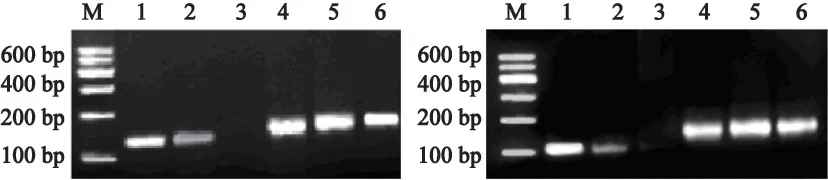
图3 不同胃组织中Syndecan-1和HPA-1PCR扩增产物电泳图Fig.3 Agarosegel electrophoresis of the sydencan-1 and HPA-1 PCR production in various gastric tissues
2.2 胃癌HPA-1 mRNA及Syndecan-1 mRNA的表达及其与临床病理特征的关系 本研究中通过RT-PCR显示,胃癌中HPA-1及Syndecan-1的阳性表达率(表3)。低分化及未分化者(93.8%和2.1%)、侵至浆膜外者(93.5%和0)、有淋巴结转移者(89.1%和1.8%)、有血行转移者(91.8%和2.0%)、临床分期Ⅲ/Ⅳ期者(94.0%和2.0%)明显高于高中分化者(50.0%和20.0%)、侵至浆膜者(58.3%和25.0%)、无淋巴结转移者(33.3%和66.7%)、无血行转移者(55.6%和22.2%)及临床分期Ⅰ/Ⅱ期者(37.5%和25%)(P均<0.05)。
2.3 Syndecan-1和HPA-1在胃癌组织中表达的相关性 相关性检验结果表明,在胃癌组织中,Syndecan-1表达与HPA-1表达呈负相关(r=-0.415,P=0.006)。
3 讨 论
Syndecan-1是一种跨膜硫酸乙酰肝素糖蛋白聚糖,主要由上皮细胞表达,亦可表达于成纤维细胞和浆细胞中,是细胞间质、细胞质膜的重要组成成分。Syndecan-1通过促进细胞-基质和细胞-细胞黏附来阻止细胞脱落和侵袭,从而限制了肿瘤的恶性表型。当正常细胞恶变后,细胞膜表面的Syndecan-1表达常明显下降或缺失,这可能导致了细胞丧失生长接触抑制的功能,使肿瘤细胞大量增殖,并具有极强的侵袭活性和转移潜能。有研究发现,Syndecan-1在人类多种恶性肿瘤中表达降低[3-4]。Syndecan-1在胃异型增生组织中的表达呈下降趋势,在胃癌组织中的表达减弱或者丢失,提示Syndecan-1在胃癌的发生过程中可能起重要的作用[5-6]。为此,本实验利用实时荧光定量PCR对Syndecan-1在基因水平进行了定量检测。研究结果显示:胃正常黏膜组织中Syndecan-1 mRNA几乎均呈阳性表达,阳性表达率98.3%,配对癌旁组织(距癌边缘2 cm)阳性表达(25.9%)较配对远离胃癌的手术切缘正常胃组织(距癌灶大于5 cm)明显降低(P<0.001),原发性胃癌几乎未见表达(6.9%),这与Fujiya等[7]关于大肠腺瘤进展到癌及浸润癌Syndecan-1异常表达的研究结果一致。在肿瘤分化程度较高、出现淋巴结转移、远处转移及临床分期Ⅲ-Ⅳ的胃癌组织中Syndecan-1表达水平降低,随着胃癌浸润深度的增加,Syndecan-1的表达水平逐渐下降。目前的研究认为,浸润深度、淋巴结转移、远处转移和TNM分期,是胃癌的独立预后指标[8],Syndecan-1 mRNA的表达与这些因素相关,可能意味着Syndecan-1的表达减少可促进恶性肿瘤的侵袭转移。已有研究表明,Syndecan-1与肿瘤侵袭转移密切相关[9-10]。Qi等[11]利用免疫组织化学证明了Syndecan-1在胃癌癌前的各个阶段几乎均有表达,随着胃黏膜组织由癌前状态发展为胃癌,Syndecan-1黏附蛋白表达显著下降,出现远处淋巴结转移时Syndecan-1表达更明显下调,阳性率降至24.56%。进一步研究证明,当正常细胞恶变后,细胞膜表面的Syndecan-1分子的表达常发生改变,并且与肿瘤的恶性程度及预后有一定的相关性。在头颈部鳞状细胞癌患者中,Syndecan-1表达越高者,生存时间越长。Syndecan-1降低的胃癌患者,5年生存率显著低于高表达者,提示该基因的表达异常有可能成为估计预后的较好指标。综上所述,Syndecan-1可能成为肿瘤基因治疗的分子靶点,并可能成为肿瘤诊断、病情进展和预后判断的重要指标。

表3 胃癌HPA-1及Syndecan-1表达与胃癌临床病理特征的关系Tab.3 Correlation of HPA-1 and Syndecan-1 expression with clinic pathological features in gastric carcinoma
HPA-1是一种新近被克隆出来的基因,它编码的蛋白质被认为是一种降解细胞表面跨膜硫酸乙酰肝素蛋白聚糖(heparan sulfate protoglycan,HSPG)的硫酸乙酰肝素(heparan sulfate,HS)侧链的核苷内切酶。HPA-1在恶性组织中普遍存在,在正常组织细胞的表达水平较低。在早期的研究中发现,其主要表达于胎盘和一些淋巴样组织中,而这些组织中的细胞具有较强的增殖和穿透基底膜进行迁移的能力。HPA-1通过特异性地识别并切断HSPGs中的HS侧链,进而影响有机体的微环境,在妊娠、形态发育、炎症扩散、血管生成,特别是肿瘤侵袭和转移中发挥作用。Endo[12]分析表明HPA-1的表达与胃癌的侵袭发展密切相关。毛敬等[13]通过基因转染卵巢癌SKOV3细胞实验证实,转染HPA基因能促进卵巢癌细胞的生长增殖,增强卵巢癌细胞的侵袭转移能力。说明HPA可能在肿瘤的侵袭和转移中发挥重要作用。本实验利用实时荧光定量PCR对HPA-1 mRNA进行定量检测,结果显示:胃癌(86.2%)明显高于癌旁胃黏膜(27.6%)(P<0.001)和正常胃黏膜(5.2%)(P<0.001),癌旁胃黏膜明显高于正常胃黏膜(P<0.05)。与Kurokawa等[14]的研究结果相符。在胃癌组织中,HPA-1 mRNA的表达与反应胃癌侵袭、转移潜能和预后的组织病理学指标呈正相关,与陈俊强等[15]的研究结果相符。可见,HPA-1参与肿瘤的浸润转移,并且随着肿瘤浸润深度和恶性程度的增加,HPA-1 mRNA的表达逐渐增加。Ru等[16]的研究表明,HPA-1阴性表达组5年生存率明显高于阳性组,提示其与胃癌的转移和预后密切相关。已有许多学者将HPA-1作为抗肿瘤治疗的靶点,为肿瘤的诊断,治疗和判断预后提供了新的思路和方法。
本研究利用荧光定量PCR对Syndecan-1和HPA-1在基因水平进行联合定量检测,较免疫组织化学及普通RT-PCR敏感性强、特异性高,且关于两者蛋白质水平检测,国内外已有大量的报道[7,11,15]。本研究结果表明,Syndecan-1的低表达及HPA-1的高表达可促进胃癌的侵袭转移,两者对肿瘤的侵袭和转移具有协同作用。本实验在胃癌组织中对两者进行相关性检验,发现两者成负相关(r=-0.415),差异有统计学意义(P<0.05)。因此联合检测Syndecan-1和HPA-1有助于胃癌患者的诊断及胃癌的转移潜能、预后的判断。对于Syndecan-1表达阴性和HPA-1表达强阳性的胃癌患者术后应加强综合治疗,密切随访。
[1]Parkin DM, Bray F, Ferlay J, et al.Global cancer statistics[J].CA Cancer, 2005, 55(2): 74-108.
[2]Chen JQ, Zhan WH,He YL, et al.Expression of heparanase gene, CD44V6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinoma[J].World J Gastroenterol, 2004, 10: 776-782.
[3]Saqi A, Yun SS, Yu GH, et al.Utility of CD138(Syndecan-1)in distinguishing carcinomas from mesotheliomas[J].Diagn Cytopathol, 2005, 33(2): 65-70.
[4]Mitselou A, Ioachim E, Peschos D, et al.E-cadherin adhesion molecule and Syndecan-1 expression in various thyroid pathologies[J].Exp Oncol, 2007, 29(1):54-60.
[5]Huang MF, Zhu YQ, Chen ZF, et al.Syndecan-1 and E-cadherin expression in differentiated type of early gastric cancer[J].World J Gastroenterol, 2005, 11(19): 2975-2980.
[6]Watari J, Saitoh Y, Fujia M, et al.Reduction of Syndecan-1 expression in differentiated type early gastric cancer and back ground mucosa with gastric cellular phenotype [J].J gastroenterol, 2004, 39(2): 104-112.
[7]Fujiya M, Watari J, Ashida T, et al.Reduced expression of Syndecan-1 affects metastatic potential and clinical outcome in patients with colorectal cancer [J].Jpn J Cancer Res, 2001, 92: 1074-1081.
[8]Shiraishi N, Inomata M, Osawa N, et al.Early and late recurrence after gastrectomy for gastric carcinoma.Univariate and multivariate analyses [J].Cancer, 2000, 89: 255-261.
[9]Hirabayashi K, Numa F, Sumainami Y, et al.Altered proliferative and metastatic potential associated with increased expression of Syndecan-1 [J].Tumor Biol, 1998, 19(6): 454-463.
[10]Reiland J, Sanderson RD, Wanguespack M, et al.Heparanase degrades Syndecan-1 and perlecan heparin sulfate: function implication for tumor cell invasion [J].J Biol Chem, 2004, 279(9): 8047-8055.
[11]QI YX, Song X, Chen J, et al.Expression of Syndecan-1 at different stages in the course of gastric carcinoma and its significance [J].China J Oncol, 2007, 29(3): 193-196.
[12]Endo K, Maejara U,Baba H, et al.Heparanase gene expression and metastatic potential in human gastric cancer [J].Anticancer Res, 2001, 21: 3365-3369.
[13]毛敬, 辛晓燕, 刘玉, 等.乙酰肝素酶基因转染SKOV3细胞对细胞增殖、黏附、侵袭能力的影响[J].中国癌症杂志, 2006, 16(1): 9-13.
[14]Kurokawa H, Katsube K, Podyma KA, et al.Heparanase and tumor invasion patterns in human oral squamous cell carcinoma xenografts [J].Cancer Sci, 2003, 94: 277-285.
[15]陈俊强, 詹文化, 何裕隆, 等.乙酰肝素酶基因表达与胃癌临床病理特点的关系[J].中华肿瘤杂志,2004,26(10): 609-611.
[16]Ru GQ, Zhao ZS, Tang QL, et al.mRNA expression of Syndecan-1 and heparanase-1 in relation to tumor progression and prognosis of gastric carcinoma [J].Chin J Surg, 2006, 44(15): 1062-1063.

