超滤法纯化酪蛋白凝乳酶水解物中的酪蛋白糖巨肽
何扩,张秀媛,袁永俊
(1.河北北方学院食品科学系,河北 张家口 075131;2.西华大学生物工程学院,四川 成都 610039)
超滤法纯化酪蛋白凝乳酶水解物中的酪蛋白糖巨肽
何扩1,张秀媛1,袁永俊2
(1.河北北方学院食品科学系,河北 张家口 075131;2.西华大学生物工程学院,四川 成都 610039)
研究超滤法分离纯化了(CGMP)的条件,得到超滤的最佳条件是在室温下,压差为0.02 MPa,浓缩比为8。通过此方法得到比较纯的CGMP,蛋白回收率为1.77%,糖基化程度(唾液酸/蛋白质)为70.1 μg/mg,并且此方法适用于工业化生产。
酪蛋白糖巨肽;超滤;唾液酸
酪蛋白糖巨肽(CGMP)是蛋白酶酶解κ-酪蛋白得到的C末端亲水性糖肽,其独特的氨基酸组成和含有丰富的唾液酸使其具有多种生理功能,如能抑制胃分泌物;能调节免疫系统反应;能抑制病原体包括病毒和细菌等黏附至细胞;能结合霍乱和埃希氏大肠杆菌的肠毒素等。除此之外,CGMP还是苯丙酮尿患者膳食中的首选成分,并且在控制肝病方面也有成效[1-2]。有人对沉淀法和离子交换树脂分离纯化胃蛋白酶水解酪蛋白的水解物制备CGMP的条件进行了研究[3-4]。本文对超滤法分离纯化凝乳酶水解酪蛋白的水解物制备CGMP的条件进行了研究,此方法适用于工业化生产。
1 材料与方法
1.1 材料与仪器
干酪素(BR)、间苯二酚(AR)、考马斯亮蓝G-250(BR)、醋酸铵(AR):成都市科龙化工试剂厂;凝乳酶(1:100000):上海阿敏生物技术有限公司;唾液酸标准品(HPLC);牛血清白蛋白(BR):上海伯奥生物技术有限公司;其它试剂均为国产分析纯。
PES-200超滤膜(切割分子量20000 u,有效过滤面积0.6 m2)、SMB-20型超滤装置:中科院上海原子核研究所;ZT60-600a型蠕动泵:保定兰格恒流泵有限公司;Superdex 7510/300 GL、AKTA purifier:Amersham Biosciences。
1.2 方法
1.2.1 酪蛋白水解液的制备及其初步分离[5]
酪蛋白浓度为10 mg/mL,凝乳酶/底物为0.6/100,温度为40℃,pH为6.6条件下,水解2.5 h后,调pH为8~8.5,在75℃水浴保温30 min终止反应,冷却后调pH为4.6,真空抽滤除去沉淀,并用一定量水洗涤沉淀,合并上清液和洗涤液调pH为7.0,即得到酪蛋白水解液,微滤后备用。

1.2.2 超滤工艺流程
1.2.3 超滤分离指标[6]
1.2.3.1 渗透通量J
单位时间内通过单位膜面积的渗透液的体积,单位通常用L/(m2·h)。本试验只用到了一种PES-200超滤膜,有效滤膜面积恒定,为了方便,用单位时间内通过膜的渗透液体积表示通量,单位为mL/min。
1.2.3.2 渗透通量衰减率
达到浓缩效果时渗透通量与初始渗透通量之差与初始渗透通量之比。
1.2.3.3 浓缩比
最初进料液体积与超滤过程中任意时间的浓缩液体积的比率。
1.2.4 超滤条件的选择
在室温下,研究超滤压差对渗透通量的影响、渗透通量衰减曲线和浓缩比对超滤性能的影响。
1.2.5 唾液酸含量的测定
采用间苯二酚-盐酸法[5]。
1.2.6 蛋白质含量测定
采用考马斯亮蓝比色法[7]。
2 结果与分析
2.1 超滤压差对渗透通量的影响
本试验中压差由泵的蠕动提供,考虑到泵的极限转速,测定了 0、0.01、0.02、0.03、0.04、0.05 MPa 不同压差下滤液通量的变化,见图2。
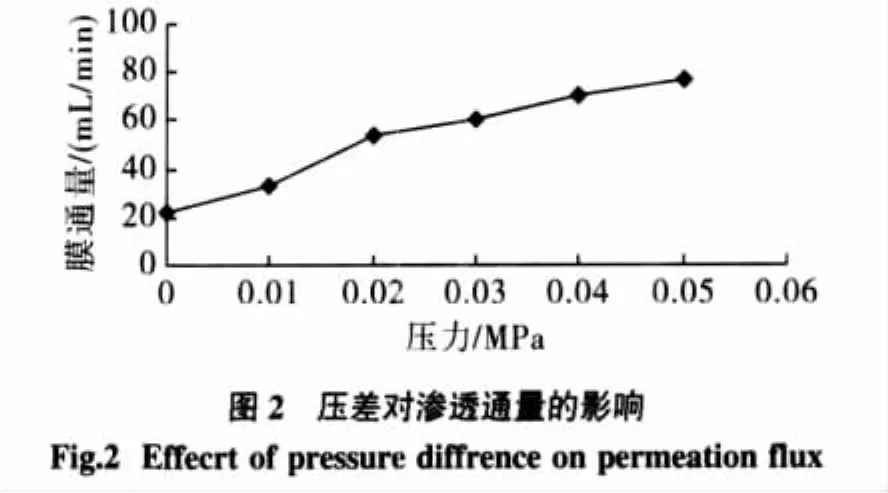
由图2可知,压差较小时,料液透过平均通量随压差的增加而增加较快,当压差达到0.02 MPa时,料液透过平均通量随压差增加变得增加缓慢,这符合超滤过程中浓差极化和凝胶层理论[8]。在低压范围内,压差的增加使小分子物质以很快的速度透过膜,而随着压差增大过程中,污染层被压实,浓差极化加剧,使膜污染加快,使透过速度增加缓慢。综合考虑选择0.02MPa作为超滤过程的压差。
2.2 渗透通量衰减曲线
研究了单级间歇操作中,在一定压力差下,2000mL酶解液随着渗透液体积的增加,膜平均通量的变化,见图3。

由图3可知,渗透通量变化基本上分为了两个阶段,即快速下降区和缓慢减少区。在开始渗透通量下降较快,当渗透液量达到300 mL时,渗透通量下降变得缓慢,说明开始浓差极化显著,当渗透液量达到300mL时,浓差极化基本上达到稳态。理论上在浓差极化层处于稳态,在未造成膜孔堵塞,也没形成不可逆覆盖层情况下,渗透通量应该会保持稳定,但是在实际操作过程中膜的污染是不可避免的,且会逐渐加重,渗透通量也必定会下降。
2.3 浓缩比对超滤性能的影响
采用单级间歇操作,考察对2000 mL酶解液分别浓缩2、5、8、10倍不同情况下蛋白质的回收率(浓缩液中蛋白质总含量与酶解前底物中蛋白质总含量之比)、通量衰减率、小分子的除去情况(用Superdex 7510/300 GL测定,洗脱液为0.1 mol/L醋酸铵,洗脱流速为0.5 mL/min、上样体积为 0.5 mL,检测波长 230 nm[9]。通过预实验得到11 mL~14 mL收集组分是CGMP)。
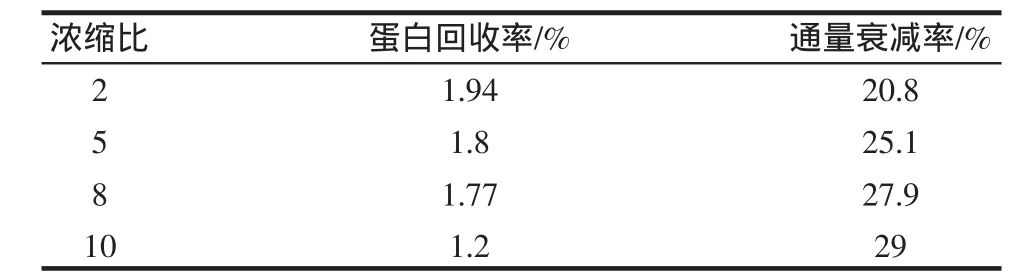
表1 不同浓缩比的超滤结果Table1 Ultrafiltration result of different volume concentration ratio
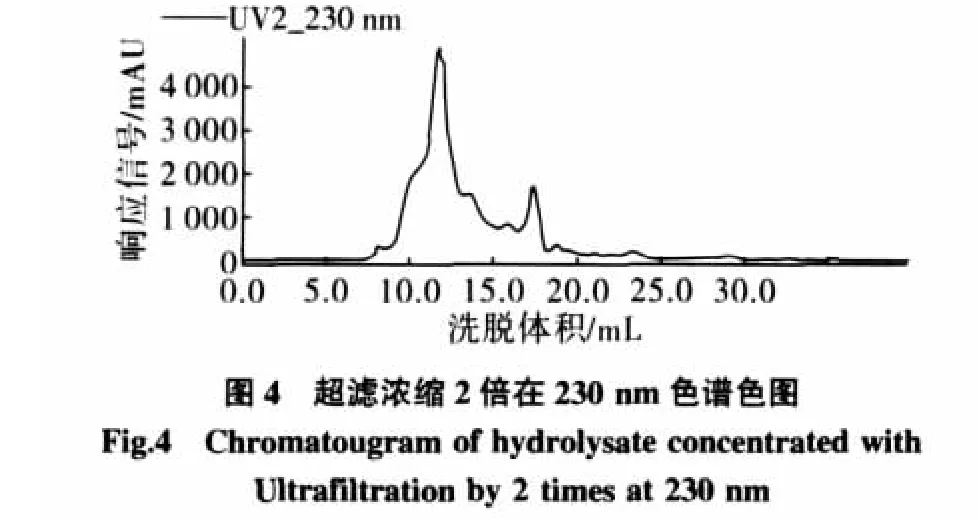

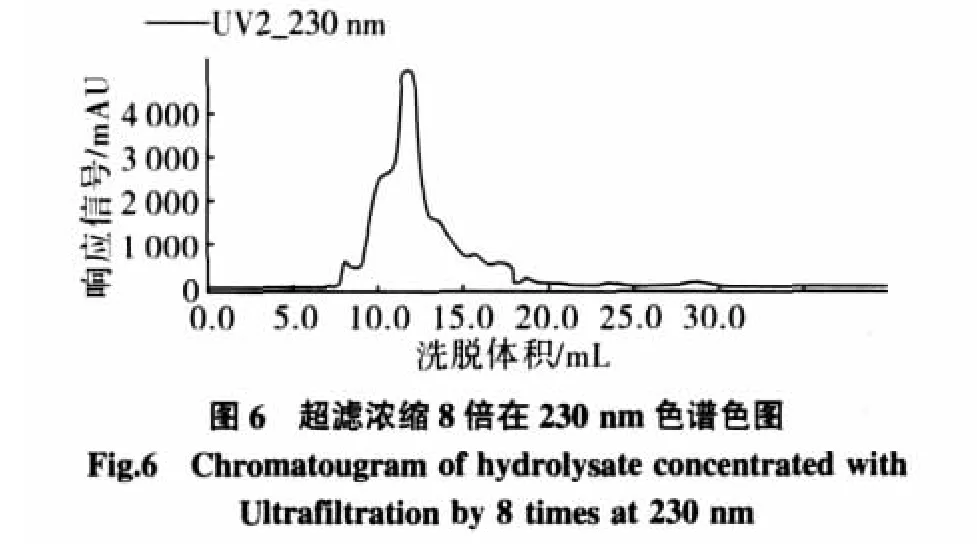

由表1和图4~图7可知,小分子物质随着浓缩比的增加越来越少,直到浓缩比为8倍时,如果继续浓缩小分子物质没有明显的减少,而蛋白回收率随着浓缩比的增大在减少,渗透通量衰减率随着浓缩比的增大在增加。考虑到对膜的保护和目标物的回收率,选择浓缩比为8。
3 结论
在室温下对超滤技术分离纯化CGMP的条件进行研究,得到超滤最佳条件是压差为0.02 MPa,浓缩比为8。通过此方法得到了比较纯的的CGMP,蛋白回收率为1.77%,糖基化程度(唾液酸/蛋白质)为70.1μg/mg,并且此方法适用于工业化生产。
[1]高志芳,钱方,陈莉,等.酪蛋白糖巨肽的生理功能及发展前景[J].食品研究与开发,2007,28(3):183-185
[2]李海平,程涛,霍贵成.乳源糖巨肽的生物活性[J].中国乳品工业,2002,30(5):74-77
[3]吴疆,庞广昌.酪蛋白糖巨肽的分离纯化研究[J].食品科技,2004(4):20-22
[4]刘剑虹,庞广昌.采用盐析及Q Sepharose FF分离纯化酪蛋白胃蛋白酶水解物中的酪蛋白糖巨肽[J].食品科学,2005,26(8):255-259
[5]张秀媛,袁永俊.凝乳酶水解酪蛋白生产酪蛋白糖巨肽工艺条件的研究[J].食品工业科技,2008(4):171-173
[6]赵婧.超滤与电渗析的组合分离γ-氨基丁酸发酵液[D].江南大学硕士学位论文,2006:8-9
[7]栾雨时,包永明.生物工程实验技术手册[M].北京:化学工业出版社,2005:11-12
[8]王湛,周翀.膜分离技术基础[M].北京:化学工业出版社,2006:193-240
[9]Nakano T,Ozimek L.Purification of Glycomacropeptide from Caseinate Hydrolysate by Gel Chromatography and Treatment with Acidic Solution[J].Food Chemistry and Toxicology,2000,65(4):588-590
Purifing Casein Glycomacropeptide from Chymosin Casein Hydrolysate by Ultrafiltration
HE Kuo1,ZHANG Xiu-yuan1,YUAN Yong-jun2
(1.Department of Food Science,Hebei North College,Zhangjiakou 075131,Hebei,China;2.College of Biological Engineerring,Xihua University,Chengdu 610039,Sichuan,China)
Ultrafiltration conditions with purifing CGMP were studied.Optimum ultrafiltration conditions were gained as follows:differential pressure 0.02 MPa,concentration ratio 8.The way not only prepares more pure CGMP,the rate of recovery of protein 1.08%,the degree of glycosylation(sialic acid/protein)78.9 μg/mg,but also fit for industrialized production.
Casein glycomacropeptide(CGMP);ultrafiltration;sialic acid
四川省教育厅重点科研项目(07205007)
何扩(1978—),男(汉),讲师,硕士研究生,研究方向:食品生物技术。
2009-05-22

