痰热清注射液对脓毒症大鼠免疫调节及生存率的影响
赵中江 孙冀武 邓 哲
广东省深圳市第二人民医院(深圳 518035)
相关研究发现,降钙素原(PCT)作为次级炎症因子,其升高水平与脓毒症严重程度有关[1]。肿瘤坏死因子-α(TNF-α)作为主要的致炎细胞因子,在引起机体失控性炎症反应与组织损害中发挥关键作用[2]。实验与临床研究显示,痰热清注射液具有调节免疫,减轻炎症反应的作用[3,4]。本研究旨在观察痰热清注射液对脓毒症大鼠PCT、TNF-α水平及生存率的影响,探讨痰热清注射液对脓毒症的治疗作用。现报告如下。
1 材料与方法
1.1 动物模型制备 清洁级Wistar大鼠,体重220~250g,购自南方医科大学实验动物中心。采用盲肠结扎穿孔法(CLP)复制Wistar大鼠肠源性脓毒症模型。大鼠实验前禁食12h,自由饮水,术前称体重,氯胺酮(100mg/kg)腹腔麻醉后固定,铺无菌孔巾,沿中下腹正中线切口2cm,暴露腹腔脏器,将盲肠提出,在距盲肠根部1cm血管弓处用7号丝线结扎盲肠,避免肠梗阻和肠坏死。用18号无菌针头贯穿盲肠3次,使肠内容物流出,避免伤及肠壁系膜血管,然后将盲肠放回腹腔,逐层缝合腹部切口。术毕动物皮下注射生理盐水10mL/kg抗休克,术后自由饮水。假手术组仅开腹翻动盲肠后关腹。
1.2 动物分组及给药 将112只大鼠按随机数字表法分为正常对照组(n=8)、假手术组(n=8)、模型组(n=48)及痰热清治疗组(n=48),模型组和痰热清治疗组又分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ6个亚组,每组8只大鼠。Ⅰ组大鼠观察CLP术后7d的生存率。Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ 5 个亚组分别为 CLP 术后 2、6、12、24、48h组。痰热清治疗组分别于CLP术后0.5、12h及其后每隔12h静注痰热清注射液(上海凯宝药业有限公司生产),剂量0.45mL/100g,模型组依同法分组并平行注射等量生理盐水作为对照。
1.3 标本采集及检测 各时间点心脏直接取血4mL,加入乙二胺四乙酸抗凝管中4℃下3000r/min离心15min后,取上清液-70℃保存。用ELISA法检测PCT和TNF-α的水平,试剂盒购于深圳精美生物工程有限公司。操作方法严格按试剂盒所附说明书进行。
1.4 统计学处理 应用SPSS 11.5统计软件。计量资料以()表示,采用方差分析及χ2检验。
2 结果
2.1 各组大鼠7d生存率的比较 模型组、痰热清治疗组的7d生存率分别为0和62.5%。痰热清治疗组的生存率明显高于模型组,差异有统计学意义(P <0.01)。
2.2 各组脓毒症大鼠血浆PCT水平比较 见表1。与正常对照组比较,假手术组血浆PCT水平无明显变化(P>0.05);与假手术组比较,模型组PCT水平在CLP后6h即明显升高,12h达到高峰,除2h时点外,各时点与假手术组比较差异有统计学意义(P <0.01);与模型组比较,痰热清治疗组PCT水平在6、12、24及48h 4个时点明显降低(P <0.01)。
表1 各组脓毒症大鼠血浆PCT水平比较(ng/mL,)
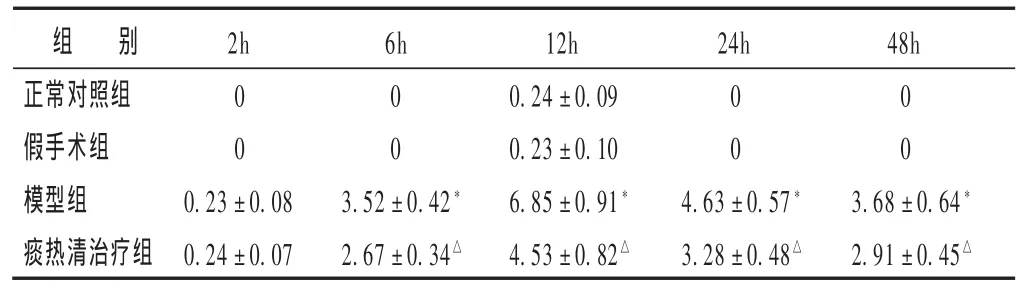
表1 各组脓毒症大鼠血浆PCT水平比较(ng/mL,)
与假手术组比较,*P<0.01;与模型组比较,△P <0.01。下同
组 别正常对照组假手术组模型组痰热清治疗组2h 6h 24h 48h 0 0 0 0 0 0 0 0 0.23±0.08 0.24±0.07 3.52±0.42*2.67±0.34△12h 0.24±0.09 0.23±0.10 6.85±0.91*4.53±0.82△4.63±0.57*3.28±0.48△3.68±0.64*2.91±0.45△
2.3 各组脓毒症大鼠血浆TNF-α水平比较 见表2。与正常对照组比较,假手术组血浆TNF-α水平无明显变化(P>0.05);与假手术组比较,模型组TNF-α水平在CLP后6h明显升高,12h达到高峰,除2h时点外,各时点与假手术组比较差异有统计学意义(P<0.01);与模型组比较,除2h时点外,痰热清治疗组TNF-α水平在各时点均明显降低(P<0.01)。
表2 各组脓毒症大鼠血浆TNF-α水平比较(ng/mL,)
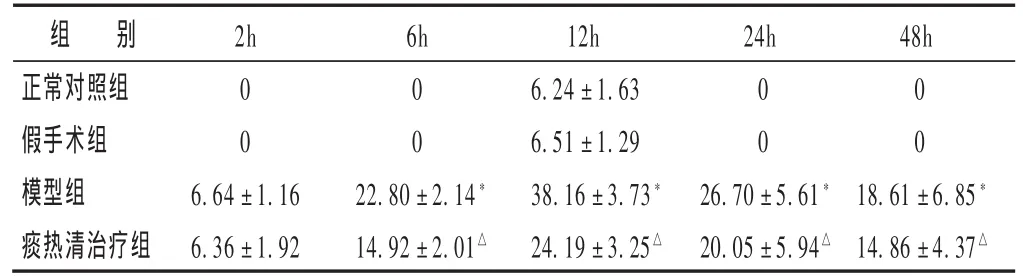
表2 各组脓毒症大鼠血浆TNF-α水平比较(ng/mL,)
组 别正常对照组假手术组模型组痰热清治疗组2h 6h 24h 48h 0 0 0 0 0 0 0 0 6.64±1.16 6.36±1.92 22.80±2.14*14.92±2.01△12h 6.24±1.63 6.51±1.29 38.16±3.73*24.19±3.25△26.70±5.61*20.05±5.94△18.61±6.85*14.86±4.37△
3 讨论
本实验采用经典CLP方法复制Wistar大鼠脓毒症模型。CLP模型模拟临床急性肠穿孔和腹膜炎的发病过程,能很好地反映脓毒症的病理生理变化,应用此模型进行的研究更具说服力。
PCT是一种由116种氨基酸残基组成的蛋白质。在正常代谢情况下,甲状腺C细胞内的PCT经蛋白水解后产生和分泌降钙素。正常个体的PCT值 <0.5ng/mL,试验条件下PCT的主要诱导源是细菌内毒素——脂质多糖(LPS)。LPS和其他多种炎症因子诱导PCT的产生,其升高程度不仅可反映引起炎症的病原体浓度还显示炎症反应程度。与其他细胞因子相比,LPS短时间内可诱导大量PCT生成,提示LPS可能直接促进PCT mRNA的表达和蛋白翻译[5]。在健康志愿者静脉注射一定量内毒素后3~4h PCT水平迅速升高,6~8h达平台期并持续24h以上[6]。PCT浓度的升高不受机体免疫抑制状态的影响。当机体处于严重的细菌感染或脓毒血症时,即使患者处于免疫抑制状态或尚无明显的临床表现,血浆中PCT浓度仍明显升高,其升高程度与感染严重程度呈正相关[6]。
动物实验提示PCT可能是一种次级炎性因子,它本身不能启动脓毒症反应,但可放大并加重脓毒症病理过程[1]。Reith及Brunkhorst等[7,8]的研究显示,脓毒症组患者的PCT值明显高于非脓毒症组,其升高水平与脓毒症的严重程度有关。此外PCT用于诊断脓毒症有较好的敏感性、特异性和准确性。与正常对照组比较,我们发现PCT在CLP后6h即明显升高,12h达到高峰,并持续至48h,且质量浓度均大于2ng/mL。
研究者曾对脓毒症的另外一些标志如WBC、白介素6、TNF-α、C反应蛋白、可溶性CD14与PCT进行系统比较,发现血清PCT是敏感性、特异性最佳的指标,最能及时反映炎症、脓毒症过程。一般情况下,脓毒症PCT均升高且>2ng/mL[9]。研究显示粒细胞减少症者PCT>0.5ng/mL则提示合并细菌感染,全身真菌感染包括念珠菌和曲霉菌也引起PCT显著增加[10]。通常PCT>5ng/mL提示重症感染,包括免疫抑制患者如艾滋患者,高浓度的PCT、特别是抗生素治疗后无下降者常提示预后不良[11]。Luzzani等[12]观察术后重症感染患者显示,C反应蛋白在所有病例治疗后均保持高水平,但PCT浓度在存活者中迅速下降,在死亡病例中处于高水平。PCT浓度变化可用来判断脓毒症和菌血症者抗生素治疗是否有效和临床情况是否改善。
TNF-α是参与多种生理与免疫过程的重要细胞因子,具有广泛的生物活性,目前认为其是参与全身炎症反应综合征、脓毒症等的重要炎症介质。脓毒症时,血清TNF-α水平升高,可反映感染的严重程度,与预后有较好的相关性[13]。我们的研究发现,血清TNF-α水平在CLP后6h即有明显升高。
既然PCT及TNF-α在脓毒症的发生发展中起重要作用,其升高的水平与脓毒症的严重程度及预后密切相关。降低PCT及TNF-α的水平,能有效改善脓毒症患者的预后。运用中药制剂对脓毒症进行免疫干预是一个研究方向。
痰热清注射液由黄芩、熊胆粉、山羊角、金银花、连翘组成。文献报道,痰热清对感染等所致急性肺损伤、肺泡炎性渗出和微血管损伤的低氧血症等病理状态有明显的改善作用,可减少多器官功能障碍等并发症的发生[3],同时具有调节免疫的作用,可降低TNF-α、IL-6水平,减少内毒素的产生和吸收,减轻炎性介质所致的炎症反应,减少多器官功能障碍的发生[4,14]。我们的研究发现,痰热清注射液对脓毒症大鼠的PCT及TNF-α的水平有明显的降低作用,可提高脓毒症大鼠的生存率,对脓毒症有很好的治疗作用。
[1]Whang KT,Vath SD,Becker KL,et al.Procalcitonin and proinflammatory cytokine interactions in sepsis[J].Shock,2000,14(1):73~78.
[2]Hadjiminas DJ,McMasters KM,Peyton JC,et al.Tissue tumor necrosis factor mRNA expression following cecal ligation and puncture or intraperitoneal injection of endotoxin[J].J Surg Res,1994,56(6):549 ~ 555.
[3]李澎涛,张娜,朱晓磊.痰热清注射液抗实验性急性肺损伤的研究[J].北京中医药大学学报,2003,26(1):22 ~25.
[4]潘彦舒,张娜,朱晓磊,等.痰热清注射液干预内毒素血症病理过程的相关性研究[J].中国中医基础医学杂志,2005,11(7):508~510.
[5]Oberhoffer M,Stonans I,Russwurm S,et al.Procalcitonin expression in human peripheral blood mononuclear cells and its modulation by lipopolysaccharides and sepsis-related cytokines in vitro[J].J Lab Clin Med,1999,134(1):49 ~ 55.
[6]Dandona P,Nix D,Wilson MF,et al.Procalcitonin increase after endotoxin injection in normal subjects[J].J Clin Endocrinol Metab,1994,79(6):1605 ~ 1608.
[7]Reith HB,Mittelktter U,Wagner R,et al.Procalcitonin (PCT)in patients with abdominal sepsis[J].Intensive Care Med,2000,26(2):165~169.
[8]Brunkhorst FM,Wegscheider K,Forycki ZF,et al.Procalcitonin for early diagnosis and differentiation of SIRS,sepsis,severe sepsis,and septic shock[J].Intensive Care Med,2000,26(2):S148 ~152.
[9]Cadet J.Rapid diagnostic methods in the detection of sepsis[J].Infect Dis Clin North Am,1999,13(2):483 ~494.
[10]Aouifi A,Piriou V,Blanc P,et al.Effect of cardiopulmonary bypass on serum procalcitonin and C-reactive protein concentrations[J].Br J Anaesth,1999,83(4):602 ~ 607.
[11]Gendrel D.Procalcitonin as a marker of bacterial infecfion[J].Pediar Infect Dis J,2000,19(8):679 ~ 68.
[12]Luzzani A,Polati E,Dorizzi R,et al.Comparison of procalcitonin and C-reactive protein as markers of sepsis[J].Crit Care Med,2003,31(6):1737 ~ 1741.
[13]KJ,Fong Y,Hesse DG,et al.Anti-cachectin/TNF monoclonal antibodies septic shock during lethaI bacteraemia[J].Nature,1987,330(6149):662 ~ 664.
[14]张黎莉,李展,徐晓月,等.痰热清胶囊的主要药效学研究[J].中国实验方剂学杂志,2004,10(3):37 ~40.

