二苯乙炔类MRI分子探针的合成*
郑 文, 程冬萍, 颜继忠
(浙江工业大学 药学院,浙江 杭州 310014)
阿尔茨海默病(AD)是一种退行性神经功能障碍性疾病,Aβ蛋白在脑内的沉积可能是引发AD的重要原因[1]。目前已经应用分子影像技术(如荧光、PET或SPECT, MRI技术)及其分子探针对其进行诊断研究,部分探针已应用到临床。MRI技术和其他成像技术相比具有相对简单、稳定、重复性好、避免暴露辐射危险等优点;且19F具有较长半衰期、自然界的丰度比较大、易通过血脑屏障[2,3]。Kumi Sato等[4]利用19F的特性合成了一个重要的MRI分子探针FSB。
由于带有供电子基团(Me2N-, MeO-,或HO-)的二苯乙烯类化合物具有在体内高选择性地与Aβ聚集物结合的能力,易通过血脑屏障;其次,这些探针试剂在正常鼠脑内注射后较快的消除,同时在Aβ斑区有高的保留。因此,二苯乙烯分子被作为药效团大量深化修饰[5~7]。最近,在AD症分子探针的生物检测中发现,由二苯乙烯衍生发展而来的二苯乙炔类化合物也是很好的药效团,如苯乙炔吡啶和二苯乙炔[8,9]。
本文综合考虑药效团与成像技术的支撑要素,设计并合成了一系列19F取代的带供电子基团的二苯乙炔类化合物——2-(2-氟-5-吡啶基)取代苯乙炔(1a~1c)和2-对氟苯基(取代)苯乙炔(1d~1f),以期用作MRI分子探针。以4-取代苯乙酮(2a~2c)为起始原料,经过经过Vilsmeier反应和Sonogashira偶联反应合成了1(Scheme 1),其结构经1H NMR,13C NMR和IR表征。其中1a~1c和1f未见文献报导。
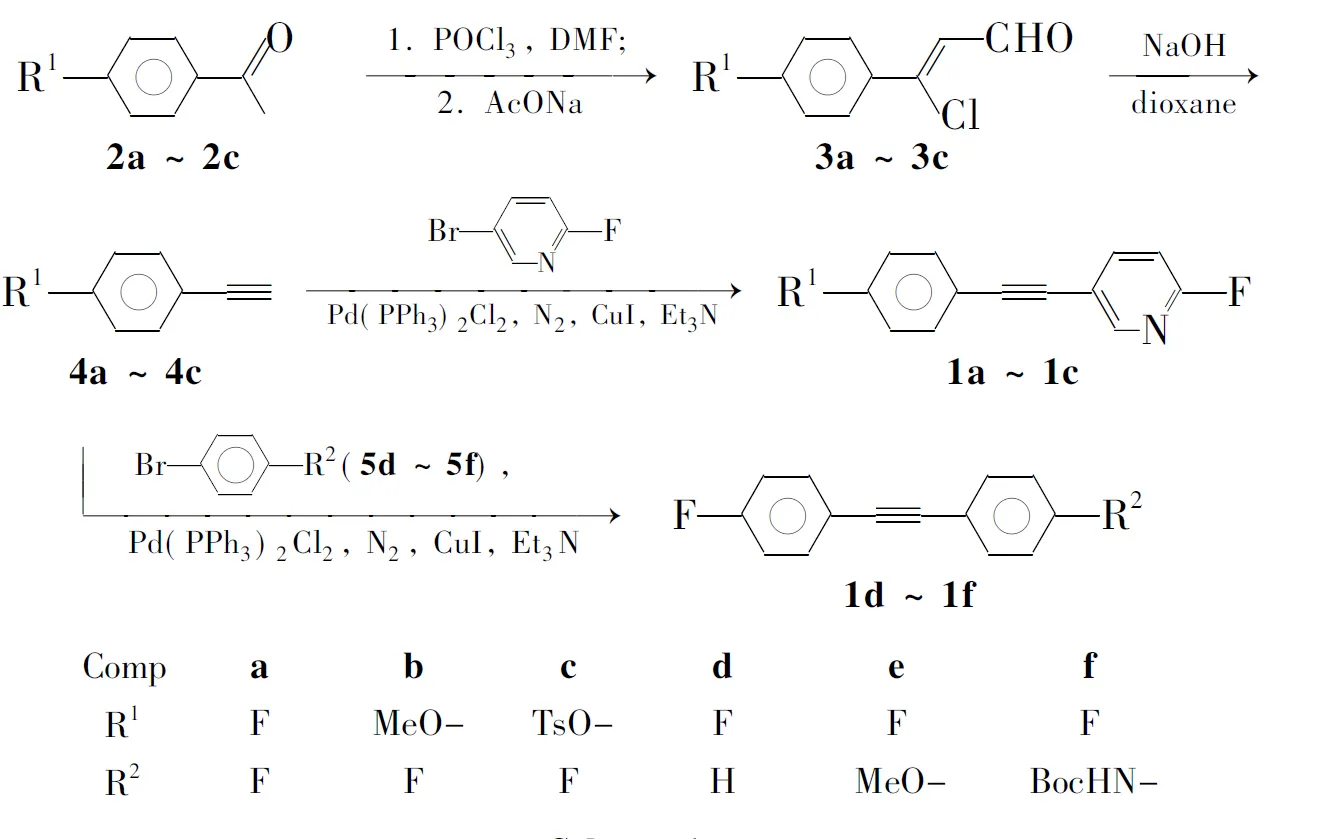
Scheme 1
1 实验部分
1.1 仪器与试剂
申光WRS-1B型数字熔点仪;Bruker AC-80型核磁共振仪(CDCl3为溶剂,TMS为内标);德国Bucker T27型红外光谱检测仪(KBr压片)。
4-氟苯乙酮(2a), 4-羟基苯乙酮,工业品,上海海曲化工;其余所用试剂均为分析纯或化学纯;Et3N使用前经NaOH除水后用氮气脱气15 min;高纯氮。
1.2 合成
(1)3的合成(Vilsmeier反应,以3a为例)
冰盐浴冷却,在三口烧瓶中加入DMF 60 mL,搅拌下于-12 ℃~-14 ℃依次缓慢滴加POCl317 mL(18 mmol)(控制滴加速度使反应温度保持在0 ℃以下,约30 min滴完)和2a100 mol的DMF(40 mL)溶液,滴毕,于室温反应1 h;缓慢升温至60 ℃,反应3 h。冷却至室温,搅拌下倒入含乙酸钠(50 g)的冰水(500 mL)中,静置过夜。过滤,滤饼晾干后用石油醚重结晶得淡黄色晶体(Z)-3-氯-3-(4-氟苯基)丙烯醛(3a) 14.65 g,收率79.4%。
用类似方法合成棕色晶体(Z)-3-氯-3-(4-甲氧基苯基)丙烯醛(3b) 9.65g,收率48.9%; (Z)-3-氯-3-(4-甲苯磺酰氧基苯基)丙烯醛(3c,不溶于石油醚,未重结晶)32.45 g,收率92.7%。
(2)4的合成(以4a为例)[10]
在三口烧瓶中加入NaOH 12.5 g(31.25 mmol)和水50 mL,加热至回流,搅拌下滴加3a30 mmol的1,4-二氧六环(70 mL)溶液,滴毕,反应约1 h(TLC跟踪)。冷却至室温,用石油醚(3×15 mL)萃取,合并萃取液,用水洗至中性,无水硫酸钠干燥,蒸干溶剂,残余物经柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=10 ∶1]分离得淡黄色晶体4-氟苯乙炔(4a) 2.83 g,收率78.7%。
用类似方法合成棕色液体4-甲氧基苯乙炔(4b) 5.34 g,收率99.8%;白色固体4-甲苯磺酰氧基苯乙炔(4c) 0.59 g,收率7.2%。
(3)1的合成(Sonogashira偶联反应[11],以1a为例)
在试管反应器中加入Pd(PPh3)2Cl228 mg(0.04 mmol), CuI 4 mg(0.02 mmol),塞好橡胶塞,抽真空充氮气(重复3次以上);注射加入5-溴-2-氟吡啶2 mmol的Et3N(2 mL~3 mL)溶液(经脱气处理),于60 ℃反应10 min;注射加入4a0.228 g(2.4 mmol)的Et3N(15 mL)溶液(经脱气处理),反应3 h~24 h(TLC跟踪)。过滤,滤液浓缩,残余物经柱层析(洗脱剂:A=40 ∶1)分离,TLC爬板(展开剂:正己烷)纯化得淡黄色粉末1a。
用类似方法合成黄色粉末1b和1c。
以4-取代溴苯(5d~5f)代替5-溴-2-氟吡啶与4a反应合成黄色粉末1d~1f。
2-(2-氟-5-吡啶基)对氟苯乙炔(1a): 0.34 g, 收率79.0%, m.p.100 ℃~102 ℃;1H NMRδ: 8.38(d,J=1.5 Hz, 1H, PyH), 7.88~7.91(m, 1H, PyH), 7.54~7.51(m, 2H, ArH), 7.09~7.06(m, 2H, ArH), 6.94~6.96(m, 1H, PyH);13C NMRδ: 163.7(J=32.4 Hz), 161.8(J=24.3 Hz), 150.6, 150.4, 143.6, 143.5, 133.7, 133.6, 118.5, 118.2, 116.0, 115.8, 109.6, 109.3, 91.4, 84.3; IRν: 3 066, 2 150, 1 602, 1 588, 1 482, 1 229, 870, 845, 775 cm-1。
2-(2-氟吡啶基-5)对甲氧基苯乙炔(1b): 0.33 g, 收率73.3%, m.p.70 ℃~72 ℃;1H NMRδ: 8.36(d,J=2.0 Hz, 1H, PyH), 7.89~7.85(m, 1H, PyH), 7.47(m, 2H, ArH), 6.94~6.88(m, 3H), 3.84(s, 3H, OCH3);13C NMRδ: 162.4(J=250.0 Hz), 160.1, 150.3, 143.43, 143.37, 134.0, 133.4, 118.7, 118.6, 114.4, 114.2, 109.5, 92.5, 83.4, 55.3; IRν: 2 924, 2 850, 2 217, 1 604, 1 626, 1 578, 1 484, 1 290, 1 251, 837, 760, 649 cm-1。
2-(2-氟吡啶基-5)对甲苯磺酰氧基苯乙炔(1c): 0.32 g, 收率43.9%, m.p.109 ℃~111 ℃;1H NMRδ: 8.37(d,J=2.0 Hz, 1H, PyH), 7.90~7.85(m, 1H, PyH), 7.72(d,J=8.0 Hz, 2H, ArH), 7.46~7.43(m, 2H, ArH), 7.33(d,J=8.0 Hz, 2H, ArH), 7.02~6.99(m, 2H, ArH), 6.95~6.93(m, 1H, PyH), 2.46(s, 3H, CH3);13C NMRδ: 150.6(J=15 Hz), 149.7, 145.7, 143.63, 143.56, 133.0, 132.2, 129.9, 128.6, 122.7, 121.4, 117.9, 109.7, 109.4, 91.0, 81.4, 21.8; IRν: 2 924, 2 846, 2 245, 1 603, 1 567, 1 466, 1 288, 1 250, 839, 824, 755 cm-1。
2-对氟苯基苯乙炔(1d): 0.33 g, 收率74.6%, m.p.112 ℃~114 ℃;1H NMRδ: 7.53~7.50(m, 4H, ArH), 7.37~7.34(m, 3H, ArH), 7.07~7.03(m, 2H, ArH);13C NMRδ: 162.5(J=247.5 Hz), 133.5, 133.4, 131.6, 128.38, 128.35, 123.1, 115.7, 115.6, 89.0, 88.3; IRν: 2 923, 2 200, 1 594, 1 508, 1 442, 1 217, 843, 793, 693 cm-1。
2-对氟苯基对甲氧基苯乙炔(1e): 0.28 g, 收率62.1%, m.p.93 ℃~95 ℃;1H NMRδ: 7.49~7.45(m, 4H, ArH), 7.04~7.01(m, 2H, ArH), 6.85(d,J=9.0 Hz, 2H, ArH), 3.83(s, 3H, OCH3);13C NMRδ: 162.3(J=247.5 Hz), 159.7, 133.3, 133.2, 133.0, 119.74, 119.71, 115.7, 115.5, 115.2, 114.1, 89.0, 86.9, 55.3; IRν: 2 924, 2 855, 1 604, 1 509, 1 467, 1 287, 1 250, 839, 824, 755 cm-1。
2-对氟苯基对叔丁氧酰胺基苯乙炔(1f): 0.35 g, 收率58.7%, m.p.160 ℃~162 ℃;1H NMRδ: 7.50~7.49(m, 2H, ArH), 7.48~7.47(m, 2H, ArH), 7.36(d,J=8.5 Hz, 2H, ArH), 7.04~7.01(m, 2H, ArH), 6.52(s, 1H, NH), 1.53(s, 9H, CH3);13C NMRδ: 206.9, 162.4(J=250.0 Hz), 152.4, 138.5, 133.4, 133.3, 132.4, 119.6, 118.1, 117.4, 115.7, 115.5, 88.9, 87.5, 80.9, 28.3; IRν: 3 357, 2 971, 2 880, 2 250, 1 706, 1 582, 1 523, 1 406, 1 234, 1 155, 835, 775, 651 cm-1。
2 结果与讨论
合成3时要注意:(1) DMF必须严格除水,POCl3遇到水会发生剧烈分解影响产率; (2) 乙酸钠溶液必须保持低温(0℃左右),温度过高将产生大量黄褐色鞣状物。
合成1的关键在于无氧操作。反应体系中如果有氧气,CuI易导致炔自身偶联副产联炔,不仅使产物分离困难,而且降低产率。因此,必须实行无氧操作,一般抽真空、充氮气应重复三次以上。液体底物与溶剂也要在使用前进行脱气处理;为减少联炔的生成和避免炔在换气过程中的损失,4安排在最后加料;也可选择DMF, THF,乙二醇二甲醚等作溶剂。
[1] D J Selkoe. Alzheimer’s disease:Genes,proteins,and therapy[J].Physiol Rev,2001,81:741-766.
[2] Weizsaecker M, Deen D F, Rosenblum M L,etal. The 9L rat brain tumor: description and application of an animal model[J].Neurol,1981,224:183-192.
[3] Makoto Higuchil, Nobuhisa Iwatal, Yukio Matsubal,etal. 19F and1H MRI detection of amyloidβplaques in vivo[J].Nature neuroscience,2005,8(4):527-533.
[4] Kumi Sato, Makoto Higuchi, Nobuhisa Iwata,etal. Fluoro-substituted and13C-labeled styrylbenzene derivatives for detecting brain amyloid plaques[J].Eur J Med Chem,2004,39(7):573-578.
[5] Hank F Kung, Chi Wan Lee, Zhi Ping Zhuang,etal. Novel stilbenes as probes for amyloid plaques[J].J Am Chem Soc,2001,123:12740-12741.
[6] Rajesh Chandra, Mei Ping Kunga, Hank F Kung. Design,synthesis,and structure-activity relationship of novel thiophene derivatives forβ-amyloid plaque imaging[J].Bioorganic & Medicinal Chemistry Letters,2006,16:1350-1352.
[7] Masahiro Onoa T, Mamoru Haratakea, Morio Nakayamaa,etal. Synthesis and biological evaluation of (E)-3-styrylpyridine derivatives as amyloid imaging agents for Alzheimer’s disease[J].Nuclear Medicine and Biology,2005,32:329-335.
[8] Rajesh Chandra, Shunichi Oya, Mei Ping Kung,etal. New diphenylacetylenes as probes for positron emission tomographic imaging of amyloid plaques[J].J Med Chem,2007,50:2415-2423.
[9] Wenchao Qu, Mei Ping Kung, Catherine Hou,etal. Radiodinated aza-diphenylacetylenes as potential SPECT Imaging agents for ofβ-plaque detection[J].Bioorganic & Medicinal Chemistry Letters,2007,17:3581-3584.
[10] 李建,杜渭松,安忠维. 4-取代苯乙炔的简便制备方法[J].现代化工,2008,2(2):41-44.
[11] Hadjar Benmansour, Richard D Chambers, Graham Sandford,et.al. Polyhalogenohetero-cyclic compounds.Part 53.1 Sonogashira reactions of 2,4,6-tribromo-3,5-difluoropyridine[J].Arkivoc,2007,:46-55.

