庆麻肾松滴鼻液的制备及质量控制
盛红彬,杨磊,华拯敏,原永芳(上海交通大学医学院附属第三人民医院,上海市201900)
庆麻肾松滴鼻液的制备及质量控制
盛红彬*,杨磊,华拯敏,原永芳#(上海交通大学医学院附属第三人民医院,上海市201900)
目的:制备庆麻肾松滴鼻液,并建立其质量控制方法。方法:以硫酸庆大霉素、盐酸麻黄碱等为主药,加入适量醋酸氢化可的松、盐酸去氧肾上腺素和助悬剂制备滴鼻液,采用高效液相色谱法测定其中盐酸麻黄碱的含量。结果:所制备的滴鼻液为白色混悬液,检查符合2005版《中国药典》中的相关规定,盐酸麻黄碱检测浓度的线性范围为0.390~1.560mg·mL-1(r=0.9999),平均回收率为100.2%(RSD=1.30%)。结论:本制剂制备工艺简便可行,含量测定结果稳定,质量可控。
庆麻肾松滴鼻液;盐酸麻黄碱;制备;HPLC法;含量测定
庆麻肾松滴鼻液是本院自制制剂,其主要成分是盐酸麻黄碱和硫酸庆大霉素,并加入了少量的醋酸氢化可的松和盐酸去氧肾上腺素。其成分之间有相互协同作用,具有较好的抗菌、抗过敏和收缩黏膜毛细血管等作用。笔者根据不同成分的不同的理化性质,加入辅料淀粉和琼脂将其制成混悬液[1],更有利于药物与鼻黏膜的充分接触,对各种鼻炎和副鼻窦炎所致的鼻塞、流涕有良好的疗效;并按《中国药典》的相关规定建立了其质量控制方法,采用高效液相色谱(HPLC)法测定了庆麻肾松滴鼻液中盐酸麻黄碱的含量。结果表明,本制剂制备工艺简便可行,含量测定结果稳定、质量可控。
1 仪器与试药
HPLC仪,包括LC-10AT泵、SPD-10A检测器(日本岛津公司);N2000色谱工作站(浙江大学)。
盐酸麻黄碱(赤峰艾克制药科技有限公司,批号:0040407,纯度:≥99.0%);盐酸麻黄碱对照品(上海市食品药品检验所,纯度:99.9%);硫酸庆大霉素(安阳路德制药厂,批号:040514,纯度:595u·mg-1);盐酸去氧肾上腺素(深圳沃兰德药业有限公司,批号:040817,纯度:99.6%);醋酸氢化可的松(天津市津津药业有限公司,批号:H0148,纯度:98.4%);庆麻肾松滴鼻液(本院制剂室提供,批号:060420、060529、060810、061009);纯化水为自制;甲醇为色谱纯;磷酸二氢钾为分析纯。
2 处方与制备
处方:硫酸庆大霉素5g、盐酸麻黄碱4g、醋酸氢化可的松适量、盐酸去氧肾上腺素适量、淀粉12g、琼脂0.3g,加适量水制成1000mL。制备方法:取淀粉与适量的水搅匀,缓缓加热并不断搅拌至半透明的胶浆。另取琼脂加适量水使其膨胀成胶块状,加热至溶解,滤过;待冷后两液合并,分次与醋酸氢化可的松研匀。另取盐酸麻黄碱、盐酸去氧肾上腺素、硫酸庆大霉素加适量水溶解,滤过,加入上液中,随加搅拌,加水至全量,搅匀即得。
3 质量控制
3.1 性状
本品为白色混悬液。
3.2 鉴别
3.2.1 硫酸盐。取本品,滤过,取滤液5mL,加氯化钡试液1滴,即生成白色沉淀,分离沉淀,在盐酸或硝酸中均不溶解。
3.2.2 氢化可的松。取本品5mL,离心,倾去上清液,沉淀加硫酸2mL使溶解,溶液即显黄色至棕色,并带绿色荧光。
3.2.3 盐酸去氧肾上腺素。取本品,离心,取上清液10mL,加三氯化铁试液1滴,溶液即显紫棕色。
3.2.4 盐酸麻黄碱。取本品,滤过,精密量取续滤液5mL,置于100mL容量瓶中,用无水乙醇稀释至刻度,摇匀,滤过,取续滤液照分光光度法测定,在568nm波长处有最大吸收。
3.3 检查
3.3.1 沉降体积比。不应低于0.9。用具塞量筒量取本品50mL,密塞,用力振摇1min,记下混悬液的开始高度H0。静置3h,记下混悬液的最终高度H,沉降体积比=H/H0。
3.3.2 微生物限度和装量。按《中国药典》规定检查[2],应符合规定。
3.4 含量测定
3.4.1 色谱条件。色谱柱:C18(150mm×4.6mm,5μm);流动相:甲醇-0.02mol·mL-1磷酸二氢钾溶液(40∶60);流速:0.7mL·min-1;柱温:室温20℃;紫外检测波长:254nm;进样量:20μL。
3.4.2 系统适用性试验。在上述色谱条件下,取“3.4.3”项下对照品溶液、“3.4.4”项下供试品溶液及“3.4.7”项下空白样品溶液进样分析,结果,样品中盐酸麻黄碱与其它成分的分离度R>3,理论板数n>2200,色谱见图1。

图1 高效液相色谱图A.对照品;B.空白样品;C.供试品;1.盐酸麻黄碱Fig 1 HPLC chromatogramsA.reference substance;B.blank sample;C.sample;1.ephedrine hydrochloride
3.4.3 对照品溶液的制备。精密称取干燥至恒重的盐酸麻黄碱40.0mg,置于25mL容量瓶中,用流动相溶解并稀释至刻度,摇匀即得1.60mg·mL-1的盐酸麻黄碱溶液。精密量取5mL,置于10mL容量瓶中,用流动相稀释至刻度摇匀得0.8mg·mL-1,作为盐酸麻黄碱的对照品溶液。
3.4.4 供试品溶液的制备。充分摇匀庆麻肾松滴鼻液,精密量取2mL,置于10mL容量瓶中,用流动相稀释至刻度摇匀。3000r·min-1离心5min,取上清液用0.45μL微孔滤膜过滤,滤液备用。
3.4.5 线性范围考察。精密称取干燥至恒重的盐酸麻黄碱39.0mg,按“3.4.3”项下方法制成1.560mg·mL-1的盐酸麻黄碱溶液,即原液。分别取原液2.5、3.75、5、7.5mL至10mL容量瓶中,用流动相稀释至刻度,摇匀,浓度分别为0.390、0.585、0.780、1.170、1.560mg·mL-1。分别取上述不同浓度溶液20μL进样,记录峰面积(A),并与浓度(C)进行线性回归,得方程A=6.64×105C+5.07×103(r=0.9999)。表明盐酸麻黄碱检测浓度线性范围为0.390~1.560mg·mL-1。
3.4.6 精密度试验。精密吸取“3.4.5”项中0.585mg·mL-1的溶液20μL进样,连续6次,记录峰面积。结果,其RSD=1.31%,表明本测定法精密度较好。
3.4.7 干扰性试验。按照庆麻肾松滴鼻液的处方,制备不含盐酸麻黄碱的空白样品滴鼻液,按“3.4.4”项下处理,进样20μL。结果,所得图谱中未见盐酸麻黄碱峰,并且基线良好,表明其它成分在此条件下不干扰盐酸麻黄碱含量的测定。
3.4.8 加样回收率试验。取3支试管,分别精密加入样品溶液1mL,另取浓度分别为1.56、1.17、0.585mg·mL-1的对照品各1mL加入3支试管中。在相同的色谱条件下分别进样20μL,记录峰面积并计算回收率,结果见表1。
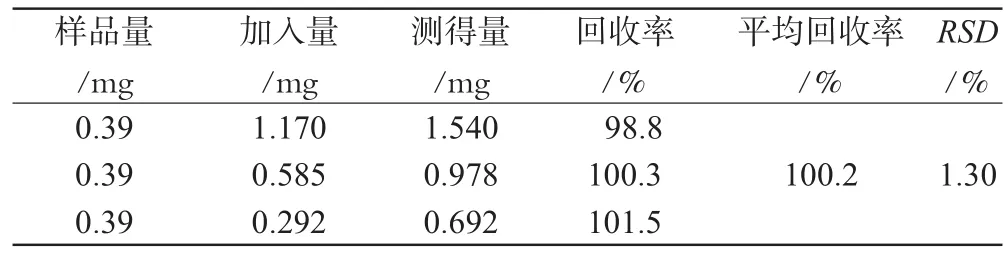
表1 回收率测定结果Tab 1 Result of recovery rate test
3.4.9 稳定性试验。取同一批号的样品(061009)制成供试品溶液,分别在0、2、4、6、8h进样20μL,依法测定,结果,含量的RSD=0.624%,表明供试品溶液在8h内稳定性良好。
3.4.10 样品的含量测定。取不同批次的庆麻肾松滴鼻液,按“3.4.4”项下处理,分别进样20μL,记录峰面积。另取对照品溶液(0.780mg·mL-1)依法测定,计算盐酸麻黄碱的含量,结果见表2。

表2 样品含量测定结果(n=4)Tab 2Result of sample test(n=4)
4 讨论
庆麻肾松滴鼻液中有效成分共有4种,使其制备及建立全面的质量控制方法具有一定难度,故本文暂时只建立了其中1种有效成分的含量测定方法,并将在以后逐步完善。硫酸庆大霉素的含量测定一般采用生物检定法,医院制剂室对其质量检测存在一定的局限性,因此本文选择盐酸麻黄碱作为含量测定项。盐酸麻黄碱通常采用茚三酮显色后比色法[2]或离子对比色法[3]测定,在实际工作中,含量测定时成分之间相互干扰,稳定性较差。本文采用HPLC法,在文献[4]报道的基础上改变了流动相的极性,结果分离度和稳定性较好,回收率和稳定性也符合含量测定的要求,可以作为庆麻肾松滴鼻液质量标准中盐酸麻黄碱含量测定方法。
笔者在处方中加入高分子材料增加黏稠度,并制成混悬液,有利于其在鼻黏膜的黏附和延长作用时间[1]。故在建立质量标准时,也加入了沉降体积比这一指标的测定。
[1] 邓 平,时 涛,邵 峰,等.氯麻滴鼻凝胶的制备及质量控制[J].中国药房,2008,19(19):1488.
[2] 国家药典委员会编.中华人民共和国药典(二部)[S].2005年版.北京:化学工业出版社,2005:569、附录ⅪF、ⅩH.
[3] 陈双璐,郭东华,柏亚林.离子对比色法测定复方制剂中盐酸麻黄碱的含量[J].中国药师,2005,8(9):795.
[4] 程辉跃.HPLC法同时测定百喘朋中盐酸麻黄碱和盐酸苯海拉明的含量[J].中国药房,2001,12(10):622.
Preparation and Quality Control of Qingma Shensong Nasal Drops
SHENG Hong-bin,YANG Lei,HUA Zheng-min,YUAN Yong-fang(The Affiliated Third People’s Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai 201900,China)
OBJECTIVE:To prepare Qingma shensong nasal drops,and to establish quality control method of it.METHODS:Gentamycin sulfate and ephedrine hydrochloride were used as main components,hydrocortisone acetate,phenylephrine hydrochloride and suspending agent were added into main components to prepare nasal drops.The content of ephedrine hydrochloride was determined by HPLC.RESULTS:The prepared nasal drops was white suspension,and the results of its tests were in conformity with the standards of Chinese Pharmacopeia(2005edition).The linear range of ephedrine hydrochloride was 0.390~1.560mg·mL-1(r=0.9999)with an average recovery of 100.2%(RSD=1.30%).CONCLUSION:The preparation technology for the nasal drops is simple and feasible,and the quality of the preparation is stable and controllable.
Qingma shensong nasal drops;Ephedrine hydrochloride;Preparation;HPLC;Content determination
R987;R977.1
A
1001-0408(2010)33-3124-02
*主管药师,硕士。研究方向:临床药学。电话:021-56603113。E-mail:shenghongbin2005@126.com
#通讯作者:教授,硕士研究生导师。研究方向:药物分析、药事管理。电话:021-56786907。E-mail:mmxyyf@sohu.com
2010-01-11
2010-03-03)

