瘦素对大鼠肝星状细胞硬脂酰辅酶A去饱和酶-1基因表达的影响△
哈尔滨医科大学附属第四医院内分泌科(哈尔滨 150001)
闫 爽 刘思颖 封 泉 崔新河*
硬脂酰 CoA去饱和酶-1(Stearoyl-CoA desaturase-1,SCD-1)是单不饱和脂肪酸生物合成的限速酶,在脂肪酸代谢中起中心调节作用,也是瘦素(Leptin)作用的目的基因之一。瘦素与糖尿病、肥胖、脂肪肝有着密切关系,是近年来代谢性疾病的热点领域之一。2型糖尿病患者,常常伴有胰岛素抵抗、高瘦素血症,同时约50%的2型糖尿病患者存在脂肪肝。本文采用 RT-PCR方法观察瘦素对大鼠肝星状细胞SCD-1基因表达的影响。
材料与方法
1 细胞培养和总RNA提取 在35 mm培养皿中常规培养 HSC细胞(由哈尔滨医科大学提供),细胞生长至对数期时,分别用瘦素(浓度为100 ng/ml,为实验组)和对照液体(对照组)培养 HSCs细胞,36 h后收获细胞提取总 RNA。应用 Trizol一步法提取细胞的总RNA,经琼脂糖凝胶电泳及分光光度计进行定性定量分析。
2 逆转录反应 将定量的总 RNA用 SYBR Ex Script RT-PCR Kit反转录总 RNA。反转录条件:42℃ 13min,95℃ 2min;反转录体系:5×Exscript TM缓冲液:2μl,dN TP混合物(各10mM):0.5μl,Random 6mers 反转录引物(100μM):0.5μl,Exscript TM Rtase反转录酶(200U/μl):0.25μl,RNase抑 制剂(40U/μl):0.25μl,总 RNA:500ng,无 RNase纯水:总量至10μl,总体积:10μl。
3 引物的合成 根据 RT-PCR引物合成的要求,根据SCD-1和GAPDH基因序列应用N TI软件设计引物如下(由上海生物工程有限公司合成):SCD-1上游引物 P1:5′-TGGGTTGGCTGCTTGTG-3′(17bp),下游引物 P2:5′-GCGTGGGCAGGATGAA G-3′(17bp),GAPDH上游引物 P1:5′-ATGATTCT ACCCACGGCAAG-3′,下游引物 P2:5′-CTGGAA GATGGTGATGGGTT-3′。
4 RT-PCR反应 使用 Light Cycler PCR仪进行RT-PCR反应。将对照组模板cDNA进行5倍的倍比稀释,设未稀释的模板cDNA浓度为1,则稀释后的浓度梯度为1、0.2、0.04、0.008、0.0016,以此五个浓度的cDNA为模板,对 SCD-1基因进行 PCR扩增,以 CT值做标准曲线。同时以未稀释的实验组和对照组 cDNA为模板,对 SCD-1基因进行 PCR扩增,以 ct值落在标准曲线中的位置来计算 SCD-1基因在瘦素刺激前后的相对含量。反应体系为:SYBR Green荧光染料:10μl,dd H2O:8.2μl,引物 P1:0.4μl,引物 P2:0.4μl,模板:1.0μl,终体积:20μl。反应条件为:95℃,10s;95℃,5s→60℃,20s,45个循环。
结 果
1 总 RNA的定性、定量分析:使用高质量的总RNA是保证cDNA高质量的前提。核酸-蛋白分析仪A260/A280检测结果:经过瘦素处理过的和未用瘦素处理的肝星状细胞提取的总 RNA分别为0.653μg/μl和0.712μg/μl,A260/A280分别为1.924和1.963。1.0%琼脂糖凝胶电泳如图1。
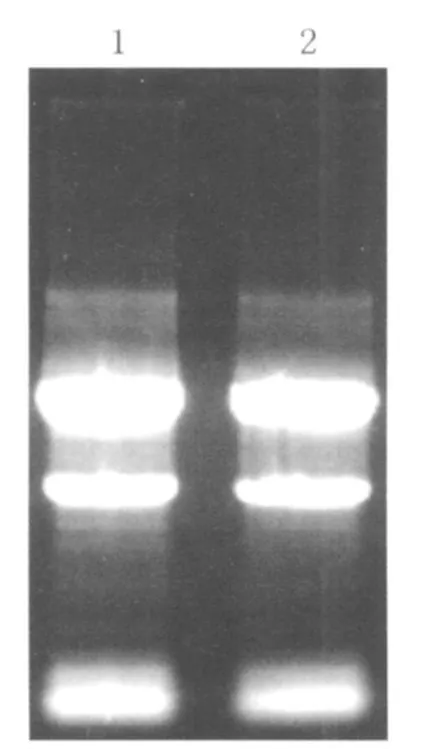
图1 总 RNA电泳图
2 RT-PCR的标准曲线图及融解曲线图,见图2。
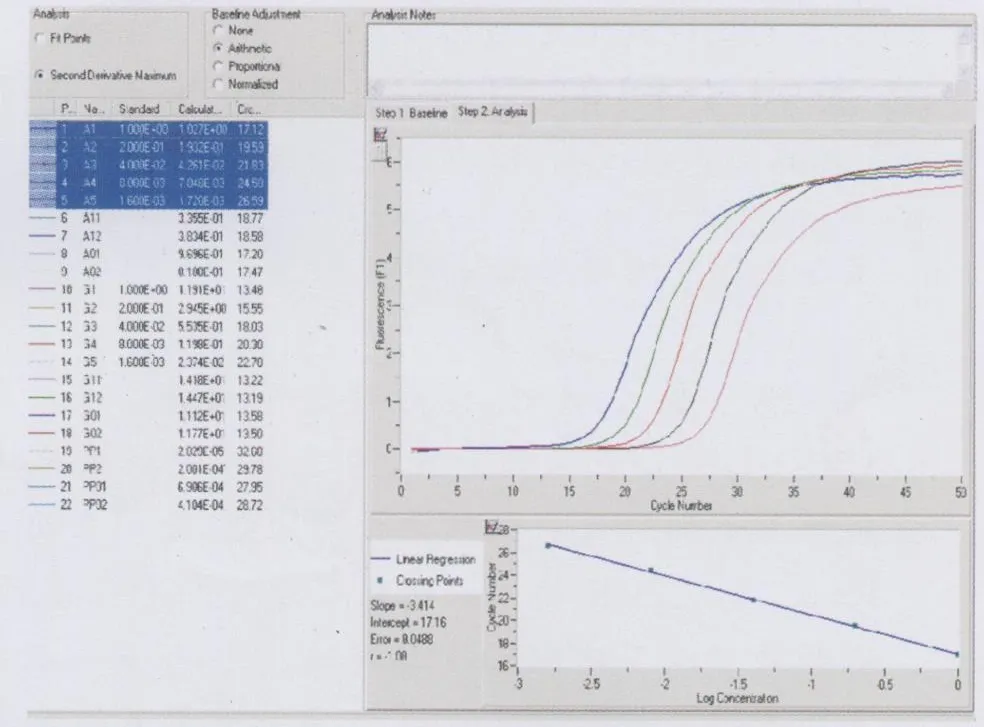
图2 SCD-1基因标准曲线图
图3 SCD-1基因溶解曲线图
3 RT-PCR的实验结果:瘦素对 SCD-1的调节。RT-PCR实验的标准曲线斜率r=1,根据 RT-PCR的调节倍数计算公式:调节倍数=(实验组测试基因拷贝数 /实验组内参基因拷贝数)÷(对照组测试基因拷贝数 /对照组内参基因拷贝数),计算得出瘦素刺激后SCD-1基因的扩增是未用瘦素刺激的0.315倍。
讨 论
随着肥胖和2型糖尿病发病率的增加,2型糖尿病并发脂肪肝也明显增加,肝内的脂肪沉积会影响肝脏功能的正常发挥,加重糖代谢紊乱,形成恶性循环,严重影响糖尿病人的预后。发现 2型糖尿病并发脂肪肝的可能病因,有利于寻找防治 2型糖尿病并发脂肪肝的途径。非酒精性脂肪肝主要是由于中性脂肪在肝脏中沉积所引起,糖尿病人脂代谢紊乱是其非酒精性脂肪肝形成的原因之一。而糖尿病人的脂代谢紊乱又和瘦素有着复杂的关系。
瘦素是一种脂肪组织来源的亲水多肽激素,分子量为16000,含146个氨基酸。Zhang Y等[1](1994年)首次克隆出瘦素基因或称肥胖基因(Obese gene,Ob基因)。瘦素的功能是多方面的,主要表现在对脂肪及体重的调控[2~5]。瘦素通过肝脏、胰腺、骨骼肌、脂肪组织等发挥其调节能量代谢、保持机体能量平衡的作用。对瘦素与脂肪代谢之间关系的研究表明,生理状态下,脂肪组织增生则分泌更多瘦素而加速脂肪分解,使机体的脂肪量和体重维持相对稳定,而代谢综合征状态下,患者存在瘦素抵抗,使得瘦素不能正常发挥对脂肪代谢的调控作用,同时摄食增加,脂肪氧化分解减弱,脂肪蓄积,从而导致高脂血症,进一步导致脂肪肝,同时亦影响了胰岛素的生物学效应[6,7]。瘦素与胰岛素之间关系的研究最为广泛。胰岛素被认为是血浆瘦素浓度的决定因素,参与调节热卡摄入对瘦素的效应。更为重要的是瘦素与胰岛素之间存在有负向调节袢:胰岛素刺激瘦素分泌,同时瘦素通过与胰岛细胞上的受体结合来抑制胰岛素的分泌。这种反馈调节机制一旦破坏,瘦素抑制胰岛素分泌的能力即下降,导致高胰岛素血症,或胰岛素抵抗发生,进一步发展为2型糖尿病[8,9],同时更加促成了糖尿病人高瘦素血症的形成。
硬脂酰 CoA去饱和酶(SCD)是单不饱和脂肪酸(Monounsaturated fattyacid,MUFA)生物合成的限速酶,在脂肪酸代谢中起中心调节作用。MUFA从其前体饱和脂肪酸经NADH依赖的黄素蛋白细胞色素 b5还原酶、细胞色素 b5和SCD三种物质组成的酶系催化,无氧氧化而来。SCD催化硬脂酰和软脂酰 Co A形成油酰和棕榈油酰 CoA。生成的油酰和棕榈油酰 CoA是细胞内合成三酰甘油、胆固醇酯和膜磷脂 M UFA的主要来源。油酸是肝合成三酰甘油和胆固醇酯的必需脂肪酸,三酰甘油和胆固醇酯是肝内装配和分泌极低密度脂蛋白(VLDL)的重要成份。因而,SCD是调节VLDL水平的控制点。SCD主要有三种同功酶:SCD1、SCD2和SCD3。SCD1主要存在于肝、肾、肺、心脏和脾。2002年,Cohen等[10]研究发现,SCD-1基因是瘦素信号的靶基因之一,瘦素可显著抑制 SCD-1基因的表达。本组资料也显示:在体外实验,一定浓度的瘦素刺激后,SCD-1m RNA水平明显低于对照组,说明瘦素可以使 SCD-1基因表达下调,与国外动物实验研究结果一致,国内尚未见报道。SCD-1mRNA水平下降,可使VLDL分泌降低,肝内多余脂肪不能排出,在肝内沉积形成脂肪肝。Cohen同时发现,SCD-1缺乏的ob/ob鼠三酰甘油合成和VLDL分泌减少,由此认为:SCD-1作为脂代谢过程中的关键酶,参与了脂肪肝的发病过程。由于SCD-1是V LDL的调控点,参与脂肪肝的发生,瘦素又减少SCD-1的分泌,糖尿病人由于胰岛素抵抗、瘦素抵抗,其脂肪肝的形成很可能与其内源性的高瘦素血症有关,使得肝细胞的SCD-1表达下调,VLDL分泌降低,肝内脂肪不能排出,形成脂肪肝。如果改善瘦素抵抗,纠正糖尿病人的高瘦素血症,预防和减轻 SCD-1表达下调,可能有助于脂肪肝的改善,瘦素作用的详细机制以及与各种相关代谢途径关系的研究,瘦素抵抗发生的真正原因、瘦素与胰岛素抵抗的关系、瘦素与2型糖尿病合并脂肪肝的关系如何,均有待深入研究,这对与瘦素相关的代谢性疾病的发生将起到更好的解释和防治作用。而 SCD-1与瘦素的进一步深入研究亦为非酒精性脂肪肝,其中包括糖尿病脂肪肝临床研究和药物开发提供了一个新的方向和可能的治疗靶点。
[1] Zhang Y,P roenca P,M affeiM,etal.Positional cloning of the mouse obese gene and its human homologue[J].Nature,1994,372(6505):425-432.
[2] Houseknecht KL,Spurlock ME.Leptin regulation of lipid homeostasis:dietary and metabolic imp lications[J].Nutrition research reviews,2003,16(1):83-96.
[3] Caro J F,Sinha M K,Kolaczynski JW,etal.Leptin:the tale of an obesity gene[J].Diabetes,1996,45(11):1455-1462.
[4] Shek EW,BrandsM W,Hall JE.Chronic leptininfusion increases arterial pressure[J].Hypertension,1998,31(1 Pt 2):409-414.
[5] Lord GM,Matarese G,Howard JK,etal.Leptin modulates the T2 cell immune response and reverses starvation induced immunosuppression[J]. Nature,1998,349(6696):897-901.
[6] Sahu A,Metlakunta AS.Hypothalamic phosphatidylinositol 3-ki-nase-phosphodiestrase 3B-cyclic AMP pathway of leptin singnaling is impaired following chronic central leptin infusion.J Neuroendocrinol,2005,17:720-726.
[7] Covey SD,Wideman RD,Mc Donald C,etal.The pancreatic beta cell is a key site for mediating the effects of leptin on glucose homeostasis.Cell Metab,2006,4:291-302.
[8] Munzberg H,Flier JS,Bjorbaek C.Region-specific leptin resistance within the hypothalamus of diet-induced obese mice.Endocrinology,2004,145:4880-4889.
[9] Martin TL,Alquier T,Asakura K,etal.Diet-induced obesity alters AM P-kinase activity in hypothalamus and skeletal muscle.JBiol Chem,2006,281:18933-18941.
[10] Cohen P,Miyazaki M,Socci ND,etal.Role for stearoyl-Co A desturase1 in leptin-mediated weight-loss.Science,2002,297∶240-243.

