猪瘟病毒E2蛋白部分抗原区基因在原核系统的分泌表达与鉴定
周 顺 ,李 俊 ,温建新
(1.青岛农业大学,山东青岛 266109;2.山东省农业科学院畜牧兽医研究所,山东济南 250100)
猪瘟,也叫古典猪瘟,是由猪瘟病毒(HCV或CSFV)引起的猪的一种急性、热性、接触性传染病。自从1883年在美国俄亥俄州首次发生以来,猪瘟在世界许多国家和地区时有暴发和流行,给养猪业带来巨大的经济损失,被世界动物卫生组织(OIE)列为一类动物传染病[1]。1885年Salmom和Smith对猪瘟病原体和猪沙门氏菌等猪的一些病原体进行了鉴别诊断,1903年De Shweinitz和Dorset的研究表明,猪瘟是由病毒引起的。迄今为止,该病在南美和亚洲地区仍有发生和流行,欧洲少部分地区也时有发生。猪瘟仍然是严重危害全球养猪业的重要传染病,是我国主要的畜禽疫病之一。目前该病流行于除北美和大洋洲外的世界上各大洲和地区[2],因此各国都在致力于猪瘟的研究、控制与扑灭工作。我国从70年代开始,由于成功研制出C株兔化弱毒疫苗并大力推广应用,使得猪瘟在我国得到有效控制[3]。但是由于近20多年来,猪瘟的流行与发病发生了一些变化,温和型(非典型)猪瘟的发生日益普遍,加上一些疾病的继发感染或混合感染[4-6],加大了猪瘟诊断的难度,即使是采用实验室的诊断手段,一般检测抗体的方法[7-9]也不易对猪瘟进行确诊。由于多年来疫苗研究方面没有取得突破性的进展,使得猪瘟的防制工作不尽人意,甚至猪瘟在有些地区还有抬头的趋势,因此猪瘟仍然是威胁我国养猪业特别是规模化养猪的重要传染病。
猪瘟病毒是黄病毒科瘟病毒属成员,其囊膜糖蛋白E2是其主要保护性抗原蛋白,能够单独诱导有效的免疫保护反应[10]。该蛋白从多聚蛋白的690位氨基酸到1 061位,共包括371个氨基酸残基,包含6个半胱氨酸,其中693和737形成一对二硫键,以此为基础形成了一个独立的抗原表位集中的B区和C区;而792和857、818和828形成了另一个独立的抗原表位集中的A区和D区[11-12],B/C区基因序列在各CSFV毒株中极其保守而在黄病毒属其它成员,如BVDV和BDV中变异很大[13-14],所以表达产物作亚单位疫苗时能产生针对各猪瘟病毒毒株的保护性抗体,可以用于血清学方法监测抗体水平,故用其表达产物作诊断抗原时比选择A/D区的表达产物有更大的特异性优势。养猪发达国家已有利用重组表达的E2蛋白作亚单位疫苗和建立了对应其猪瘟防疫政策的检测猪群猪瘟抗体阴阳性的ELISA方法[15]。因此本研究选取了E2基因中编码1到76位氨基酸的基因序列进行扩增表达,以期用重组表达E2蛋白或其主要的抗原域,作为检测抗原和亚单位疫苗。
1 材料与方法
1.1 材料
病毒与血清、猪瘟兔化弱毒、高免血清及阴性血清、表达载体PET30(a)、受体菌BL21由山东省畜禽疫病防治与繁育重点实验室保存;PMD18-T载体、Taq DNA聚合酶、T4 DNA连接酶及各种修饰酶购自Takara公司;IPTG、卡那霉素、PEG6000、MW8000纤维素透析袋购于上海生工生物工程技术有限公司;其他试剂均为进口或国产分析纯品。
1.2 引物的设计及合成
扩增含编码B/C抗原区的基因片段所用的引物:上游:5'-tcgaattcatg cgtctagcctgca-3'、下游:5'-tggtgagtgag taaagcccccttat-3',送上海生工生物工程有限公司合成。上、下游引物分别包含设计为Eco RI、Pst I酶切位点,扩增E2基因的第1位氨基酸至第76位氨基酸。
1.3 试验方法
1.3.1 病毒RNA的提取和B/C基因的RT-PCR扩增
RNA的提取按Trizol试剂盒说明书进行。根据GeneBank中猪瘟病毒设计一对针对B/C基因的特异性引物(见上),反转录按反转录试剂盒说明书进行。取5μL cDNA产物用作PCR模板,将PCR产物经8 g/L琼脂糖凝胶电泳后观察结果。
1.3.2 表达载体的构建
将PCR产物胶回收后,与PMD18-T载体连接,转化后得到阳性重组质粒,命名为TB/C。利用上游引物的酶切位点和载体上的酶切位点,双酶切后回收B/C基因和同样处理的原核表达载体进行T4 DNA连接酶连接,转化BL21菌种制备的感受态细胞。小量提取质粒。双酶切筛选阳性重组质粒,命名为PETB/C。将PETB/C送上海博亚生物公司测序。
1.3.3 PCR阳性菌株的诱导表达
将含有重组质粒PETB/C的BL21菌种在含卡那霉素的LB平板上划线,37℃培养过夜,挑取单个菌落,于含卡那霉素的LB中37℃摇床培养至OD600为0.6~0.7时加入IPTG至终浓度1 mM,继续振摇培养3~6 h,收获细菌。离心后将菌体用0.5 M NaCl、20 mM Tris·Cl(pH=7.6)洗两次,然后用PBS悬浮细胞,经超声波裂解后,进行SDS-PAGE蛋白电泳,考马斯亮兰染色,观察结果。
1.3.4 表达产物SDS-PAGE和免疫学鉴定
直接取上清进行SDS-PAGE(5%的浓缩胶,15%分离胶),将表达上清中蛋白转印到硝酸纤维素膜上,用猪瘟兔化弱毒高免血清进行Western-blot分析。
1.3.5 间接ELISA检测表达产物的抗原性
将浓缩的重组表达上清及对照(空菌上清)用包被液在96孔板上倍比稀释,4℃包被过夜,分别用猪瘟兔化弱毒高免血清和阴性血清进行检测,稀释倍数为1:200,二抗按说明稀释(1:5 000),底物为 TMB,用 0.15%HF终止反应,最后用标仪读取OD630值。选用可与阳性血清反应出现明显反应且与阴性血清无反应的抗原稀释度作为抗原用量用于检测待检血清中的猪瘟抗体。同时对其他8种疫病阳性血清(猪瘟阴性血清)做间接ELISA试验。
1.3.6 表达蛋白的初步应用
随机从山东、哈尔滨等地的送检血清中选择了58份血清,将表达的B/C蛋白按上述确定的反应量与待检的血清进行间接ELISA试验,同时用Dot-ELISA试验结果作为参照,分析其相符性。
2 结果
2.1 重组质粒的构建与鉴定
2.1.1 编码E2蛋白B/C区特定基因的扩增
PCR产物琼脂糖电泳后在DL2000 DNA分子量标准的250 bp附近出现了一条明显的条带,符合预期设计的261 bp大小的片段(图1)。
2.1.2 阳性质粒双酶切鉴定结果
质粒经用Eco RI和Pst I双酶切处理后,8 g/L琼脂糖上电泳,可见在DL2000 DNA分子标准250 bp、500 bp之间出现符合预期设计大小的目的片段和大于2 000 bp的载体带(图2)。
2.1.3 阳性质粒双酶切鉴定结果
质粒经用Eco RI和SacⅡ双酶切双酶切处理后,8 g/L琼脂糖上电泳,可见在DL2000DNA分子标准250 bp、500 bp之间出现符合预期设计大小的目的片段和大于2 000 bp的载体带(图3)。
2.2 表达产物SDS-PAGE和免疫学鉴定结果
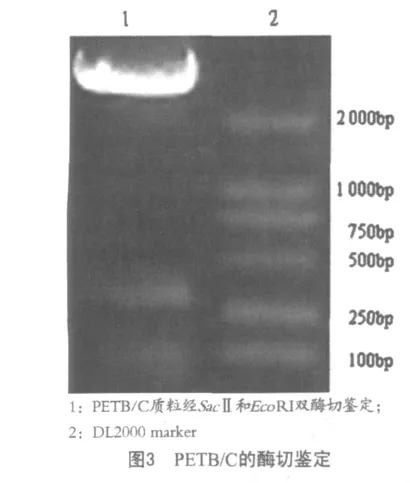
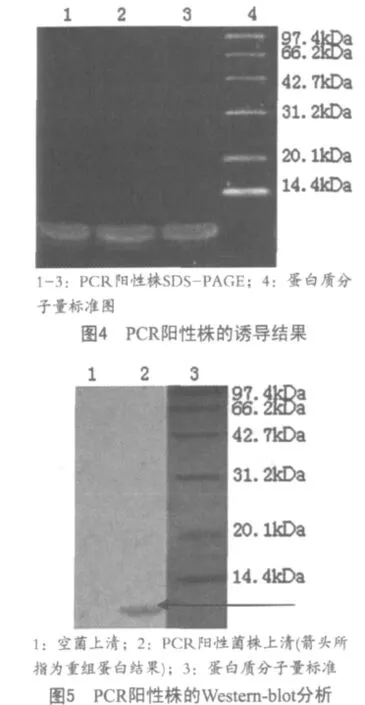
诱导72 h样品经SDS-PAGE电泳,考马斯亮蓝染色,可见一条大小为9 kDa的条带,与预期的9.0 kDa相符合(图4)。在Werstern-blot中结果有明显的杂交带而对照组杂交呈阴性,说明表达产物能与猪瘟抗血清特异性结合(图5)。
2.3 间接ELISA检测表达产物的抗原性
用包被液稀释重组表达上清与猪瘟兔化弱毒高免血清呈阳性反应,OD630从1:24开始下降,但直到1:27仍然与猪瘟兔化弱毒高免血清阳性反应,而空白菌体的诱导上清呈阴性反应(OD630≤0.2)。说明重组表达产物具有良好的抗原性,可以区分猪瘟阴阳性血清和用于抗体水平的检测。
2.4 与Dot-ELISA对比试验
随机从山东、哈尔滨等地的送检血清中选择了40份血清,将表达的蛋白按适当的反应量与待检的血清进行上述试验,同时用Dot-ELISA试验结果作为参照,结果其相符性达95%左右。
3 讨论
近年来,国外对猪瘟病毒的研究内容逐渐加深。猪瘟病毒是猪急性传染病以及免疫抑制等方面的一个主要诱因。如何对猪瘟进行及时准确检测也成为科研工作者和养殖户所关心的重要问题。利用传统的细胞培养的病毒分离方法诊断猪瘟不仅费时费力,而且也不容易操作。而常用的HA试验不仅其敏感度低,而且因猪血清中含有非特异性红细胞凝集物质和非特异性血凝抑制物质,故在诊断中还需要先进行预处理,使操作过程复杂化[16-17]。此外,利用全病毒作抗原建立的诊断方法必须先将病毒浓缩提纯,然后再用去污剂裂解后并适当浓缩才能用作抗原,这就使得全病毒抗原制备过程复杂,不宜于推广。而且利用全病毒抗原作为诊断用抗原,在对以HA为基础的亚单位疫苗或病毒活载体疫苗免疫猪血清的诊断中,不能起到鉴别诊断疫苗免疫猪和野毒感染猪血清的作用。
猪瘟B/C蛋白是其保守性蛋白,是猪瘟病毒诊断最具代表性的蛋白。利用原核表达系统表达外源蛋白已在分子免疫学、亚单位疫苗、蛋白与蛋白、蛋白与DNA的相互作用中得到了广泛的应用。而选用合适的表达系统生产诊断用抗原也是一种新型的方法。利用原核表达系统生产的抗原其反应原性一般不会丧失,可以直接用于病毒感染的检测,而且所表达的蛋白一般都融合了一定的标签以方便蛋白的纯化。我们选用的PET30就是带有组氨酸标签的一种原核表达系统,所以所表达的重组B/C也非常方便纯化。如今猪瘟的检测手段中HA试验其敏感度都较低,而较敏感的ELISA等检测方法尚未建立,如果能将重组的蛋白进行纯化,然后作为抗原,组装成重组B/C的间接ELISA诊断试剂盒,其敏感性将会有很大的提高。而且因为重组蛋白纯化后其纯度可已达到很高,所以特异性也非常有保证。对我国猪瘟的诊断必将带来极大的方便。在猪瘟病毒NP蛋白的表达过程中,所表达的蛋白大小约为9 KD,在对送检血清样品的检测中也充分证实了重组蛋白具有非常好的生物学活性。在实验室工作的基础上,通过对送检样品的检测,利用重组蛋白建立的间接ELISA诊断方法特异性高,敏感性也可以满足需要,能够对我国猪瘟的流行病学调查或感染猪场的猪瘟病毒诊断奠定良好的技术基础,希望能尽快得到推广。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科技出版社,1997:652-664.
[2]涂长春.猪瘟国际流行态势、我国现状及防制对策 [J].中国农业科学,2003,36(8):955-960.
[3]王镇,丁明孝.猪瘟病毒致病机制及防制的研究进展[J].畜牧兽医学报,1998,29(5):449-454.
[4]魏玉明.仔猪水肿病和猪瘟混合感染的诊断和防制[J].中国预防兽医学报,2000,22(5):389-390.
[5]魏玉明.仔猪伪狂犬病与猪瘟混合感染的诊断和防制[J].中国兽医科技,2001,31(1):35.
[6]黎江,李军,余艳娟,等.猪繁殖与呼吸综合征病毒、猪瘟病毒和副猪嗜血杆菌的混合感染[J].中国畜牧兽医,2008,35(11):123-124.
[7]毕保良,李进涛,旭川,等.分子生物学技术在猪瘟诊断中的应用 [J].动物医学进展,2009,30(2):106-108.
[8]傅义娟,王生祥,张立成.猪瘟的诊断与防治[J].中国兽医杂志,2006,42(9):55.
[9]王华,王君玮,徐天刚,等,非洲猪瘟流行病学和诊断方法的研究进展.[J]. 中 国 兽 医 科 学 ,2008,38(6):544-548.
[10]Konig M,Lengsfeld T,Pauly T.Classical swine fever virus(CSFV)independent induction of protective immunity by two structural glycoproteins[J].Virol,1995,69(10):6479-6486.
[11]Van rijn P A,Van gennip H G P,De meijer E J,etal.Epitope mapping of envelope glycoprotein E1 of hog cholera virus strain Brescia[J].Gen Virol,1993,74:2053-2060.
[12]Van rijn P A,Miedema G K W,Wensvoort G,et al.Antigenic structure of envelope glycoprotein E1 of hog cholera virus [J].Virol,1994,75:3934-3942.
[13]Dong X N,Wei K,Zu Q,et al.Candidate peptide vaccine induced protection against classical swine fever virus[J].Vaccine,2002,21:167-173.
[14]Vanrijn P A,Van gennip H G P,Leendertse,et al.Subdivision of the pestivirus genus based on envelope glycoprotein E2 [J].Virology,1997,23(2):337-348.
[15] Colijn E,Bloemraad M,Wensvoort G.An improved ELISA for the detection of serum antibodies directed against classical swine fever virus[J].Vet Microbiol,1997,59:15-25.
[16]Astrid V,Guillaume S.Comparison of three non-nested RT-PCR for the detection of influenza A viruses[J].Clin Virol,2000.17(3):167-175.
[17]Swenson S L,Vincent L L.A compsrison of diagnostic assay for the detection of type A swine influenza virus from nasal swabs and lungs[J].VetDiagn Invest,2001,13(1):36-42.


