两种免疫酶试剂盒检测猪抗E型肝炎病毒IgG的比较
张焕容,杨发龙
(西南民族大学生命科学与技术学院,四川成都 610041)
E型肝炎病毒(HepatitisEvirus,HEV)是世界范围内最常见的经粪-口途径感染的病毒之一。该病毒最早于1983年由MikhailS.Balayan分离鉴定[1]。1988年DanielW.Bradley及其同事描述了HEV的分子特征[2]。该病毒属于肝炎病毒属,无囊膜,二十面体,直径约32~34nm。病毒基因组由单股正链RNA组成,长约7200 bp,包含三个开放式阅读框(ORF)。已经分离鉴定的HEV分为四种基因型,不同基因型在全世界范围内呈不同的地区分布。发生在亚洲和非洲的E型肝炎主要由基因1型HEV引起,1987年墨西哥暴发的E型肝炎由基因2型HEV引起,世界范围内偶然发生的E型肝炎主要由基因3型和基因4型HEV引起[3-4],越来越多的证据表明,基因3型和基因4型hHEV(humanHEV)基因组非常接近[5-10],有些与猪感染的HEV是一致的[11-12]。HEV是一种人兽共患病,猪可能还有其他动物是病毒的储存库[13]。跨种传播是HEV流行的主要原因之一,特别是在偶尔暴发的病例中[3]。
E型肝炎(HE)和A型肝炎(HA)临床症状极为相似,均表现为严重感染,典型的症状有流感样、呕吐、腹泻、发热、头痛和关节痛并伴有转氨酶升高和黄疸,黄疸症状可持续几周。因为通过粪便和经口感染,污染的食品和饮水是最常见的传染源。在偶尔暴发的地方性流行中,往往是由于食用生的或者未煮熟的海鲜或猪肉引起。东南亚和中亚、中东、非洲和中美洲是最主要的地方性流行区域。人与人之间的接触传播、污染的食品和血液制品,以及猪、家禽和其他动物作为人兽共患的HEV的储存宿主是大家所关注的。
MengXJ等分离鉴定了猪的HEV并采用反转录聚合酶链式反应(RT-PCR)扩增基因片段,并对扩增的片段进行测序,分析了美国不同地区来源的猪 HEV(sHEV)[14]。HEV 急性感染可采用电子显微镜检查粪便样品中的病毒粒子或者是采用RT-PCR方法扩增病毒特异性基因片段来加以诊断,但这些方法需要昂贵的实验设备和较高的检测技术,只能在极少数的实验室才能完成。扩增片段的基因序列分析也显示HEV基因序列有许多变异,RT-PCR方法的敏感性因此就会受到引物特异性的限制。血清学检测方法是最常用的诊断HEV感染的方法,根据IgM抗体水平可以诊断急性HEV感染,检测IgG抗体水平可以诊断HEV感染后期或感染后恢复。在人HEV(hHEV)感染的诊断中,血清学方法已得到了广泛的应用,特别是免疫酶技术,国内外均有多个公司生产的采用全病毒抗原、亚单位抗原或基因工程重组抗原包被的免疫酶试剂盒。本试验采用德国Mikrogen公司生产的两种免疫酶试剂盒:recomWellHEVIgG(swine)(recomWellR) 和 recomLineHEV IgG(swine)(recomLineR),检测实验感染hHEV基因3型和基因4型的无菌猪感染后不同天数(DPI)的抗hHEVIgG水平和消长规律,同时检测对照猪和多头未感染普通猪不同观察日龄的抗HEVIgG,比较两种免疫酶检测方法检测结果的符合程度和各自的优缺点,为临床合理选择使用该试剂盒检测sHEVIgG提供参考。
1 材料与方法
1.1 主要材料
RecomWellHEVIgG(swine)ELISA 检测试剂盒(recomWellR)、RecomLineHEVIgG (swine) test strips检测试剂条(recomLineR):购自德国Mikrogen公司。
血清样本:A1-A9、B1-B9 分别是基因3型hHEV人工感染2头无菌猪(A、B)后 0、7、14、21、28、35、42、49和 56d的血清样品;C1-C9、D1-D9分别是基因4型hHEV人工感染2头无菌猪(C、D) 后 0、7、14、21、28、35、42、49 和 56d 的 血 清 样 品 ;E1-E9、F1-F9分别为PBS液接种两头无菌猪血清样品,G1-G3、H1-H6、I1-I4和J1-J5为未感染普通猪血清样品。所有样本均由美国爱荷华州立大学兽医学院兽医诊断与动物生产系Opriessnig实验室提供。
1.2 方法
猪抗HEVIgG抗体检测按recomWellR和recomLineR检测试剂盒说明进行。血清样品作1:100稀释,反应后将酶标板置于酶标仪中,在450nm波长下读取recomWellRELISA检测样品的光密度值(OD),以650nm波长作为参考波长。recomLineR检测结果置两层吸水纸间先吸干水分,避光干燥约2h,然后将试纸条粘贴于评分记录表上,通过肉眼观察并按试剂盒判断标准进行评分。统计两种检测方法的检测结果并进行比较。recomLineR试纸条图1。
结果判定标准:recomWellRELISA检测应同时设两个临界点对照、阴性对照和阳性对照各一个,临界点对照OD值(Ecutoff)、阴性对照OD值(ENeg)和阳性对照 OD 值(Epos)应符合以下条件,两个Ecutoff的差异应小于20%,然后取平均Ecutoff,ENeg ≤0.15,Ecutoff-ENeg ≥0.050,Epos-ENeg≥0.300,只有在上述条件成立的前提下,才能对样品检测结果进行判断。recomLineR每一试纸条上反应控制条带(最顶端的第一条带)应出现深紫色条带,抗体种类控制条带(第二和第三条带,分别为IgG和IgM)中与酶接合物一致的条带应出现清晰的颜色反应,而另一条不出现或仅出现极弱的非特异性条带;临界点对照条带(第四条带)应出现弱的条带,但明显而清晰。只有在上述条件成立的前提下,才能对样品检测结果进行判断。根据试剂盒说明书上对各检测条带出现颜色反应深浅的评分标准可以得到每一条带确定的分值,计算各条带相加的总分值,再根据分值范围确定检测结果的阴阳性。具体标准如表1、2和3所列。

?
2 结果
2.1 猪抗HEVIgGrecomWellR ELISA检测结果
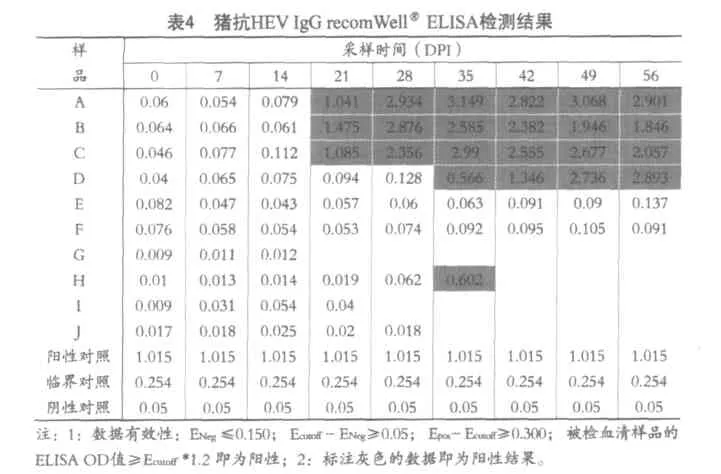
recomWellRELISA检测hHEV基因3型,4型和PBS液接种无菌猪不同时间所采血清样品54份,以及未感染普通猪血清样品18份,检测结果见表4。
?
从表4可知,阴、阳性以及临界点对照均成立,两头hHEV基因3型人工感染无菌猪A和B,于接种感染后第21d开始出现猪抗hHEVIgG阳性,一直到56DPI都为阳性;两头hHEV基因4型人工感染无菌猪C和D中,C于21DPI开始出现猪抗hHEVIgG阳性,一直到56DPI都为阳性;而D从35DPI开始出现猪抗hHEVIgG阳性,到56DPI仍为阳性;两头PBS液接种无菌猪E和F在观察期内与hHEV接种猪同时所采集的所有样品均为阴性;4头普通猪的18份血清样品中只有1份为阳性,该头猪正常饲养条件下于观察采样的第35天出现了抗HEVIgG。
2.2 猪抗HEVIgGrecomLineR免疫试纸条检测结果
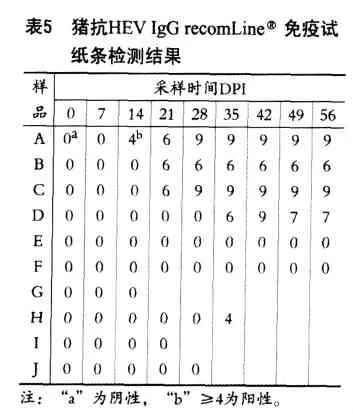
RecomLineR免疫试纸条检测样品同recomWellRELISA检测样品,根据试剂盒的评分标准,各样品的检测分值见下表5。
免疫试纸条上对照均成立,两头hHEV基因3型人工感染无菌猪A和B中,其中14DPI开始出现猪抗hHEVIgG阳性,一直到56DPI都为阳性;B从 21DPI开始出现猪抗hHEVIgG阳性,一直到56DPI都为阳性;两头hHEV基因4型人工感染无菌猪C和D中,其中C从21DPI开始出现猪抗hHEVIgG阳性,一直到56DPI都为阳性;而D从35DPI开始出现猪抗hHEVIgG阳性,到56 DPI仍为阳性;两头PBS液接种对照无菌猪在观察期内与hHEV接种猪同时采集的所有样品recomLineR免疫试纸条检测均为阴性;来自四头普通猪的血清样品18份中,1份recomLineR免疫试纸条检测阳性。
?
2.3 两种检测方法比较
两种检测方法检测的72份样品中,recomWellRELISA法检出阳性样品23份,阳性检出率为32.0%(23/72),recomLineR免疫试纸条法检出阳性样品24份,阳性检出率为33.30%(24/72),阳性检出率两者差异不显著(P>0.05);在 recomWellRELISA法检出的23份阳性样品中,recomLineR免疫试纸条法检测均为阳性,两者阳性检出符合率为100%(23/23);recomWellRELISA 法的漏检率约 4.1%(1/24)。
3 分析与讨论
HEV包括三个 ORF[2],其中ORF2和ORF3高度保守的结构域适合作为特异敏感的包被抗原[15],基因1型和基因3型ORF2和ORF3部分抗原基因分别克隆重组后经大肠杆菌表达,表达产物高度纯化后包被96孔酶标板制成recomWellHEVIgG ELISA酶标板,酶结合物为抗猪IgG酶标抗体,其基于间接ELISA法检测猪抗HEV抗体。RecomLineHEV IgG免疫试纸条法是将重组的高度纯化的HEV基因1型和3型的 ORF2 N端和C端、ORF2M以及ORF3表达产物按一定的排列顺序线性点在硝酸纤维素膜上,然后将包被的硝酸纤维素膜切成细条制成。利用它来检测抗HEV特异性抗体时,试纸条和稀释的血清样品一起孵育,这样抗体就会和试纸条上的抗原结合,没有结合的抗体通过洗涤步骤去除,试纸条再和辣根过氧化物酶标记的抗猪IgG孵育,试纸条上特异性结合的抗体和酶标抗体特异性结合,通过酶催化底物的显色反应检测抗HEV特异性抗体的存在。在免疫酶试纸条顶端,还包括4条顺序排列的对照条带,第一条为反应控制条带,对每一个待检样品它都会出现显色反应,第二条和第三条为酶结合抗体种类控制条带,如果酶结合抗体为IgG,则IgG控制条带会出现颜色反应,如果酶结合抗体为IgM,则IgM控制条带会出现颜色反应,第四条为临界值控制条带,用其控制显色反应程度以评估待检抗体究竟是阳性、阴性或者是可疑。
文献报道,基因3型和基因4型hHEV基因组非常接近[5-10],感染猪的主要是基因3型和基因4型HEV[11-12],人偶然暴发的HE主要由基因3型和基因4HEV引起,而基因1型是常见的引起人HE地方性流行的病因。如结果所示,两种酶免疫法能同时检测针对基因3型和基因4型hHEV感染无菌猪抗hHEVIgG抗体。因为两种试剂盒的包被抗原均为基因1型和3型的混合抗原,本试验结果也证实1、3和4基因型HEV抗原之间存在明显的交叉,这与HEV只有一个血清型相符,因此,可以采用基因1型和基因3型或者基因1型和基因4型重组抗原包被酶标板或试纸条用于检测人和猪的HEV感染,只是在检测人和猪的抗HEV IgG或IgM抗体时,分别采用不同的酶结合第二抗体即可。这两种试剂盒可广泛应用于猪群HEV感染血清或血浆抗体检测和监测,recomLineR免疫试纸条法不需要特殊昂贵的检测设备如酶标仪等,操作步骤也更简便,因此更适合基层单位使用。
[1]Balayan M S,Andjaparidze A G,Savinskaya S S.Evidence for a virus in a non-A,non-B hepatitis transmitted via feco-oralroute[J].Intervirol,1983,20(1):23-31.
[2]Brandley D,Andjaparidze A G,Cook Jr E H,etal.Ateiological agent of enterically transmitted non-A,non-B hepatitis[J].J Gen Virol,1988,69(3):731-738.
[3]Emerson S U,Pucell R H.Hepatitis E virus[J].Rev Med Virol,2003,13:145-154.
[4]Bouwkegt M,Frakena K,Rutjes S A,etal.Estimation of hepatitis E virus transmission among pigs due to contact-exposure[J].Vet Res,2008,39(1):40.
[5]Tam A W,Smith M M,Guerra M E,et al.Hepatitia E virus(HEV):Molecular cloning and sequencing of the full-length viralgenome[J].Virol,1991,185:120-131.
[6]Huang C C,Nguyen D,Fernandez J,et al.Molecular cloning and sequencing of the Mexico isolate of hepatitis E virus (HEV)[J].Virol,1992,191:550-558.
[7]Schlauder G G,Dawson G J,ErkerJ C,et al.The sequence and phylogenetic analysis of a novel hepatitis E virus isolated from a patientwith acute hepatitis reported in the United Sates[J].JGen Virol,1998,79:447-456.
[8]Takahashi K,Kang J H,Ohnishi S,et al.Full-length sequences of six hepatitis E virus isolates ofgenotypeⅢandⅣfrom patients with sporadic acute or fulminanthepatitis in Japan[J].Intervirol,2003,46:308-318.
[9]Takahashi K,Kitajima N,Abe N,et al.Complete or near complete nucleotide sequences of hepatitis E virus denome recovered from a wild boar,a deer,and four patients who ate the deer[J].Virol,2004,330:501-505.
[10]Lewis,Boisson S,Ijaz S,et al.Hepatitis E in England and Wales[J].Emerg InfectDis,2008,14:165-167.[11]Nishizawa T, Takahashi M,Mizuo H,et al.Full-length sequences ofsix hepatitis E virus isolates ofgenotypesⅢandⅣfrom patients with sporadic acute or fulmimant hepatitis in Japan[J].Intervirol,2003,46:308-318.
[12]Yazaki Y,Mizuo H,Takahashi M,et al.Sporadic acute or fulminant hepatitis E in Hokkaido,Japan may be food borne,as suggested by the presence of Hepatitis E virus in pig liver as food[J].J Gen Virol,2003,84:2351-2357.
[13]Meng X J.Swine hepatitis E virus:Cross-speciesinfection and risk in xenotransplantation[J].Curr Top Microbiol Immunol,2003,278:185-216.
[14]Meng X J,Halbur P G,Haynes J S,etal.A novelvirus in swine isclosely related to the human hepatitis E virus[J].Proc NatlAcad SciUSA,1997,94:9860-9865.
[15]Anderson DA,Li F,Riddel M,et al.ELISA for IgG-class antibody to hepatitis E virus based on a highly conserved,conformational epitope expressed in Escherichia coli[J].J Virol Methods,1999,81:131-142.

