氯化物镀锌液中的金属杂质及其处理
袁诗璞
(成都市机投镇会所花园A3–02–202,四川 成都 610045)
氯化物镀锌液中的金属杂质及其处理
袁诗璞
(成都市机投镇会所花园A3–02–202,四川 成都 610045)
介绍了氯化物镀锌液中铁、铜、铅等金属杂质的产生原因以及对镀层的影响。其去除方法是:先以工业级高锰酸钾氧化,然后加入高纯细锌粉还原,最后沉淀过滤。处理后应采用双氧水将过量的高锰酸钾去除,调整pH,以及补加光亮剂。
氯化物镀锌;金属杂质;去除
1 前言
钢铁件上的锌镀层作为牺牲性阳极保护镀层,应用面极广,其加工量达电镀总量约60%以上。
尽管我国在氯化物与锌酸盐镀锌的无氰镀锌上已基本取代了剧毒氰化镀锌(一些军工产品及个别用户还在采用),且已应用多年,在生产实践中,仍不断反映出一些问题。笔者接到过不少同行的咨询电话,除添加剂问题外,杂质问题居第二位。添加剂受售品单位利益问题,不好公开多讲,但认真讨论一下杂质问题,对用户与助剂供应商都有益。
氯化物镀锌尽管防蚀力不高,但相对于锌酸盐镀锌,阴极电流效率高(对铸件等氢超电势低的基体易于施镀)、镀层光亮性好、对杂质敏感性较低。由于汽摩、电器零件等现多要求采用锌酸盐镀锌,且出口件要求采用三价铬钝化,因此锌酸盐镀锌复苏很快。但该工艺对杂质异常敏感,更有必要认真讨论杂质问题。
杂质问题涉及许多理论与实践问题,报道比较分散,且有的报道并不合实际。笔者拟撰文分别对上述两种镀锌工艺的杂质问题进行讨论,以供参考。本文先讨论氯化物镀锌液中的金属杂质问题。
氯化物镀锌液中最易引入的是铁杂质,其去除方法颇有考究,是重点讨论对象。
2 二价铁离子Fe2+
2. 1 引入途径及工艺条件的影响
一是镀前酸洗后未作认真的清洗,造成大量引入(尤其是滚镀)。沈品华[1]曾报道过一例类似的故障处理实例,寻找原因及解决办法都颇费周折。二是钢铁件在弱酸性镀液中的化学浸蚀。在滚镀时,由于多种原因造成工件混合周期过长,工件又未带电入槽或采用冲击镀,下槽后先会大量被腐,较长时间才沉积一层锌。机加工小件粘有的屑、渣粉等,镀前处理时未被去掉而进入镀液,挂镀时掉件未及时捞出而造成工件在液中腐蚀损坏,都会向镀液中引入Fe2+。复杂件(特别是管件及有盲孔件),挂镀时也易局部被腐而引入Fe2+。镀液的pH越低,腐蚀越严重,加之pH低时添加剂用量与消耗量大增;液温越高,工件腐蚀越快(滚镀时镀液往往升温很快)。这些都会导致Fe2+生成速度很快。笔者对国内竞相开发高温载体以适应粗放式管理企业的做法,历来持反对态度:其结果只会使我国氯化物镀锌的总体质量、管理与设备水平,与发达国家和地区的差距越来越大。
2. 2 Fe2+的影响
在微酸性条件下,Fe2+与Zn2+易于共沉积。氯化物镀锌属简单盐电镀。尽管Cl−对Zn2+有配位作用,但配位能力非常弱,[ZnCl4]2−配离子很不稳定。所以,镀液中的氯化钾实际上仅起到导电盐的作用。屠振密老师[2]指出,在简单盐电镀液中,可以从标准电极电位大致判定合金共沉积的可能性。在酸性条件下,为−0.762 V,为−0.441 V,是有可能共沉积的。实际上,在镀液中加入 Fe2+稳定剂与适当添加剂,就能镀取锌铁合金。这方面,曾祥德有过很多报道。然而实际共沉积条件不取决于标准电极电位,而取决于析出电位。赫尔槽试验反复证明,Fe2+会在试片高中电流密度区造成恶劣影响。因此,以小电流密度电解除铁的说法是完全错误而不可信的。
2. 2. 1 对镀层外观的影响
文献[1]指出:赫尔槽试验发现,Fe2+达0.2 g/L时,试片高端20 mm出现烧焦和粗糙区;达0.3 g/L时,试片几乎一半烧焦,同时低区镀层发灰。Fe2+多时,滚镀件易产生黑点状滚筒印。可见,Fe2+大大降低了允许阴极电流密度与光亮电流密度范围。
2. 2. 2 对低铬钝化层的影响
共沉积于镀层中的铁,在低铬钝化时会溶解于钝化液中,使低铬彩钝层透明性下降,色泽乌暗。笔者曾系统测试过阳离子对低铬彩钝层的调色作用,发现往钝化液中加入少许FeSO4·7H2O时,钝化色泽加深;FeSO4·7H2O稍多则色泽乌暗。只有加入适量CuSO4·5H2O可使大平面工件彩钝后色泽均匀,但黄色增加。Fe2+使低铬银白钝化层高阴极电流密度区发黄,甚至乌黑,也使低铬蓝白钝化层易泛彩、发雾。
2. 2. 3 对三价铬钝化的影响
马冲等人[3]指出,在早期研究的钝化液中,铁离子含量超过100 mg/L,钝化膜的防护能力会明显下降。而对于新一代抗铁离子污染能力较强的三价铬钝化剂,当钝化液中铁离子质量浓度超过350 mg/L时,钝化膜的耐盐雾腐蚀能力也大幅下降。
2. 3 镀层中铁杂质的判定
取镀液于250 mL赫尔槽中,采用铁试片,以1.5 A电流静镀5 min,清洗后在体积分数为2% ~ 3%的稀硝酸溶液中出光3 ~ 4 s,若试片高中电流密度区镀层色泽依“泛黄—暗黑—深黑”变化,则说明镀液中 Fe2+含量越来越高,应作去除处理。
2. 4 Fe3+的产生及影响
2. 4. 1 Fe2+的氧化特性
陈寿椿[4]较详细讨论过Fe2+的氧化特性,指出:(1) 二价铁盐是强还原剂,Fe2+有变为Fe3+的强烈倾向。亚铁盐暴露在空气中即发生氧化作用,在溶液中可被溶解氧氧化为碱式盐:

(2) 碱性溶液中的 Fe2+甚易被空气氧化为 Fe3+。碱性条件下,Fe3+是铁的稳定态。
(3) 在显著的酸性条件下,溶液中的 Fe2+不易被空气中的氧所氧化。例如铁件用盐酸酸洗后,酸洗液呈绿色,而不易变黄。
(4) 在弱酸及微酸性条件下,pH越低,Fe2+越不易被空气氧化为Fe3+。随溶液pH上升,Fe2+被空气氧化的速度加快。此时,因生成三价铁盐,氯化钾镀锌液的棕黄色逐渐加深。
(5) 在弱酸性条件下,Fe2+易被氧化剂氧化为Fe3+。因氧化反应都必须有H+参与,故pH越低,Fe2+越易被氧化剂所氧化。例如:
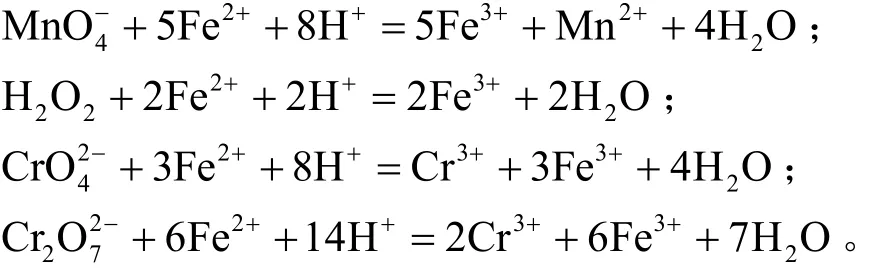
众所周知,过去广泛在pH <3.5的情况下将硫酸亚铁加入废水中,用以还原六价铬。但因投药比大,生成铁污泥多,现多改为在低pH下用焦亚硫酸钠或亚硫酸氢钠来还原六价铬,因为一分子焦亚硫酸钠可水解产生两分子亚硫酸氢钠。
2. 4. 2 生成Fe(OH)3的pH条件
文献[5]推导出了不同金属离子质量浓度ρ(mg/L)与摩尔质量Mi、生成氢氧化物的溶度积常数Ksp、离子价态n与沉淀所需pH的关系如下:

代入相关数据,Fe3+生成Fe(OH)3沉淀所需pH为:Fe3+为100 mg/L时,pH为2.442;Fe3+为1 mg/L时,pH为3.109。
当氯化钾镀锌液pH为5.4时,残存的游离Fe3+仅约5.93 × 10−12mg/L,完全可以忽略不计。
可见,在工艺pH条件下,一旦Fe2+被氧化为Fe3+,则几乎立即转化为棕黄色的 Fe(OH)3沉淀。这是镀液易变黄、滚镀液呈黄泥浆状的原因。
2. 4. 3 Fe(OH)3的影响
虽然可以查到Fe(OH)3放电的电极电位:

但实际上并不会在阴极还原成Fe与锌共沉积。原因是:即使放电产生 Fe(OH)2,在微酸性条件也会立即变为Fe2+,要么以Fe2+形式放电,要么很快又被氧化为Fe3+,再度成为 Fe(OH)3沉淀。以胶体状或细微粒子状悬浮于镀液中的Fe(OH)3,可能因吸附、电泳的形式夹附于镀层中,使镀层光亮整平性下降,甚至产生针孔、麻点。
3 铜、铅杂质
3. 1 引入途径
铜杂质(Cu2+)主要是因为铜挂钩落入镀液后被腐蚀,或刷洗阴、阳极铜导电杆时而引入。铅杂质主要因不纯阳极溶解而引入。个别情况下,镀含铅的锌压铸件时,工件及掉件腐蚀也会引入Pb2+。
3. 2 影响
沈品华[1]认为,铜杂质在1 × 10−5mg/L(即10 ppm)以下无明显影响;达0.15 g/L时,高阴极电流密度区出现明显烧焦和粗糙,低阴极电流密度区镀层发黑。铅杂质影响比铜杂质严重,应控制在5 × 10−6mg/L以下。其含量很少时,镀层发雾,钝化膜易变色;其含量多则滚镀时难以上镀。含铅镀锌层在蓝白钝时难以出现蓝色色调,彩钝时膜色极易变淡。生产中应尽量采用 0#锌阳极,1#锌可用,但决不能用2#锌。
3. 3 去除
铜、铅杂质虽可用小电流长时间电解去除,但费工、费电、耗料,而且要不时搅拌镀液,故很少采用。由于 Cu2+、Pb2+还原为金属时的标准电极电位分别为+0.337 V与−0.126 V,比锌的标准电极电位−0.762 V正得多,在金属锌上易发生置换反应,因而常用锌粉置换反应加以去除。置换时,在微细锌粉表面形成金属Cu与Pb,沉淀后过滤去除。通常在氧化除铁时,同时用锌粉处理。
锌粉要用高纯度的。市面上有用热镀锌产生的锌灰或锌渣磨细后冒充锌粉的伪劣产品出售,其含铅、铁杂质很多。切勿因小失大。
4 去除金属杂质的程序
4. 1 Fe2+氧化剂的选择
虽然双氧水也可氧化 Fe2+为 Fe3+,但试验与生产应用反复证明,用H2O2氧化后,生成的Fe(OH)3呈胶体状,长时间不易自然沉降,要另加絮凝剂才行。而用高锰酸钾氧化,很快就生成大矾花状的 Fe(OH)3絮状沉淀,用烧杯试验时,0.5 h内上部溶液就能澄清。经试验对比后,笔者建议:氯化物镀锌液中氧化Fe2+,宜采用工业级高锰酸钾作氧化剂。
4. 2 处理条件
在室温与工作液pH下进行。pH低时,虽氧化效果好,但调高 pH却较难,稍有不慎则生成 Zn(OH)2沉淀。
无作者署名的文献[6]中说:“去除铁杂质,需将镀液加热至60 °C左右,然后用氢氧化钠提高镀液的pH至 6.0,使之生成氢氧化物沉淀”。然而文中只字未提是否加入氧化剂,而且要求加温与调高pH的说法不知从何而来(该文并未列出参考文献),也不符合实际。笔者是国内较早应用氯化物镀锌的电镀工作者之一,除铁无数次,从未如此做过。实际上,单就加温而言,氯化物镀锌加工的附加值都低,全靠量大薄利挣点辛苦钱,因而镀液体积都大。试问如何加温?加温到60 °C后又如何降温到30 °C以下正常工作?
4. 3 具体处理程序
(1) 取工业高锰酸钾,用热水溶解(高锰酸钾不易溶完)。
(2) 在不断强烈搅拌下,慢慢将高锰酸钾溶液加入镀液中,至镀液刚微红。若先做过实验确定了同样浓度高锰酸钾溶液的最佳量,则按镀液体积换算后加入定量的同浓度高锰酸钾溶液。
(3) 继续搅拌半小时以上,以氧化彻底。
(4) 按1 g/L左右的量加入高纯细锌粉。先用水调成糊状,在搅拌下慢慢加入,搅匀镀液。注意:锌粉具有强还原性,千万不要与氧化剂同时加入,否则易劳而无功。加入锌粉更有助于Fe(OH)3自然沉降。
(5) 自然澄清几小时。
(6) 小心将上部清液用泵或利用虹吸原理移入另一空槽中。由于氯化物镀锌液除铁较频繁,最好另有一个体积大的专用处理槽。建议在车间外用高标号水泥专门做一个砖混结构处理池,用铸铁潜水泵抽液。强调一下:镀液澄清后应及时过滤,否则在酸性条件下,锌粉会再度溶解,置换出的杂质又进入了镀液。
(7) 过滤沉淀。由于沉淀含水率很高,不能直接将其倒入废水中,否则会加重废水处理的负担,而且浪费镀液。可采用下述办法进行过滤(用溶液过滤机太易堵塞滤芯):
一、用过滤布进行过滤,但滤布要勤洗,而且过滤较慢。
二、用滤布制成袋子,悬空放置,将污泥注入袋内,利用重力,使过滤加快,可得到较干的污泥。
三、专门做一个类似废水处理用砂滤池的滤槽,槽高约2/3处焊一钻孔塑料板,板上先垫一层滤布,滤布上再放一层清洗过的粗砂,槽底侧设一放液塑料阀,进行砂滤。
4. 4 处理后镀液的后续处理
4. 4. 1 过量高锰酸钾的去除
由化学平衡移动原理可知,要一次处理使 Fe2+氧化彻底,应当过量投加KMnO4。正如电镀废水处理时还原六价铬,若用硫酸亚铁作还原剂,Cr(VI)与FeSO4·7H2O的理论投药比(质量比)为 1∶16,但当Cr(VI)质量浓度<50 mg/L时,实际投药比应达到1∶30,而当Cr(VI)质量浓度<20 mg/L时应达1∶50。
镀液中残存的 KMnO4会继续氧化破坏光亮剂而有害,应予以去除。方法为:过滤后的镀液在不断搅拌下按约1 mL/L的量加入30% H2O2稀释10倍后的溶液。因KMnO4氧化能力远比H2O2强,此时H2O2成为还原剂而将残余的KMnO4还原:

当用H2O2作Fe2+的氧化剂时,残存H2O2也会氧化邻氯苯甲醛主光剂,此时也可试加少量KMnO4将之氧化去除。
双氧水的加入量最好用以下方法确定:用烧杯取1 L过滤后的镀液,在搅拌下滴加稀释了的双氧水,至镀液无色透明即可,按此试验最佳量换算后在搅拌下往镀槽中加入同样浓度的双氧水。
4. 4. 2 pH的调整
由于处理时总有H+参与反应,加之难免有镀液损失而补加水,处理后镀液的pH会有所上升。若pH上升到最佳值以上,应先用盐酸或稀硫酸将pH调低到最佳值。
4. 4. 3 光亮剂的补加
实践证明,KMnO4对主光剂苄叉丙酮破坏不多,但以邻氯苯甲醛作主光剂(或混合型)时,由于邻氯苯甲醛本身的抗氧化性很差,很易被氧化为邻氯苯甲酸(用H2O2作氧化剂时也会被大量破坏),用KMnO4氧化 Fe2+时,几乎要被氧化殆尽,补加时要按新开缸量补加。
尽管用邻氯苯甲醛作主光剂时起光速度快、镀层亮度高,但除了其稳定性差外,低铬彩钝时容易脱膜(镀液pH高些,则彩钝膜附着力好些)。由于同一镀槽中既要镀蓝白锌,又要镀彩锌,笔者曾因彩钝脱膜(用户又要求色深而鲜艳)而造成大批返工,立即作除铁处理,同时去除液中的邻氯苯甲醛。坚持请助剂生产单位配制全苄叉丙酮型主光剂的添加剂。只要工艺液勤于调好,仍有好的光亮性与快的起光速度。作为阳极性镀层,也不能过度追求“亮了就取”,否则抗蚀力更差。特别申明:笔者并不反对采用邻氯苯甲醛作主光剂。若以镀银白、蓝白锌为主,又有本事保证色鲜的彩钝膜仍有良好附着力,也可采用。
因此,在处理镀液并加足水搅匀后,都应取液用赫尔槽试验调整补加光亮剂等组分,但应在调好pH后再做。
[1] 沈品华, 屠振密. 电镀锌及锌合金[M]. 1版. 北京: 机械工业出版社, 2002.
[2] 屠振密. 电镀合金原理与工艺[M]. 1版. 北京: 国防工业出版社, 1993.
[3] 马冲, 李文波, 左正勋. 影响锌镀层三价铬钝化膜耐中性盐雾腐蚀的因素[J]. 电镀与涂饰, 2007, 26 (11): 4-7.
[4] 陈寿椿. 重要无机化学反应[M]. 2版. 上海: 上海科学技术出版社, 1982.
[5] 黄渭澄, 袁华, 袁诗璞, 等. 电镀三废处理[M]. 1版. 成都: 四川科学技术出版社, 1983.
[6] 佚名. 无铵弱酸性氯化物镀锌液故障的处理[J]. 现代电镀, 2009 (6): 25-27.
[ 编辑:温靖邦 ]
Metallic impurities in chloride zinc plating bath and their treatment //
YUAN Shi-pu
The origin of metallic impurities such as iron, copper and lead in chloride zinc plating bath and their effects on deposit were described. The removal method is as follows. First, oxidation with industrial-grade potassium permanganate; second, reduction with fine high-purity zinc powder; third, precipitation and filtration. After above treatments, the removal of excess potassium permanganate using hydrogen peroxide, adjustment of pH and replenishment of brightening agent should be performed.
chloride zinc plating; metallic impurity; removal Author’s address: A3–02–202 Huisuo Residential Garden, Jitou Town, Chengdu 610045, China
TQ153.15
A
1004 – 227X (2010) 07 – 0016 – 04
2010–05–10
袁诗璞(1944–),男,四川成都人,本科学历,高级工程师,成都表面处理研究会秘书长,成都表面工程行业协会学术专业委员会主任。长期从事电镀技术工作,有丰富的实践经验。
作者联系方式:(Tel) 028–87423973。

