一株具有抑制麦芽糖酶活性的乳酸菌的筛选与鉴定
吴彬彬,郭本恒,,*,张 灏,王荫榆,吴正钧
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214036;2.光明乳业股份有限公司技术中心,上海200436)
一株具有抑制麦芽糖酶活性的乳酸菌的筛选与鉴定
吴彬彬1,郭本恒1,2,*,张 灏1,王荫榆2,吴正钧2
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214036;2.光明乳业股份有限公司技术中心,上海200436)
以抑制麦芽糖酶为目的,采用α-葡萄糖苷酶抑制剂的体外筛选模型,筛选出具有较好麦芽糖酶抑制效果的乳酸菌菌株JH28。菌株JH28的MRS发酵上清及无细胞提取物均对麦芽糖酶有抑制作用。将该菌株的无细胞提取物经透析膜(截留分子量1000Da,去离子水为透析液)透析后取透析液冻干,测定不同浓度冻干物对麦芽糖酶的抑制效果,最高抑制率可达67.19%,经计算其IC50为4.12mg/mL。菌株经16S rDNA鉴定为干酪乳杆菌,具有潜在的工业应用价值。
乳酸菌,筛选,抑制,麦芽糖酶
根据1999年世界卫生组织(WHO)和国际糖尿病联盟(IDF)公布的定义,糖尿病(DM,DiabetesMellitus)一词是描述一种多病因的代谢疾病,特点是慢性高血糖,伴随因胰岛素(Insulin)分泌及/或作用缺陷引起的糖、脂肪和蛋白质代谢紊乱。由糖尿病引起的高血糖症将会导致各种血管综合病症发病率的增加,如视网膜病变、神经病变及肾脏病变[1]。因此,控制餐后高血糖对于治疗早期糖尿病及减轻慢性血管综合症具有极其重要的意义[2]。其中,控制进食后碳水化合物的吸收是一种降低餐后高血糖的治疗方法。由于小肠只能够吸收和运输单糖到血液循环中,而α-葡萄糖苷酶能够将多糖水解为单糖,因此被认为是肠内葡萄糖吸收的重要因素。麦芽糖酶是位于小肠内的一种重要的α-葡萄糖苷酶,能够将一分子麦芽糖水解为两分子葡萄糖,是人体消化吸收葡萄糖,转化为血糖的重要因素。对于II型-非胰岛素依赖型糖尿(NIDDM)病患者而言,服用一些含有α-葡萄糖苷酶抑制剂的降血糖口服药能够有效地降低高血糖[3]。这些药物能够抑制双糖水解成单糖,减缓葡萄糖的消化与吸收,从而降低餐后血液中的血糖含量。自从1960年,nojirimycin被发现以来,人们又从天然产物中分离或人工合成了大量的葡萄糖苷酶抑制剂。Young-Jun Shim[4]等研究了草本植物对α-葡萄糖苷酶的抑制活性,提出它可能会通过抑制碳水化合物的消化和吸收从而影响葡萄糖的摄入,维持糖尿病人正常的葡萄糖动态平衡。近年来,有报道称益生菌(乳酸菌)对于糖尿病的治疗有一定效果[5],S.l.Yun[6]等从母乳中筛选出BNR17,以活菌喂养进行动物实验,研究发现BNR17能够有效降低血糖及改善糖尿病症状。然而,尽管有诸多研究表明乳酸菌具有减少糖尿病发病率的潜力,人们对于乳酸菌作为糖尿病治疗剂的研究还是很少。本文以麦芽糖酶为靶向酶,建立了α-葡萄糖苷酶抑制剂的体外筛选模型,筛选具有抑制麦芽糖酶活性的乳酸菌。
1 材料与方法
1.1 材料与设备
菌株 来源于健康人体粪便及光明乳业技术中心保藏的菌种(包括干酪乳杆菌LC2W,BD-2,植物乳杆菌ST-III,鼠李糖乳杆菌LGG等);麦芽糖酶(maltase,EC3.2.1.20)、p-Nitrophenyl- α -glucopyranoside(PNP-glycoside) sigma公司;其他试剂 国产常规生化纯和分析纯试剂;MRS培养基德国Merck公司。
恒温水浴锅 上海精宏实验设备有限公司;KAT 25高速组织分散机 德国IKA公司;Avanti J30I高速冷冻离心机 Beckman Coulter公司;厌氧培养箱英国 RUSKINN TECHNOLOGY LIMITED公司;APV1000型高压均质机 丹麦APV公司;PHS-25型pH计 奥立龙公司;真空冷冻干燥机、TH-CB-402型超净工作台 LABCONCO公司;CE7250型紫外分光光度计 BIO-AQUARIUS公司;;MDF-U超低温冰箱日本SANYO公司。
1.2 实验方法
1.2.1 乳酸菌的分离和保存 从健康人体粪便中取样,采用pH6.8的无菌缓冲液进行10倍梯度稀释,取10-3、10-4、10-5、10-6四个稀释度涂布于乳酸菌分离培养基平板上,37℃厌氧培养36~72h后,挑选单菌落,划线纯化得到纯培养物,进行革兰氏染色,接触酶实验。纯化菌株在MRS斜面上4℃短期保存,置于30%(W/W)无菌甘油中,在-70℃超低温冰箱中长期保存[7]。
1.2.2 初筛样品的制备 实验菌株经活化三代后,以1%接种量转接于MRS肉汤培养基中,37℃厌氧培养24h,4℃,8000r/min离心15min,分别收集发酵上清液及菌体。发酵上清液采用1mol/L NaOH调节pH至6.8,4℃保存;菌体经磷酸盐缓冲液(20mmol/L,pH6.8)洗涤三次,重悬于缓冲液中,高压均质(25,000psi)破碎细胞后,4℃,12000r/min离心15min,收集上清液,即为无细胞提取物,4℃保存。
1.2.3 复筛样品的制备 制备方法采用L.ramchandran[8]等的方法,略加改动。
实验菌株经活化三代后,以1%接种量转接于12%灭菌脱脂乳中,分别于37℃厌氧培养0、24、48h。取5mL发酵混合液,加入1mL去离子水,10mL 0.75N三氯乙酸(TCA),在4℃下,4000×g离心30min。取上清液经0.45μm膜过滤,即为待测样品,于-20℃保存。
1.2.4 麦芽糖酶抑制活性的测定 麦芽糖酶抑制活性的测定方法采用Zhang[9]等的方法,略加改动。在300μL pH6.8的缓冲中加入150μL 20mmol/L PNP-glucosidase溶液及50μL待测样品,将混合物于37℃水浴10min。加入100μL麦芽糖酶溶液(0.2u/mL)继续反应5min。加入2mL 0.05mol/L氨水作为反应
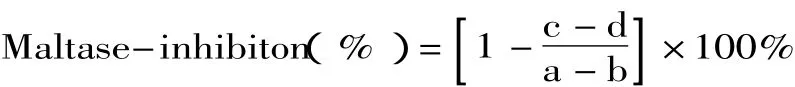
其中a为含有麦芽糖溶液但不含样品的测定吸光值,b为不含麦芽糖溶液及待测样品的测定吸光值,c为含有麦芽糖酶溶液及待测样品的测定吸光值,d为不含麦芽糖溶液但含待测样品的测定吸光值。
1.2.5 筛选菌种的分子生物学鉴定 菌株JH28的16S rRNA基因序列分析:PCR扩增反应采用25μL体系,反应条件:94℃,5min;94℃,1min,50~55℃,1min,72℃,1.5min,30个循环;72℃,5min。回收PCR产物,由invitrogen公司测序。终止液。并将反应液于405nm处测其吸光值,吸光值与p-nitrophenol的游离量成正比。采用以下公式计算样品的抑制活性:
2 结果与讨论
2.1 乳酸菌的初步分离
从健康人体粪便中,利用MRS固体培养基分离得到了200个分离株,经过菌落形态、革兰氏染色、接触酶实验排除了5株革兰氏阴性细菌,2株接触酶阳性细菌和2株酵母,得到191株乳酸菌分离株。
2.2 抑制麦芽糖酶活性的乳酸菌筛选结果
实验菌株经活化三代后,以1%接种量转接于MRS肉汤培养基中,37℃厌氧培养24h,离心后分别取上清及菌体破碎物测其对麦芽糖酶的抑制活性,菌体破碎物测定筛选部分结果如图1所示。取菌体破碎物抑制效果较好的菌株进行复筛,最终获得一株JH28,其MRS发酵上清液及胞内产物均对麦芽糖酶有显著抑制效果,其胞内产物在一定范围内对麦芽糖酶的抑制率与样品剂量呈正相关(图2)。
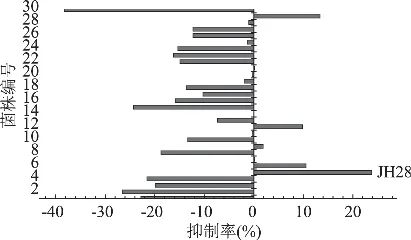
图1 菌体筛选结果

图2 JH28胞内提取物对麦芽糖酶抑制作用的剂量效应
分离得到的191株乳酸菌中大部分菌株表现出对麦芽糖酶的促进作用,或对酶活无影响,只有少量菌株的MRS发酵上清及胞内产物对麦芽糖酶表现出抑制作用,将经过初筛呈现阳性结果的菌株于脱脂乳中发酵24h,离心后取上清,加入TCA去除蛋白,离心后上清经0.45μm膜过滤,所得样品用于测其对麦芽糖酶的抑制活性。其中菌株JH28无论是MRS发酵上清还是其菌体破碎后的胞内产物都对麦芽糖酶表现出稳定的抑制作用,并且能于脱脂乳中发酵凝乳,脱脂乳发酵上清也有很好的抑酶活性,因此,选定菌株JH28作为实验菌株,进行下一步实验。
将菌株JH28经MRS发酵后的无细胞提取物于1000Da透析膜中透析48h,将透析液冷冻干燥,所得产物以pH6.8缓冲液配成不同浓度溶液,分别测其对麦芽糖酶的抑制效果,并计算出IC50,为4.12mg/mL(图2)。从图中可以看出,当样品浓度在1.5mg/mL以下时,随着浓度的增加,样品对麦芽糖酶的抑制率增加缓慢,曲线平稳,浓度达到2.5mg/mL时,随着样品浓度的增加,样品对麦芽糖酶的抑制率急剧上升,最高抑制率可达67.19%,此时样品浓度为6mg/mL,之后随着样品浓度的增加,样品对麦芽糖酶的抑制率不再升高,并隐约出现下降趋势,可能是由于样品与酶或底物的结合已达最大极限,随后再加入的样品对反应体系已无太大影响。
2.3 JH28的16S rDNA序列测定
菌株JH28的16S rDNA部分序列长约1447bp,根据菌株JH28的16S rDNA测序结果进行BLASTn分析,结果表明:菌株JH28与Lactobacillus casei BL23相似性为100%,与Lactobacillus casei ATCC 334相似性为100%。综合同源性分析,将菌株JH28归类为干酪乳杆菌,命名为Lactobacillus casei JH28。
3 结论
本文从自然来源中筛选出了一株具有麦芽糖酶抑制活性的乳酸菌菌株JH28,其MRS发酵上清及无细胞提取物均对麦芽糖酶具有抑制效果,该菌是否具有潜在辅助治疗糖尿病的作用,还需进行动物实验,以确定其在活体中的功效,并进一步从酶动力学等方面研究该菌相关成分对麦芽糖酶抑制作用的机理。
[1]Fujita Hiroyuki,Yanmagami Tomohide,Ohshima Kazunori. Efficacy and safety of touchi extract,an α-glucosidase inhibitor derived from fermented soybeans,in non-insulin-dependent diabetic mellitus[J].Journal of Nutritional Biochemistry,2001,12:351-356.
[2]Harold E Lebovitz.Effect of the postprandial state on nontraditional risk factors[J].The American Jorunalof Cardiology,2001,88(6A),20H-25H.
[3]Toeller M.α-glucosidase inhibitors in diabetes:efficacy in NIDDM subjects[J].European Journal of Clinical Investigation,1994,24(3):31-35.
[4]Young-Jun Shim,Ho-Kyung Doo,Se-Young Ahn,et al. Inhibitory effect of aqueous extract from the gall of rhus chinensis on α-glucosidase activity and postprandial blood glucose[J]. Journal of Ethnopharmacology,2003,85:283-287.
[5]Yadav H,Jain S,Sinha PR.Antidiabetic effect of probiotic dahi containing Lactobacillus acidophilus and Lactobacillus casei in high fructose fed rats[J].Nutrition,2007,23:62-68.
[6]Sl Yun,HO Park,JH kang.Effect of lactobacillus gasseri BNR17 on blood glucose levels and body weight in a mouse model of type 2 diabetes[J].Journal of Applied Microbiology,2009:1-5.
[7]凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[8]L Ramchandran,NP Shah.Proteolytic profiles and angiotensin -l converting enzyme and α-glucosidase inhibitory activities of selected lactic acid bacteria[J].Food Microbiology and Safety,2008,73(2):M75-M81l.
[9]Zhang Jian-Fen,Zheng Yu-Guo,Shen Yin-Chu.Inhibitory effect of valienamine on the enzymatic activity of honeybee(Apis cerana Fabr.)α-glucosidase[J].Pesticide Biochemistry and Physiology,2007,87:73-77.
Screening of lactic acid bacteria with inhibitory effect on maltase
WU Bin-bin1,GUO Ben-heng1,2,*,ZHANG Hao1,WANG Yin-yu2,WU Zheng-jun2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214036,China;2.Technology Center of Bright Dairy Co.,Ltd.,Shanghai 200436,China)
This study used an α-glucosidase inhibitor screening model in vitro targeted at inhibiting maltase activity and found bacterial strain JH28 that could obviously inhibit maltase activity.The supernatant and intra-cellular extracts of JH28 fermented in MRS both had inhibit activity on maltase.Different concentration of the intra-cellular extracts of JH28 was measured while freeze drying after dialysis(MWCO 1000Da,de-ionized water as dialysate),the highest suppression ratio could be 67.19%,and the lC50calculated was 4.12mg/mL.JH28 was also found inhibitory effect of the supernatant on maltase while fermented in skimmed milk.Bacterial strain JH28 was found as Lactobacillus casei though 16S rDNA method which had potential industrial applications.
Lactobacillus;screen;inhibitory;maltase
TS201.3
A
1002-0306(2010)11-0175-03
2009-09-27 *通讯联系人
吴彬彬(1985-),女,硕士研究生,主要从事乳品微生物研究。
国家科技支撑计划“十一五”奶业重大专项(2006BADO4A14)。

