鲤鱼组织蛋白酶L活性的影响因素研究
侯鲁娜,陈学云,聂小华,刘 璘
(浙江工业大学生物与环境工程学院,浙江杭州310014)
鲤鱼组织蛋白酶L活性的影响因素研究
侯鲁娜,陈学云,聂小华*,刘 璘
(浙江工业大学生物与环境工程学院,浙江杭州310014)
主要研究了鲤鱼组织蛋白酶L活性的影响因素。结果表明,鲤鱼组织蛋白酶L具有较强的稳定性,在-20℃冻藏、20~50℃加热处理、不同酸性环境中均保留了一定程度的活性;鱼肉中组织蛋白酶L在漂洗工艺中并不能完全去除,漂洗后仍残存了45.65%活性。此外,鲤鱼组织蛋白酶L在豆科类蛋白、大米蛋白、鸡蛋清蛋白、马铃薯蛋白、茶多酚和大豆异黄酮等各种食品组分作用下,其活性发生明显的下降,且呈现良好的量效关系。
鲤鱼,组织蛋白酶L,影响因素
鲤鱼是我国淡水养殖的主要品种,养殖面积大,产量高[1];但鉴于其肉质粗糙和土腥味,鲤鱼的鲜销受到很大程度的限制,急需进行深加工以提高其附加值。鱼糜制品是一类营养丰富、口味多样、实用方便的低胆固醇食品,深受消费者欢迎,是发展较快的一类水产食品。经多年的研究发现,鲤鱼完全适于用作鱼糜加工的原料[2-3],但其产品普遍存在着弹性低、口感差等问题。国内外大量研究表明,组织蛋白酶L是主要影响鱼糜制品凝胶特性的内源性蛋白酶之一[4-5]。比如,An等报道在太平洋牙鳕鱼糜中,组织蛋白酶L是鱼糜中残存较多和具有内肽酶活性的组织蛋白酶[4]。虽然为非肌原纤维蛋白结合蛋白酶,组织蛋白酶L活性并未能在鱼肉漂洗工艺中完全去除[6],在凝胶化过程中亦降解肌球蛋白,从而造成鱼糜凝胶劣化现象的产生。因此,本实验对影响鲤鱼组织蛋白酶L活性的冻藏条件、漂洗工艺、热处理、pH处理等因素进行了研究,同时初步探讨了不同食品组分对鲤鱼组织蛋白酶L活性的抑制作用,以期提高鲤鱼鱼糜制品的凝胶特性。
1 材料与方法
1.1 实验材料
新鲜鲤鱼 每尾重800±50g,购于杭州市朝晖农贸市场,击晕,冰鲜运至实验室。
1.2 实验方法
1.2.1 粗酶液提取 取鲤鱼背部白肌肌肉10.00g,加入已预冷的4倍体积25mmol/L乙酸钠缓冲液(含5mmol/L L-Cys,pH5.0)进行匀浆,置于4℃下提取1.5h,4℃离心(10000r/min,20min),抽滤,滤液即为鲤鱼组织蛋白酶L的粗酶提取液。
1.2.2 鲤鱼组织蛋白酶L的活性测定 组织蛋白酶L活性参照Barret方法并加以改进[7]。取250μL酶液,依次加入250μL Brij35溶液(0.1%)、250μL反应缓冲液(340mmol/L乙酸钠-60mmol/L乙酸-4mmol/L EDTA-2Na,含8mmol/L DDT,pH5.5)后,加入Z-Phe -Arg-AMC底物溶液至终浓度为5μmol/L,混匀后于40℃反应10min,终止反应,离心取上清液,利用多功能酶标仪进行测定其荧光值,所用的激发波长为360nm,发射波长为460nm。
一个酶活单位(U)定义为在反应温度(40℃)及pH6.0下,能够在1min内水解底物并释放出1nmol AMC产物的酶活性量(1nmolAMC/min)。
1.2.3 鲤鱼的冻藏实验 取鲤鱼背部白肌,切成块状(40mm×20mm×15mm),置于-20℃下冻藏,定期取样测定其组织蛋白酶L的活性。
1.2.4 鲤鱼鱼糜的制备 参考王锡昌方法制备鱼糜[8]。将鲤鱼背部肌肉搅碎,按鱼∶水为1∶8比例依次进行2次清水漂洗和0.15%盐水漂洗,对各个阶段的鱼肉分别进行取样,测定其组织蛋白酶L的活性。
1.2.5 鲤鱼组织蛋白酶L的稳定性实验 参照李树红的方法[9],对粗酶液进行酸化处理后,离心所得上清液进行40%和80%硫酸铵分级沉淀,收集沉淀,溶解、透析,所得透析液用于组织蛋白酶L的稳定性实验。
1.2.5.1 热稳定性实验 将上述处理的组织蛋白酶L酶液分别置于20、30、40、50、60、70、80℃下加热处理,每隔一定时间取样,冷却后测定其活性。
1.2.5.2 pH稳定性实验 将上述处理的组织蛋白酶L酶液分别调整pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,于20℃下处理30min后,回调pH至6.0,测定其活性。
1.2.6 组织蛋白酶L的抑制实验 取250μL酶液,依次加入250μL Brij35溶液(0.1%)、250μL反应缓冲液后,加入不同浓度的食品组分,然后加入Z-Phe -Arg-AMC(底物溶液至终浓度为5μmol/L),混匀后于40℃反应10min,终止反应,离心取上清液,利用多功能酶标仪进行测定其荧光值,所用的激发波长为360nm,发射波长为460nm。
2 结果与讨论
2.1 冻藏对鲤鱼组织蛋白酶L活性的影响
鱼类鲜水产品极易腐败变质,且其生产具有明显的季节性,产量高度集中,因此加工中常采用冻藏方式保存鱼类原料。本实验将鲤鱼置于-20℃下进行贮藏,动态检测了其组织蛋白酶L活性的变化,结果如图1所示。由图1可知,冻藏期间鲤鱼组织蛋白酶L活性呈现不断下降的趋势,经冻藏6个月后,其活性由 4.83U/g鱼肉降至 3.83U/g鱼肉,下降了20.81%,这表明了鲤鱼组织蛋白酶L在冻藏过程中具有较强的稳定性。J Shann-tzong等亦报道了相似的结果,鲭鱼鱼糜在-40℃环境中贮藏8周后,其组织蛋白酶B和L活性残存了约80%[10]。

图1 鲤鱼冻藏后组织蛋白酶L的活性变化
2.2 漂洗对鲤鱼组织蛋白酶L活性的影响
鱼糜加工过程中,一般采用2次清水漂洗和盐水漂洗方式以去除鱼肉中水溶性蛋白,从而达到提高产品弹性和白度的目的。实验考察了鲤鱼鱼糜加工中组织蛋白酶L的残存情况,结果如图2。研究发现,漂洗工艺可在一定程度上降低鱼肉中组织蛋白酶L的活性,但并不能完全去除该酶,该结果与李树红[9]等的报道相一致。经第一次清水漂洗后,鱼肉中组织蛋白酶L活性显著减少,下降了34.58%;经2次清水漂洗和0.15%盐水漂洗后,鲤鱼鱼肉中仍残存了45.65%的组织蛋白酶L。
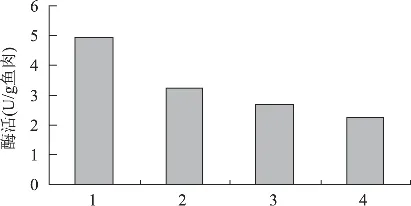
图2 漂洗对鲤鱼组织蛋白酶L的活性影响
2.3 鲤鱼组织蛋白酶L的稳定性实验
2.3.1 加热处理对鲤鱼组织蛋白酶L活性的影响已有研究表明,组织蛋白酶是一类耐热性半胱氨酸蛋白酶,在鱼糜加热胶凝过程中可能残存一定的活性,从而导致凝胶劣化的产生[11]。由图3可知,鲤鱼组织蛋白酶L具有较强的耐热性,40℃下加热处理30min和60min后,组织蛋白酶 L活性分别降至68.78%和59.69%;50℃下加热处理30min和60min后,组织蛋白酶L活性分别降至38.26%和33.97%;而加热温度大于60℃时,鲤鱼组织蛋白酶L基本失活,其活性降至4%以下。
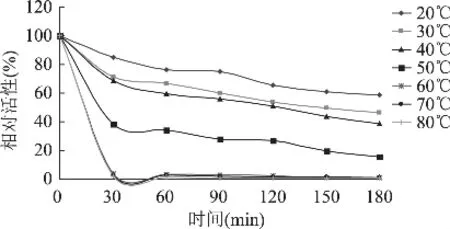
图3 鲤鱼组织蛋白酶L的热稳定性
2.3.2 pH对鲤鱼组织蛋白酶L活性的影响 本实验研究了不同pH环境下鲤鱼组织蛋白酶L活性的变化,结果如图4所示。研究表明,鲤鱼组织蛋白酶L具有较强的耐酸性,pH4.5~5.5下处理30min,其活性基本保持85%以上;pH3.0下处理30min,组织蛋白酶L仍保留了47.62%活性;当pH≥7.0后,鲤鱼组织蛋白酶L活性发生明显下降,其相对活性仅为0.62%。该结果与鲢鱼组织蛋白酶的pH稳定性相类似[12]。
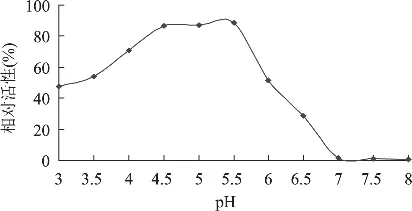
图4 鲤鱼组织蛋白酶L的pH稳定性
2.4 食品组分对鲤鱼组织蛋白酶L的抑制作用
近年来,从食品组分中筛选安全、高效的酶抑制剂已成为改善鱼糜凝胶强度的研究焦点[13-15]。实验中研究了豆科类蛋白、马铃薯蛋白、大米蛋白、鸡蛋清蛋白、大豆异黄酮和茶多酚等食品组分对鲤鱼组织蛋白酶L活性的影响,结果见图5。由图可知,5~30mg/mL豆科类、马铃薯、大米、鸡蛋清等蛋白均对鲤鱼组织蛋白酶L表现出明显的抑制作用,且呈现良好的量效关系,其中鸡蛋清蛋白对组织蛋白酶L的抑制效果最强,马铃薯蛋白次之,当蛋白质浓度为5mg/mL时,其抑制率分别为34.5%和23.6%;豆科类蛋白对鲤鱼组织蛋白酶L的抑制大小分别为:黄豆>绿豆>红豆>蚕豆。此外,大豆异黄酮和茶多酚亦显著抑制鲤鱼组织蛋白酶L活性,当添加量为2mg/mL时,其抑制率分别为49.0%和38.0%。实验结果说明,大豆异黄酮、茶多酚等双黄酮物质是潜在的、高效的组织蛋白酶L抑制物质,有待于进一步深入研究其对鱼糜胶凝的影响。
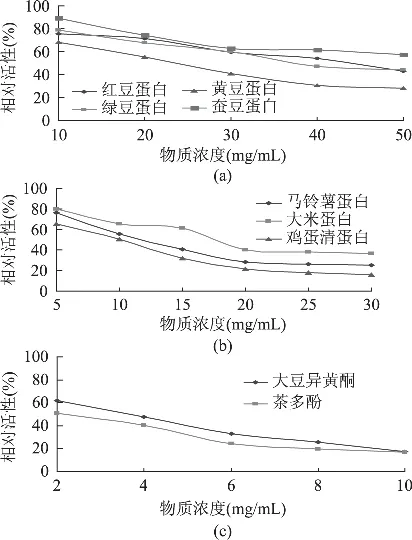
图5 不同食品组分对鲤鱼组织蛋白酶L的抑制效果
3 结论
3.1 经-20℃冻藏6个月,鲤鱼组织蛋白酶L活性下降了20.81%,这说明其在冻藏过程中具有较强的稳定性。
3.2 漂洗工艺可在一定程度上降低鱼肉中组织蛋白酶L的活性,但并不能将其完全去除,经2次清水漂洗和 0.15%盐水漂洗后,鲤鱼鱼肉中仍残存了45.65%的组织蛋白酶L。
3.3 鲤鱼组织蛋白酶L具有较强的热稳定性和酸稳定性。20~50℃下加热处理下和pH≤7.0酸性环境中,鲤鱼组织蛋白酶L仍保留了一定的活性。
3.4 豆科类、马铃薯、大米、鸡蛋清等蛋白均对鲤鱼组织蛋白酶L表现出明显的抑制作用。大豆异黄酮和茶多酚亦显著抑制鲤鱼组织蛋白酶L活性,有待于进一步深入研究上述食品组分对鱼糜凝胶特性的影响。
[1]王立斌.鲤鱼的养殖与经济价值[J].商场现代化,2008,556(31):328.
[2]汪之和.水产品加工与利用[M].北京:化学工艺出版社,2002.
[3]潘世玲.鲤、草、鲢、鳙加工冷冻生鱼糜的特性研究[D].中国农业大学,2003.
[4]An Haejung,S Thomas A,W Junwen,et al.Assay systems and characterization of Pacific whiting protease[J].Journal of Food Science,1994,59(2):277-281.
[5]L Huan,Y Lijun,Z Nan,et al.Isolation of cathepsin B from the muscle of silver carp(Hypophthalmichthys molitrix)and comparison of cathepsins B and L actions on surimi gel softening.[J].Food Chemistry,2008,110(2):310-318.
[6]L Huan,Y Lijun,L Shuhong,et al.Effects of Endogenous Cathepsins B And L on Degradation Of Silver Carp(Hypophthalmichthys Molitrix)Myofibrillar Proteins[J].Journal of Muscle Foods,2008(19):125-139.
[7]J Alan Barret,Heidrun Kirschke.Cathepsin B,Cathepsin H and Cathepsin L[J].Methods in Enzymol,1981,80:535-560.
[8]王锡昌,汪之和.鱼糜制品加工技术[M].北京:中国轻工业出版社,1997.
[9]李树红,张楠,刘欢,等.鲢鱼背肌肌原纤维蛋白自溶与内源组织蛋白酶B,L与H的关系[J].中国农业大学学报,2004,9(5):71-75.
[10]J Shann-tzong,L Bai-lin,T Ching-yu.Mackerel Cathepsins B and L Effects on Thermal Degradation of Surimi[J].Food Science,1997,62(2):310-315.
[11]JL Cardenas-Lopez,NF Haard.Identification of a cysteine proteinase from Jumbo squid(Dosidicus gigas)hepatopancreas as cathepsin L[J].Food Chemistry,2009,112:442-447.
[12]李树红.鲢鱼背肌组织蛋白酶B、L的纯化鉴定及水解肌球蛋白的研究[D].中国农业大学,2004.
[13]S Benjakul,W Visessanguan,H An.Properties of cysteine proteinase inhibitors from black gram and rice bean[J].Journal of Food Biochemistry,2001,25(3):211-227.
[14]江善宗.生物技术在水产食品加工上之应用[J].福州大学学报,2002,30(21):672-685.
[15]李德昆.蛋白酶抑制剂的制备及其抑制狭鳕鱼糜凝胶劣化的研究[D].中国海洋大学,2008.
Study on influence factors of cathepsin L in common carp
HOU Lu-na,CHEN Xue-yun,NIE Xiao-hua*,LIU Lin
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
The influence factors of cathepsin L in common carp were studied.From the results,cathepsin L in common carp exhibited strong stability and kept certain activities during the process of-20℃ frozen,20~50℃heating and acid treatment.Cathepsin L in common carp still reserved 45.65%activity after washing process. Meanwhile,cathepsin L in common carp were obviously inhibited by bean proteins,rice protein,egg protein,potato protein,polyphenols and soy isoflavones in a dose-dependent manner.
common carp;cathepsin L;influence factors
TS254.1
A
1002-0306(2010)11-0075-03
2010-03-11 *通讯联系人
侯鲁娜(1983-),女,硕士研究生,主要从事食品生物技术方面的研究。
国家863项目(2007AA09Z442);浙江省自然科技项目基金(Y307132)。

