蚕蛹油对高脂膳食大鼠血脂及脂代谢相关酶的影响
胡金鹿,陈伟平,卓玛丽
(1.浙江大学医学院营养与食品卫生研究所,浙江杭州310058;2.浙江大学城市学院医学与生命科学学院,浙江杭州310015)
蚕蛹油对高脂膳食大鼠血脂及脂代谢相关酶的影响
胡金鹿1,陈伟平2,*,卓玛丽2
(1.浙江大学医学院营养与食品卫生研究所,浙江杭州310058;2.浙江大学城市学院医学与生命科学学院,浙江杭州310015)
目的:研究蚕蛹油对高脂膳食大鼠血脂及脂代谢相关酶的影响。方法:SD大鼠60只,雄性,按体重并参考血脂水平随机分为6组:正常对照组,高脂对照组,阳性对照组(紫苏籽油),预防低、中、高剂量组。适应期后分别喂养对应饲料,每两周检测血液中甘油三酯(TG)、总胆固醇(TCH)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、卵磷脂胆固醇转移酶(LCAT)、脂蛋白脂酶(LPL)、肝脂酶(HL)水平,第四周处死后,检测肝中脂蛋白脂酶(LPL)、肝脂酶(HL)水平。结果:预防组的血脂(TG、TCH)、血脂蛋白(HDL、LDL)、LCAT及总酯酶水平与高脂对照组相比均具有显著性差异(P<0.05),并具有剂量依赖性,且相应酶的变化早于血脂和血蛋白的变化。结论:蚕蛹油可以通过激活脂代谢相关酶,调整血清中血脂和脂蛋白的含量,从而达到预防高脂血症的目的。
蚕蛹油,不饱和脂肪酸,脂代谢酶
高脂血症的主要危害是导致动脉粥样硬化,进而导致众多的相关疾病,其中最常见的一种致命性疾病就是冠心病。高脂血症对身体的损害是隐匿、逐渐、进行性和全身性的。它的直接损害是加速全身动脉粥样硬化,因为全身的重要器官都要依靠动脉供血、供氧,一旦动脉被粥样斑块堵塞,就会导致严重后果。此外,高脂血症也是增加高血压、糖耐量异常、糖尿病发病率的一个重要危险因素。高脂血症还可导致脂肪肝、肝硬化、胆石症、胰腺炎、眼底出血、失明、周围血管疾病、跛行、高尿酸血症等。有些原发性和家族性高脂血症患者还可出现腱状、结节状、掌平面及眼眶周围黄色瘤、青年角膜弓等[1]。现代研究表明高脂膳食会引起肝脏总脂解酶、脂蛋白脂酶和肝脂酶活性的降低,造成代谢紊乱,引发高脂血症[2]。LCAT,LPL,HL都是调节脂蛋白代谢的关键酶,在脂质代谢中发挥重要作用。已有实验表明,蚕蛹油具有十分显著的预防和治疗非酒精性脂肪肝形成的效果[3],但目前其机理并不明确,本实验研究蚕蛹油对高脂膳食大鼠血脂及脂代谢相关酶的影响,旨在探讨蚕蛹油调节脂代谢的机理问题。
表1 蚕蛹油对高脂膳食大鼠血脂及脂蛋白的影响(±s)
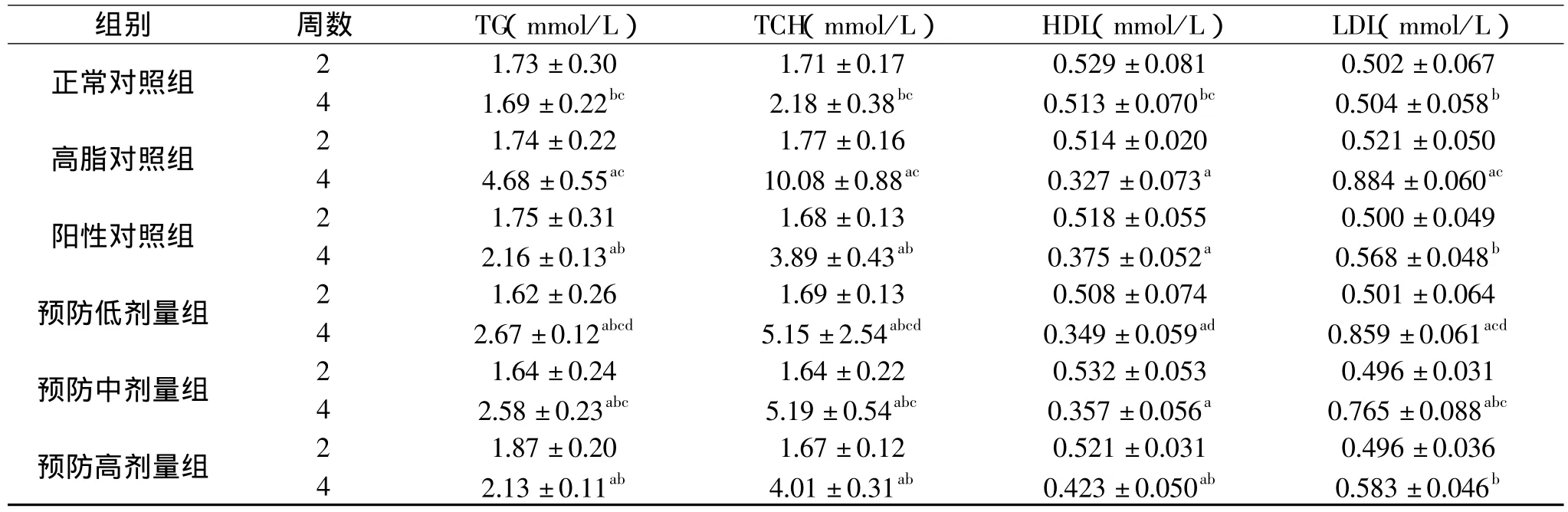
表1 蚕蛹油对高脂膳食大鼠血脂及脂蛋白的影响(±s)
注:统计分析:P<0.05;a:与正常组比有统计学意义;b:与高脂组比有统计学意义;c:与阳性组比有统计学意义;d:三个预防剂量组剂量依赖性比较有统计学意义。表2、表3同。
组别 周数 TG(mmol/L) TCH(mmol/L) HDL(mmol/L) LDL(mmol/L)正常对照组 2 1.73±0.30 1.71±0.17 0.529±0.081 0.502±0.067 4 1.69±0.22bc 2.18±0.38bc 0.513±0.070bc 0.504±0.058b高脂对照组 2 1.74±0.22 1.77±0.16 0.514±0.020 0.521±0.050 4 2.16±0.13ab 3.89±0.43ab 0.375±0.052a 0.568±0.048b预防低剂量组 2 1.62±0.26 1.69±0.13 0.508±0.074 0.501±0.064 4 4.68±0.55ac 10.08±0.88ac 0.327±0.073a 0.884±0.060ac阳性对照组 2 1.75±0.31 1.68±0.13 0.518±0.055 0.500±0.049 4 2.67±0.12abcd 5.15±2.54abcd 0.349±0.059ad 0.859±0.061acd预防中剂量组 2 1.64±0.24 1.64±0.22 0.532±0.053 0.496±0.031 4 2.58±0.23abc 5.19±0.54abc 0.357±0.056a 0.765±0.088abc预防高剂量组 2 1.87±0.20 1.67±0.12 0.521±0.031 0.496±0.036 4 2.13±0.11ab 4.01±0.31ab 0.423±0.050ab 0.583±0.046b
1 材料和方法
1.1 材料与仪器
雄性SD大鼠(150±10g)、普通饲料 购于浙江省实验动物中心;高脂饲料 胆固醇1%,蛋黄粉10%,猪油10%,普通饲料79%[4];蚕蛹油 由作者实验室研制;阳性对照物(紫苏油软胶囊) 购于五台山沙棘制品有限公司;TG、TCH、HDL、LDL、总酯酶测定试剂盒 购于南京建成生物技术公司;FC测定试剂盒 购于sigma公司。
FW135粉碎机 天津市泰斯特仪器公司;MEI-03L微波萃取仪 无锡普莱玛仪器设备有限公司;RE-2000旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 饲喂动物及设计 取SD大鼠60只,随机分为6组,即正常对照组,高脂对照组,阳性对照组,预防高剂量组,预防中剂量组,预防低剂量组,每组10只,适应期1周后,空白对照组仍喂食普通饲料,以3mL/kg水灌胃;模型对照组喂饲高脂饲料,以3mL/kg水灌胃;紫苏对照组喂饲高脂饲料,以3mL/kg剂量紫苏油灌胃;预防高、中、低剂量组喂饲高脂饲料,分别以1.5、3、4.5mL/kg剂量蚕蛹油灌胃。高脂喂食两星期后,清晨空腹(隔夜忌食高脂),尾部采血约3mL,3000r/min离心15min,取血清进行测定甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、卵磷脂胆固醇酰基转移酶、脂蛋白酯酶和肝酯酶的活性。高脂喂食四星期后,尾部采血约3mL,处死,取肝脏适量做匀浆,测定肝脏中总酯酶及LCAT含量,血液样本部分的测定指标同第二周。
1.2.2 血清和肝脏中TG、TCH、HDL、LDL、HP、LPL测定 均按试剂盒说明书进行。
1.2.3 血清和肝脏中LCAT的测定 参照蒋宪成等的方法[5]:利用血清中原有卵磷脂与胆固醇作底物,保温处理一段时间,由于LCAT作用,导致血清中胆固醇酯增加,游离胆固醇减少。利用胆固醇氧化酶处理血清,游离胆固醇发生氧化,同时产生H2O2,后者与4-氨基比林及苯酚在辣根过氧化酶作用下生成红色醌亚胺,在500nm波长处测定游离胆固醇(FC)含量,以FC的减少量(即胆固醇酯化量)表示LCAT活性大小。
1.2.4 数据处理 采用SPSS15.0进行单因素方差分析,若具有统计学意义(P<0.05),则采用LSD分析后检验进行统计分析;三个预防剂量组的比较用有序分组资料线性趋势检验,检验水准均为α=0.05。
2 结果与分析
2.1 蚕蛹油对血脂及脂蛋白的影响
表1结果显示,高脂喂食两周后,与正常对照组相比,高脂对照组TG、TCH、HDL、LDL水平的差异均无统计学意义。与阳性对照组相对,各实验组TG、TCH、HDL、LDL水平的差异也均无统计学意义。三个预防剂量组之间各指标差异均无统计学意义。高脂喂食四周后,与正常对照组相比,阳性对照组TG、TCH、HDL水平的差异均具有统计学意义(P<0.05),与阳性对照组相比,各实验组TG、TCH、HDL、LDL水平的差异也均具有统计学意义(P<0.05),三个预防剂量组之间各指标差异比较均有统计学意义(P<0.05)。
2.2 蚕蛹油对血清中LCAT、HL、LPL的影响
表2结果显示,高脂喂食两周后,与正常对照组相比,高脂对照组LCAT、HL、LPL水平的降低均有统计学意义(P<0.05),与高脂对照组相比,阳性对照组、预防高剂量和预防中剂量组的LCAT水平的升高有统计学意义(P<0.05),三个预防剂量组比较时,LCAT、HL升高有统计学意义(P<0.05)。四周后,与正常对照组相比,高脂对照组LCAT、HL、LPL水平的降低均有统计学意义(P<0.05),与高脂对照组相比,除LCAT的预防低剂量组、HL的预防低剂量组和预防中剂量组、LPL的阳性对照组、预防低剂量组外,其它各实验组相应指标水平的升高均有统计学意义(P<0.05),三个预防剂量组比较时,LCAT、HL、LPL升高均有统计学意义(P<0.05)。
2.3 蚕蛹油对肝脏中HL、LPL的影响
表2 蚕蛹油对高脂膳食大鼠血清中LCAT、HL、LPL的影响(±s)
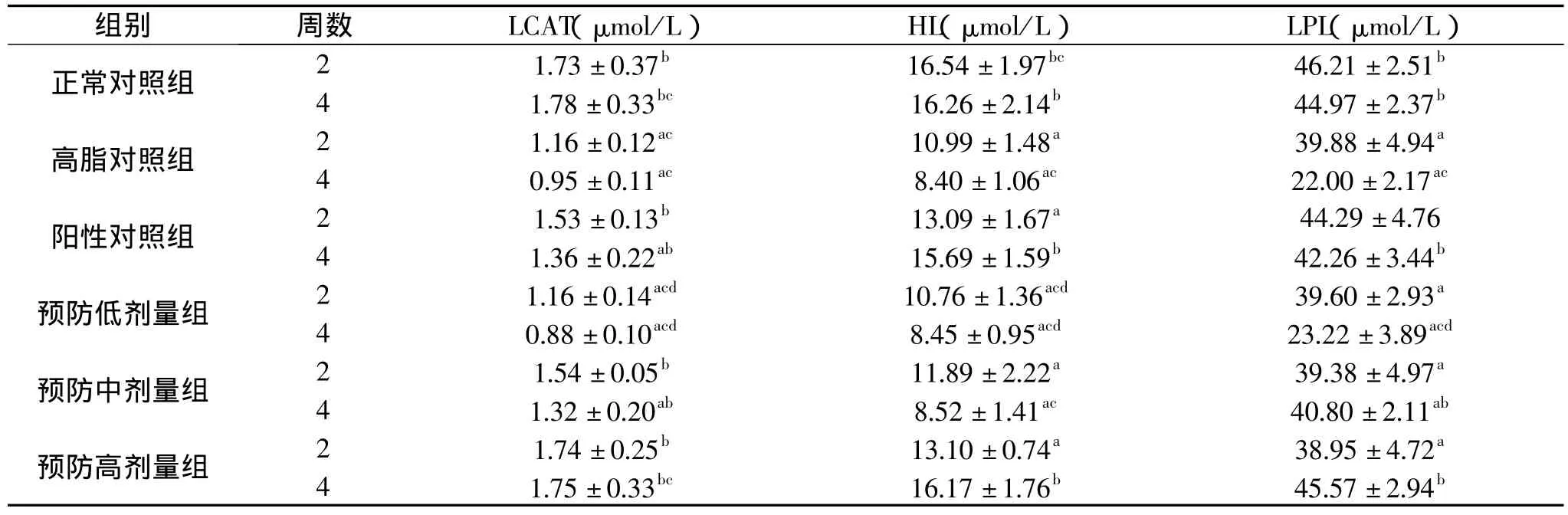
表2 蚕蛹油对高脂膳食大鼠血清中LCAT、HL、LPL的影响(±s)
组别 周数 LCAT(μmol/L) HL(μmol/L) LPL(μmol/L)正常对照组 2 1.73±0.37b 16.54±1.97bc 46.21±2.51b 4 1.78±0.33bc 16.26±2.14b 44.97±2.37b高脂对照组 2 1.16±0.12ac 10.99±1.48a 39.88±4.94a 4 1.36±0.22ab 15.69±1.59b 42.26±3.44b预防低剂量组 2 1.16±0.14acd 10.76±1.36acd 39.60±2.93a 4 0.95±0.11ac 8.40±1.06ac 22.00±2.17ac阳性对照组 2 1.53±0.13b 13.09±1.67a 44.29±4.76 4 0.88±0.10acd 8.45±0.95acd 23.22±3.89acd预防中剂量组 2 1.54±0.05b 11.89±2.22a 39.38±4.97a 4 1.32±0.20ab 8.52±1.41ac 40.80±2.11ab预防高剂量组 2 1.74±0.25b 13.10±0.74a 38.95±4.72a 4 1.75±0.33bc 16.17±1.76b 45.57±2.94b
表3结果显示,与正常对照组相比,高脂对照组中肝脏HL、LPL水平的降低均有统计学意义。与高脂对照组相比,除LPL预防低剂量组外,其它各剂量组HL、LPL水平的升高均有统计学意义(P<0.05),三个预防剂量组比较时,HL、LPL水平的升高均有统计学意义(P<0.05)。
表3 蚕蛹油对高脂膳食大鼠肝脏中HL、LPL的影响(±s)

表3 蚕蛹油对高脂膳食大鼠肝脏中HL、LPL的影响(±s)
组别 HL(μmol/g) LPL(μmol/g)正常对照组 39.36±2.94b 53.98±3.74b高脂对照组 21.65±3.03ac 37.15±5.77ac阳性对照组 35.93±2.98b 55.28±4.23b预防低剂量组 28.87±4.34abcd 39.32±3.45acd预防中剂量组 28.21±3.40abc 50.36±3.70b预防高剂量组 37.21±2.86b 55.53±5.12b
3 讨论
随着人类生活水平的提高,人类膳食由以植物性食物为主逐渐转变为以动物性食物为主,人们获取丰富营养的同时也引发了一系列营养过剩的问题。由于高脂食物频繁摄入而导致的高脂血症等相关疾病已成为当代重要疾病。据报道,我国人群近20年来血脂水平明显异常,中年人群中高胆固醇血症患病率已超过10%,近年来更是逼近15%;而血脂异常与动脉粥样硬化呈正相关,与动脉粥样硬化有关疾病造成的死亡率达到35%~40%,是我国目前第一位死亡原因,冠心病发生率与死亡率随血胆固醇水平增高而增加[6]。近年来的研究表明,富含α-亚麻酸的植物油在预防动脉硬化发生方面起着重要的作用[7],其主要是通过影响甘油三酯的水平,进而调节血脂水平。蚕蛹油中含有丰富的不饱和脂肪酸,其含量在80%左右,其中 ω-3多不饱和脂肪酸(PUFA)的含量可以达到40%左右。而α-亚麻酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)同属ω-3PUFA家族[8]。而且,从古至今我国就是一个养蚕大国。建国以来,仅蚕丝产品就为我国累计创汇300亿美元,蚕丝业是我国传统的创汇支柱产业[9]。蚕蛹是缫丝工业的主要副产物,每生产1t生丝可得1t蚕蛹,据资料报道,我国近几年生丝年产量约有53万t,同时相应产生了53万t蚕蛹[10]。这是极其丰富而宝贵的资源,值得进一步开发利用。蚕蛹油是在蚕蛹制作蚕蛹粉的过程中进行分离提炼的,已有研究表明,蚕蛹油在食品、医药、轻工业上的应用价值都得到了一定的证实[11-13],由此可见蚕蛹油的应用不容忽视。
本实验主要研究蚕蛹油对脂代谢相关酶的影响,意在探索蚕蛹油调节脂代谢的作用机制。在血浆脂蛋白代谢过程中,有许多脂酶起着很重要的作用。主要包括脂蛋白脂酶(LPL)、肝脏甘油三酯酶(HTGL)、肝脂酶(HL)和卵磷脂胆固醇酰基转移酶(LCAT)。LPL和HL可催化乳糜微粒(CM)和促进极低密度脂蛋白(VLDL)中的甘油三酯水解。LCAT催化新生高密度脂蛋白(HDL)表面的游离胆固醇酯化,使HDL表面游离胆固醇酯化转入核心部位,使体积小、圆盘状的高密度脂蛋白胆固醇(HDL-C)逐渐转化为体积更大的HDL-C,HDL就这样转运消除酯化胆固醇[14]。以上说明脂代谢酶的活性与血脂水平紧密相关,而且已有研究表明,LCAT、LPL、HL都是调节脂蛋白代谢的关键酶,在脂质代谢中发挥重要作用[15]。
本实验结果表明,与正常对照组相比,高脂喂食两周后,TG、TCH、HDL、LDL水平均无明显改变,而在酶水平上,LCAT、HL均有所改变;高脂喂食四周后,与高脂对照组相比,蚕蛹油能显著降低高脂膳食大鼠血清中TG、TCH、LDL的含量,提高HDL、LCAT的含量,还能显著提高高脂膳食性大鼠血清和肝脏中LPL、HL的水平,脂代谢酶的改变早于血脂和血脂蛋白的改变,初步说明了蚕蛹油调节TG、TCH、HDL和LDL的机制,即通过激活脂代谢酶LCAT、HL、LPL而达到降低TG、TCH、LDL,提高HDL水平的目的,也进一步验证了脂代谢酶活性与血脂水平紧密相关。与阳性(紫苏)对照组相比,蚕蛹油组降低血脂的效果优于紫苏油组,而且蚕蛹油三个预防剂量组间相比较,高剂量组激活脂代谢酶,降低血脂和LDL、提高HDL效果优于中、低剂量组,提示蚕蛹油预防高脂血症效果有剂量依赖性。由此可见,蚕蛹油在高脂血症的防治中有着较好的应用前景,值得对其进一步的开发利用。
[1]吴晓泉.治疗高脂血症药物的研究进展[J].药品评价,2005,2(3):227-229.
[2]赵清,舒为群,高京生.饮用纯净水对大鼠脂质代谢酶及载脂蛋白的影响[J].第四军医大学学报,2004,25(10):945-947.
[3]何自立,陈伟平,单巍.蚕蛹油对大鼠非酒精性脂肪肝形成的影响[J].中国微生态学杂志,2007,19(6):483-485.
[4]刘明,董超仁,苏静怡.一种简易大鼠高脂血症模型[J].中国药理学通报,1989,5(2):119.
[5]蒋宪成,庄庆祺,梅美珍.卵磷脂胆固醇酰基转移酶活性的简易测定法[J].上海第一医学院学报,1985,12(2):259.
[6]唐春萍,郭姣,杨超燕,等.调脂灵对高脂血症大鼠脂代谢酶及载脂蛋白的影响[J].广东药学院学报,2007,23(2):175 -177.
[7]Balk EM,Liehtenstein AH,Orang M,et al.Efects of omega-3 fatty acid on caronary restenosis,intinm-media thickness,and exercise tolerance:asystematic review[J].Atherosclerosis,2006,84(1):237-241.
[8]杨雪锋,黄连珍,胡建平,等.桑蚕蛹油对大鼠脂质代谢的影响[J].营养学报,2002,24(3):233-236.
[9]夏未铭.我国蚕蛹综合开发现状与前景[J].中国蚕业,2003,24(1):12.
[10]王风琴.蚕蛹的综合利用[J].淮阴工学院学报,2002,11(1):48-50.
[11]yuanshanghan.昆虫食品将成为第三大蛋白源[EB/0L]. 2007-O8-14.http://blog.163.com/yuanshanghan@126/blog/ static/31 l8956720o77l463627228/.
[12]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1986:17-62.
[13]中国食品产业网.蚕蛹的综合开发利用[EB/OL].2006-09-01.http://www.foodqs.com/news/.
[14]赵水平,王钟林,陆宗泉.临床血脂学[M].长沙:湖南科学技术出版社,1997:81.
[15]苏慧,李兰荪,贾国良.LPL基因多态性与血浆TG水平及冠脉病变严重度的关系[J].第四军医大学学报,2001,22(21):1992-1995.
Effect of chrysalis oil on plasma lipids and lipid-metabolize-enzyme level of high-fat-diet rats
HU Jin-lu1,CHEN Wei-ping2,*,ZHUO Ma-li2
(1.Medicine College,Zhejiang University,Hangzhou 310058,China;2.Medicine and Lifescience College,Zhejiang University City College,Hangzhou 310015,China)
Objective:To observe the effect of the chrysalis oil on the plasma lipid and enzyme level in the high-fatdiet rats.Methods:A total of 60 male SD rats were equally randomized into 6 group by weight:normal control group,high-fat control group,positive control group,low,medium and high dose preventive group,and feeding them corresponded feedstuff.Then TG,TCH,HDL,LDL,LCAT,HL,LPL level in the blood were observed every two week.The rats were killed in the fourth week to observe LPL,HL level in the liver.Results:The plasma lipids(TG、TCH)and lipoprotein(HDL、LDL),LCAT,LPL and HL level of the rats in the preventive control groups were significantly difference to that in the high-fat-diet control group(P<0.05),and also having dose dependence.The change of the enzyme level was earlier than the lipid and lipoprotein level.Conclusion:The schrysalis oil can regulate the plasma lipids and lipoprotein level in the blood by activated the correlated lipid-metabolizedenzyme,thereby to prevent the hyperlipidemia.
chrysalis oil;polyunsaturated fatty acids;lipid-metabolize-enzyme
TS225.2
A
1002-0306(2010)11-0343-04
2009-11-24 *通讯联系人
胡金鹿(1983-),女,在读硕士研究生,研究方向:营养与食品卫生学。
杭州市科技局科技创新项目(2006831H05)。

