气相色谱-质谱联用测定母乳中合成麝香*
梁高锋 王 珺 周 静 张晓岚** 盛国英,2 傅家谟,2
(1 上海大学环境与化学工程学院,环境污染与健康研究所,上海,200444;2 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广州,510640;3 上海市青浦区环境监测站,上海,201700)
气相色谱-质谱联用测定母乳中合成麝香*
梁高锋1,3王 珺1周 静1张晓岚1**盛国英1,2傅家谟1,2
(1 上海大学环境与化学工程学院,环境污染与健康研究所,上海,200444;2 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广州,510640;3 上海市青浦区环境监测站,上海,201700)
建立了凝胶渗透色谱 (GPC)柱和硅胶柱净化,气相色谱-质谱 (GC/MS)测定母乳中合成麝香的分析方法.实验结果表明:GC/MS在 0.01μg·ml-1到 1μg·ml-1的浓度范围内对 4种常见合成麝香 (佳乐麝香HHCB、吐纳麝香AHTN、二甲苯麝香MX和酮麝香MK)均有良好的线性响应,4种合成麝香的基质加标回收率为 76%—115%,相对标准偏差为 2.8%—7.4%.利用信噪比 (5/1)确定该方法的定性检测限,HHCB,AHTN,MX为 5 ng·g-1脂重,MK为 4 ng·g-1脂重,定量检测限为定性检测限的 2倍.采用上述方法分析了上海母乳样品中合成麝香的浓度和分布特征,发现母乳中普遍存在这 4种合成麝香,浓度分别为 HHCB 92±70;AHTN 16±12;MX 26±22;MK 16±14 ng·g-1脂重,与欧美国家的污染水平相比,总体含量偏低.
合成麝香,母乳,GC/MS.
药物和个人护理用品 (PPCPs)是一类受到国际广泛关注的新型环境有机污染物[1],合成麝香(SyntheticMusks)是 PPCPs中疏水性化合物的主要代表之一,它们作为天然麝香的替代品被广泛应用于护肤品、化妆品、洗涤用品及食品、烟草、药物中,在各类环境介质中普遍分布而且浓度逐年递增[2].合成麝香对人体的主要暴露途径是皮肤接触.持续性地接触使用,合成麝香能在人体组织 (如脂肪、母乳)中富集.加香类产品中常用的合成麝香包括佳乐麝香 (HHCB)、吐纳麝香 (AHTN)、酮麝香 (MK)和二甲苯麝香 (MX).
合成麝香具有一定的毒理效应,还能降低生物体对有毒物质的自然抵抗能力[2—4].近年来一些研究表明:母乳中普遍存在合成麝香,部分地区 HHCB含量有逐年增加的趋势[5,6].母乳中的污染物水平不仅能反映母亲的暴露程度,也能反映婴儿受到的早期暴露影响,因此母乳中合成麝香的污染状况受到了普遍关注[7—10].我国是合成麝香的生产和使用大国,但对于合成麝香在人体中的分布情况还未见报导.
本文建立了测定母乳中合成麝香的方法:通过液-液萃取提取母乳脂肪,经凝胶渗透色谱 (GPC)和硅胶柱净化处理后,气相色谱-质谱 (GC/MS)分析;还对该方法的实验条件和加标回收率等进行了优化和考察,并对实际样品进行了分析.
1 实验部分
1.1 试剂
标样 HHCB和AHTN购自德国 Promochem公司,纯度分别为 75%和 99%,d10-菲,MX,MK购自德国Dr.Ehrenstorfer公司,纯度为 99%,99%,98%.二氯甲烷,正己烷,乙醚,无水乙醇均为分析纯,二氯甲烷和正己烷经重蒸后使用;无水硫酸钠,经 420℃高温灼烧 4h处理.硅胶 (100—200目)经二氯甲烷索式抽提 72h后,180℃高温灼烧 12h,加 3%二次蒸馏水进行去活化处理.凝胶色谱柱 (自填,填料为 30 g Bio-beads S-X3);硅胶柱 (自填,填料为 3%去活化硅胶 3g).
1.2 样品预处理
室温下解冻取 5—10 ml置于分液漏斗中,加回收率指示物 d10-菲后加入 8 mL 8%的草酸钾溶液、10 ml无水乙醇和 5 ml乙醚振摇;用 40 ml正己烷分 3次萃取;收集合并有机相后浓缩、柔和氮吹至近干,干燥器中恒重 2d后称量法测定乳脂重量.
用少量二氯甲烷:正己烷 (1∶1,V/V)重新溶解乳脂,加入 GPC柱中,以二氯甲烷∶正己烷 (1∶1,V/V)作为淋洗液淋洗,收集 65—165 ml淋洗液,浓缩后硅胶柱净化,用 15 ml正己烷和 30 ml二氯甲烷依次淋洗,收集二氯甲烷淋洗液,浓缩并柔和氮吹,加内标六甲基苯后定容,上机分析.
1.3 气相色谱和质谱条件
Agilent 6890 GC和 5975 MSD;HP-5MS毛细管柱 (30m ×0.25mm ×0.25μm);载气为氮气,载气流速为 1.0 ml·min-1,无分流进样,进样量 1μl;进样口温度 290℃;柱始温 100℃,保持 1 min,7℃·min-1升至 160℃,3℃·min-1升至 180℃,1℃·min-1升至 190℃,10℃·min-1升至 280℃.
EI源;离子源温度 200℃,进样口温度 280℃;选择性离子扫描模式(S IM),目标化合物以保留时间和特征离子定性.定性特征离子 (m/z)为:HHCB 243,258,213;AHTN 243,258,159;MK 279,294;MX 282,297;d10-菲 188;六甲基苯 147,162;定量特征离子为 HHCB 243;AHTN 243;MK 279;MX 282;d10-菲188.
2 结果和讨论
2.1 GPC淋洗液和硅胶柱淋洗液的确定
选用正己烷 ∶二氯甲烷 (1∶1,V/V)混合液作为 GPC淋洗液,分析脂肪和 MX,MK,AHTN,HHCB的流出曲线,淋洗液中MX,MK,AHTN和 HHCB的浓度经 GC/MS分析后确定.实验发现在0—65 ml中脂类大分子被淋洗出来,而MX,MK,AHTN和 HHCB的流出在 65 ml以后,且主要集中在 65—165 ml共 100 ml的组分中.经多次测定,确定 GPC柱的淋洗液用量为 165 ml,搜集后 100 ml淋洗液,该流程目标化合物的回收率在 82%—113%之间.参考相关文献的条件[11],选择正己烷和二氯甲烷作为硅胶柱的淋洗液,经条件实验确定最终用量为 15 ml正己烷和 30 ml二氯甲烷,合成麝香组分在二氯甲烷淋洗液中.该流程目标化合物的回收率在 86%—108%之间.
2.2 色谱响应图
在上述仪器条件下得到主要合成麝香标样的气相色谱图 (图1),由图1可见,HHCB,MX,AHTN,MK和 d10-菲得到较好分离,出峰时间分别为 17.18,17.49,17.63,21.34,15.49 min;MX和AHTN的色谱峰有部分重叠,但选用不同的检测离子后可以基本分开.母乳样品中的合成麝香也能分别检测.该方法在 0.01—1μg·ml-1的浓度范围内对 HHCB,AHTN,MX和MK均有良好的线性响应.
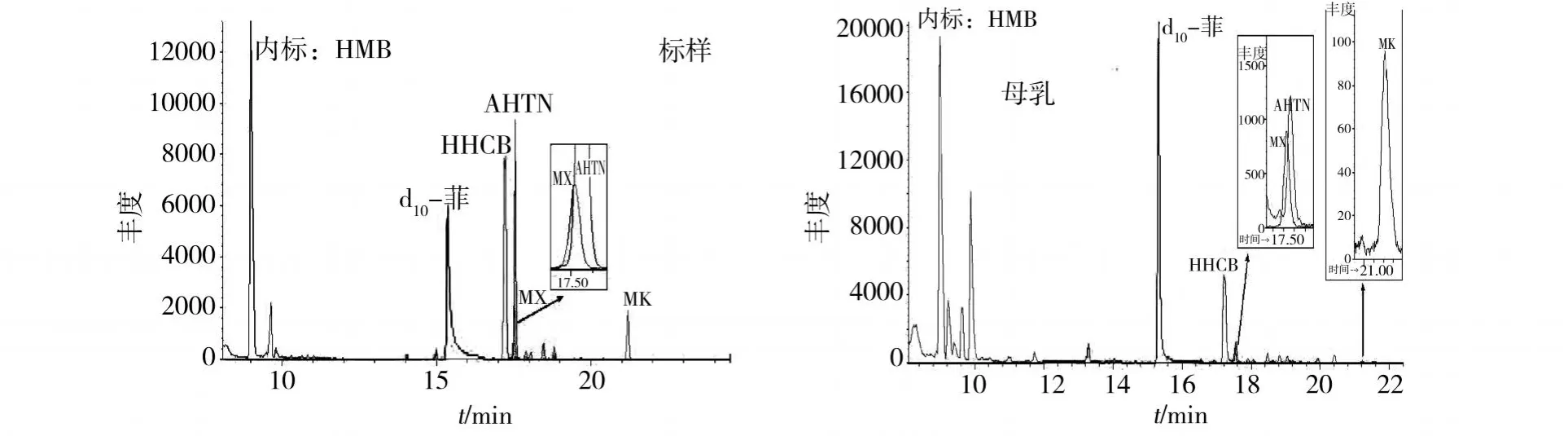
图1 S IM条件下标样和母乳的色谱图Fig.1 Chromatogram of standard samples and human milk samples under selected ion monitoringmode(S IM)
2.3 检测限和加标回收率
检测限以信噪比 5/1来计算,HHCB,AHTN,MX和MK的方法检测限 (LOD)分别为 5,5,5,4 ng·g-1脂重;定量检测限 (LOQ)定为 2倍 LOD.在较清洁母乳中分别加入高,中,低 3种浓度的合成麝香标样,进行基质加标实验,测定合成麝香浓度,计算加标回收率 (表1).加标实验的标样回收率范围在 76%—115%之间,平均回收率分别为 HHCB 90.4%,AHTN 89.8%,MX 100.4%,MK 94.8%,相对标准偏差为 2.8%—7.4%.d10-菲的回收率为 82%—115%,该方法达到分析的要求.

表1 加标回收率实验Table 1 The recoveries of spiked samples
2.4 实际样品的检测
对从上海某医院收集的 10份母乳进行分析,d10-菲的回收率在 81%—113%之间.分析结果表明母乳中普遍存在合成麝香,HHCB,AHTN,MX和MK的检出率分别为 100%,70%,80%和 60%.HHCB,AHTN,MX和MK的浓度范围分别为 20—262 ng·g-1脂重 (均值:92,中值:75), 与国外母乳中合成麝香浓度相比[6,10,11],本次检测的样品中合成麝香总体含量相对偏低 (图2).由于此次检测的母乳样品较少(n=10),不具有统计比较意义.在分布特征上,本次检测的样品中合成麝香浓度为HHCB>MX>AHTN>MK,变化趋势与 1999年丹麦的母乳样本相似,与美国的 2004年样本不同.上海地区母乳中大量存在的MX需要引起注意.2008年欧洲化学品管理署成员国委员会通过的首批 15种 “高关注物质”中包括MX;由于MX的生物富集作用和潜在致癌性效应,一些国家在日化产品中已禁止或限制使用MX;MX的亲脂性比MK大,在相同的暴露水平下MX更容易积累在人体内,对人体产生影响. 利用 GPC柱去除乳脂,再经硅胶短柱净化,通过气相色谱和质谱的联用技术,内标法定量分析了母乳中 4种常用的合成麝香.方法分析灵敏度高,具有良好的线性、精密度和准确度,适用于母乳中合成麝香的分析.利用该方法对实际母乳样品进行检测分析,结果表明本次采集的母乳中普遍存在合成麝香,污染物主要以多环的 HHCB为主,但MX也有较高浓度的存在;跟国外的报道相比,所检测的母乳中合成麝香的总体浓度相对偏低. [1] MatamorosV,Bayona J M,Elimination of Phar maceuticals and Personal Care Products in Subsurface Flow ConstructedWetlands[J].Environ.Sci.Technol.,2006,40∶5811—5816 [2] Sommer C,The Role ofMusk Compounds in the Fragrance Industry[M].The Handbook of Environmental Chem istry,2004,3 part X∶1—16 [3] Bitsch N,DudasC,KornerW et al.,Estrogenic Activity ofMusk FragrancesDetected by the E-screenAssayUsing HumanMCF-7 Cells[J].Arch.Environ.Con.Tox.,2002,43∶257—264 [4] Riedel J,DekantW,Biotransformation and Toxicokinetics ofMusk Xylene in Humans[J].Toxicol.Appl.Phar macol.,1999,157∶145—155 [5] Kannan K,Reiner J L,Yun S H et al.,PolycyclicMusk Compounds in Higher Trophic LevelAquatic Organis ms and Humans from the United States[J].Chemosphere,2005,61∶693—700 [6] Reiner J L,WongCM,Arcaro K F et al.,SyntheticMusk Fregrances in HumanBreastMilk from theUnited States[J].Environ.Sci.Technol.,2007,41∶3815—3820 [7] Raab U,Preiss U,AlbrechtM,Shahin N et al.,Concentrations of Polybrominated Diphenyl Ethers,Organochlorine Compounds and NitroMusks inMother’sMilk from Ger many(Bavaria)[J].Chemosphere,2008,72∶87—94 [8] Hutter H P,Wallner P,Moshammer H et al.,Blood Concentrations of PolycyclicMusks in Healthy YoungAdults[J].Chemosphere,2005,59∶487—492 [9] Lignell S,Darnerud PO,AuneM et al.,Temporal Trendsof SyntheticMusk Compounds inMother’sMilk andAssociationswith Personal Use of Perfumed Products[J].Environ.Sci.Technol.,2008,42∶6743—6748 [10] Rimkus G G,WolfM,PolycyclicMusk Fragrances in HumanAdipose Tissue and HumanMilk[J].Chemosphere,1996,33∶2033—2043 [11] Duedahl-Olesen L,Cederberg T,Pedersen K H et al.,Synthetic Musk Fragrances in Trout from Danish Fish Far ms and Human Milk[J].Chemosphere,2005,61∶422—431 [12] Zhang X L,Yao Y,Zeng X Y et al.,SyntheticMusks in the Aquatic Environment and PersonalCare Products in Shanghai,China[J].Chemosphere,2008,72∶1553—1558 DETERM INATI ON OF SYNTHETIC M USKS IN HUMANM I LK SAM PLES BY GAS CHROMATOGRAPHY/MASS SPECTROM ETRY L IANG Gao-feng1,3WANG Jun1ZHOU Jing1ZHANG X iao-lan1SHENG Guo-ying1,2FU Jia-m o1,2 Synthetic musk fragances are considered as new emerging environmental contaminants in the category of Pharmaceuticals and Personal Care Products.In this paper,the detection method of synthetic musk using gas chromatography and mass spectrometry(GC/MS)was developed.Gel permeation chromatography(GPC)and silica gel packed column were introduced as cleanup procedures.The linear ranges for HHCB,AHTN,MX andMKwere 0.01—1.0μg·ml-1.The recovery rate of spiked samples was 76%—115%,and RSD was 2.8%—7.4%.Phenanthrene-d10was used as a surrogate and the recovery was 81%—113%.The limit of detection(LODs)and limit of quantification(LOQs)were based on a signal-to-noise ratio of 5 and 10,respectively.The LOD was 5ng·g-1lipid weight for HHCB,AHTN,MX and 4 ng·g-1lipid weight for MK,respectively.Using this method,the concentration of synthetic musks in ten human milk samples from shanghai was detected.The results show that the occurrence of synthetic musks is common.The mean concentrationswere HHCB 92±70;AHTN 16±12;MX 26±22;MK 16±14 ng·g-1lipid weight.The contamination level is lower than those reported in EU and USA. synthetic musks,human milk,GC/MS. 2009年5月9日收稿. *973国家重点基础研究发展项目 (2008CB418200)和国家自然科学基金项目 (40872204)资助. **通讯联系人,Tel:021-66137734,E-mail:zhangxiaolan@staff.shu.edu.cn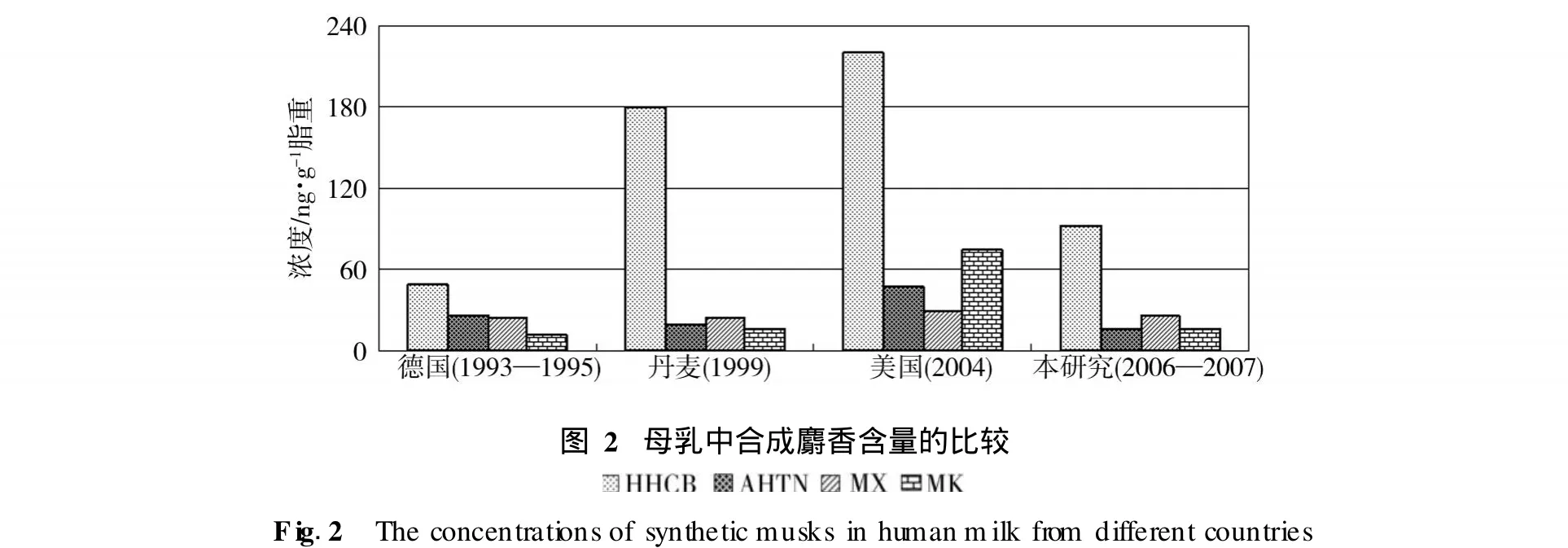
3 结论
(1 Institute of Environmental Pollution and Health,School of Environmental and Chemical Engineering,ShanghaiUniversity,Shanghai,200444,China;2 State KeyLaboratory ofOrganic Geochemistry,Guangzhou Institute of Geochemistry,Chinese Academy of Sciences,Guangzhou,510640,China;3 Qingpu EnvironmentalMonitoring Station of Shanghai,Shanghai,201700,China)

