饮用原水中微量 NH3-N的生物膜脱除*
韩 虹 韦朝海
(1 淮阴工学院生命科学与化学工程学院,淮安,223003;2 华南理工大学环境科学与工程学院,广州,510006)
饮用原水中微量 NH3-N的生物膜脱除*
韩 虹1,2**韦朝海2
(1 淮阴工学院生命科学与化学工程学院,淮安,223003;2 华南理工大学环境科学与工程学院,广州,510006)
针对 NH3-N浓度为 1 mg·l-1的饮用原水,分别以硅锰砂石和聚胺脂海绵作为硝化生物膜载体,考察了自制固定床生物膜反应器的脱氨效果.30 d的连续运行结果表明,砂石载体系统达到 95%—100%的 NH3-N去除率,出水 NH3-N浓度接近 0,出水 N-N浓度在 0—0.02 mg·l-1之间;而海绵载体系统虽然挂膜快,但运行阶段NH3-N去除率仅为 10%—35%,出水NH3-N不能达标,且具有生物可降解性,反硝化过程优先导致N-N的积累.进一步考察了硅锰砂石生物膜系统稳定运行的最优参数,得出试验条件下,水力停留时间为 6 min,气水比为 1∶1,反冲洗周期为 6 d.硅锰砂石因其良好的孔隙率、粒径分布和密度等物理特性,以及化学稳定性和生物安全性,是含低浓度NH3-N原水生物膜净化的良好载体选择.
生物膜,硝化,NH3-N,硅锰砂石,聚胺脂海绵,饮用原水.
近年来,由于水体富营养化等原因,饮用原水的氮元素污染问题越来越受到人们的关注.氨是自养菌繁殖的电子供体,常规的净水工艺由于出水 NH3-N含量高,增加了消毒加氯过程中的氯耗和氯化消毒副产物量.在给水管网中,当NH3-N浓度达到 0.25 mg·l-1时,硝化细菌及部分异氧菌得以在管网中生长,从而影响水质生物稳定性和用户的水质.根据我国建设部《城市供水水质标准》CJ/T206-2005,饮用水中 NH3-N和 N-N的允许浓度分别为 0.5 mg·l-1和 10 mg·l-1;欧盟饮用水水质标准中,NH3-N的指导值为 0.05 mg·l-1,最大允许值为 0.5 mg·l-1[1].传统的混凝、过滤等工艺已不能满足处理的要求,生物膜硝化工艺以其环境友好、稳定可靠及经济有效等优点,成为国内外饮用水处理的应用发展趋势.其基本原理是自养亚硝化菌和硝化菌利用氨或亚硝酸盐作为主要生存能源及以二氧化碳作为主要碳源,将 NH3-N首先氧化成 N-N继而氧化成 N-N的过程.对于贫营养环境中硝化细菌的生长,生物膜载体填料的选择是影响工艺硝化效果的关键因素之一[2].
本文分别以硅锰砂石和聚胺脂海绵作为硝化生物膜载体,通过接种挂膜的方法,考察自制的固定床生物膜反应器在挂膜后以及稳定运行阶段三氮 (NH3-N,N-N和N-N)的变化情况,对比两种生物膜载体对原水中 1 mg·l-1NH3-N的脱除效果.
1 材料与方法
1.1 试验装置
采用自制的固定床生物膜反应器装置,系统主要由固定床生物膜反应器、水泵、曝气头、阀门及水槽等组成.填料柱总体积为 20 ml,填料部分所占体积为 6 ml,管径为 15 mm.由于亚硝化细菌和硝化细菌对可见光、紫外光都具有较高的敏感性,因此反应柱的填料部分用铝箔包住使反应在避光条件下进行.调整流速为 1 ml·min-1,水流自下而上进入反应器,填料柱部分的水力停留时间为 6 min.采用微孔曝气头曝气,气水比为 1∶1.
1.2 材料与分析方法
培养液 (含 N,P,K及微量元素等)由 0.010 mol·l-1K2HPO4/KH2PO4,0.001 mol·l-1NaHCO3及0.001mg·l-1N-NH4Cl配制,且浓度为 1L·(100L)-1培养液的矿物盐溶液含 6.65×10-4mol·l-1Fe-EDT A,1.624×10-2mol·l-1MgS O4,1.02×10-2mol·l-1CaCl2及 20 ml·l-1微量元素.采用自来水配水.
载体 1:为硅锰砂石,孔隙率为 53%,粒径范围为 1 mm—4 mm,密度为 1900 kg·m-3;载体 2:聚胺脂 PU海绵.
菌种:Bactozym(商品名),主要含有经脱水干化的亚硝化细菌及硝化细菌生物膜;经重新水合后,可在载体表面接种,建议接种剂量为 5 mg·l-1.
NH3-N的测量采用纳氏试剂分光光度法;N-N的测量采用 N-(1-萘基)乙二胺分光光度法;N-N的测量采用酚二磺酸分光光度法.
1.3 试验方法
(1)挂膜启动阶段 (闭环反应系统):启动采用接种挂膜.反应开始时,加入 5 mg·l-1Bactozym接种.调节培养液 pH至 7.5.在固定的时间间隔分别测定砂石柱和海绵柱的三氮浓度变化情况.当NH3-N的浓度降到 0或接近 0,向培养液中补充 NH4Cl-N至 NH3-N浓度重新达到 1 mg·l-1.如果体系中出现N-N的积累,就需要换用新的培养液.
(2)运行阶段 (开环反应系统):当 NH3-N的浓度在 24 h内由 1 mg·l-1降至 0或 0左右时,即认为挂膜完成,此时转入系统的开环运行阶段.连续进水.调节培养液 pH至 7.5.在固定的时间间隔分别测定砂石柱和海绵柱的三氮进水及出水的浓度变化情况.
在系统稳定运行后,分别改变运行系统的水力停留时间 (HRT)与气水比,根据出水三氮含量的变化情况,得出实验系统适宜的运行条件.
2 结果与讨论
2.1 两种载体系统挂膜启动阶段的比较
砂石和海绵系统挂膜阶段进出水三氮检测结果分别如图1和图2所示.砂石系统经过 600 h的挂膜培养,逐渐具备了 NH3-N的去除能力.尤其在 500 h以后,NH3-N浓度由 1.0 mg·l-1降至 0仅需1d,表示此时系统挂膜已基本完成,进入了良好的启动状态.在 200 h左右,系统出现了 N-N的积累,这可能是由于气温的变化所致,而硝化细菌比亚硝化细菌对温度具有更高的敏感性[3].更换新的培养液后,N-N浓度重新降至接近 0.N-N的浓度在开始时接近 0,500 h以后,系统开始出现N-N的累积,推测此时间点后 NH3-N绝大部分转化成了 N-N,硝化反应朝着正方向进行,而在此之前 NH3-N有可能部分转化成了其他氮化物 (如N2O,N2等).海绵系统经过 250 h,已经具备了良好的 NH3-N去除能力,即 NH3-N浓度由 1.0 mg·l-1降至 0仅需 1 d.显然海绵系统相比于砂石系统具有更短的启动挂膜时间,这是因为海绵相比于砂石,其表面具有更大的孔隙率,生物膜形成相对较快,挂膜成熟时间短.海绵系统的N-N浓度接近零,而N-N的浓度在 0—0.2 mg·l-1之间不规则变化.
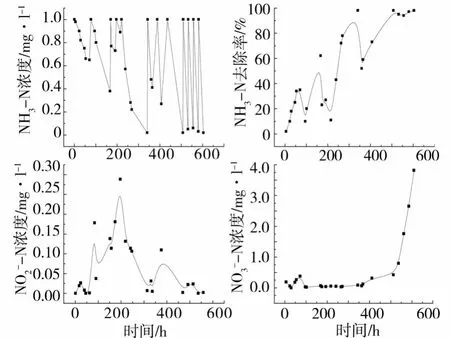
图1 砂石系统挂膜阶段进出水三氮检测结果Fig.1 Three nitrogen results of sand system at starting stage
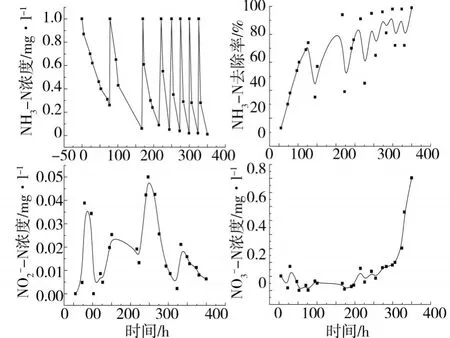
图2 海绵系统挂膜阶段进出水三氮检测结果Fig.2 Three nitrogen results of sponge system at starting stage
通过观察挂膜后两载体系统生物膜的生长状况,发现两个载体系统的生物膜均发育成熟,生物膜均匀分布于载体表面,通过电子显微镜检测,发现有致密的菌胶团和指示性微生物存在.由于硝化细菌处于贫营养状态,生物膜的厚度约为 50—70μm,远低于污水生物处理中的生物膜厚度 (平均 255μm)[3].
2.2 两种载体系统运行阶段的比较
砂石和海绵系统运行阶段进出水三氮检测结果分别如图3和图4所示.砂石系统在开环运行阶段的NH3-N去除率达到 95%—100%,出水 NH3-N浓度小于 0.05 mg·l-1,达到欧盟标准的指导值.N-N的出水浓度较之进水有小量增加,但浓度在 0—0.01 mg·l-1之间,远低于 0.01 mg·l-1.进水N-N的浓度在 0.1—0.3 mg·l-1之间,这是因为自来水中本来就含有少量 N-N,而出水的N-N浓度在 0.70—1.0 mg·l-1之间,且在每个检测时间点N-N的出水浓度较进水浓度有明显增加,证明NH3-N绝大部分朝着硝化反应的正方向进行.海绵系统在开环运行阶段的 NH3-N去除率仅为 35%—65%,NH3-N的出水浓度在绝大部分检测时间点高于 0.5 mg·l-1,仅有少量检测时间点的NH3-N出水浓度低于 0.5 mg·l-1.N-N的出水浓度达到 0.08—0.29 mg·l-1(>0.1 mg·l-1),而N-N的出水浓度较之进水浓度未有显著增加,在某些检测时间点甚至还出现了出水 N-N浓度低于进水浓度的情况.这一现象表明,在海绵系统的开环运行阶段,硝化反应的进行并不规则,推测反硝化占优,并由此导致亚硝酸盐氮的积累.而亚硝酸盐可将血红蛋白中的二价铁转化为三价铁,还可以与血红蛋白形成硝基血红蛋白,毒性为硝酸盐毒性的 11倍[2].
通过观察稳定运行阶段两载体上生物膜生长状况,发现砂石载体的比表面积远大于海绵载体,表面粗糙,挂膜容易,且挂膜后生物膜表面有一些可能深入内部的孔洞或沟渠结构;这种结构以及较小的膜厚度可能使膜内部的微生物同样处于好氧状态,进而延长膜的寿命,增加反应器内的生物量,提高反应器对污染物的去除效率[4];此外,由于砂石材料本身具有一定的机械过滤能力[5],使其对污染物有更好的处理效果,出水能够稳定达标.而海绵载体具有弹性,在水中呈立体状展开,具有价格低廉、安装方便的优点,但其表面相对光滑,生物膜不易附着;200 h以后,发现海绵载体已经开始腐烂,并出现几个较大的气泡,生物膜部分脱落,说明海绵具有生物可降解性,NH3-N去除效果不明显,硝化过程不稳定;同时气泡产生所形成的缺氧区域也促成了反硝化的进行,导致系统运行不能够稳定达标.
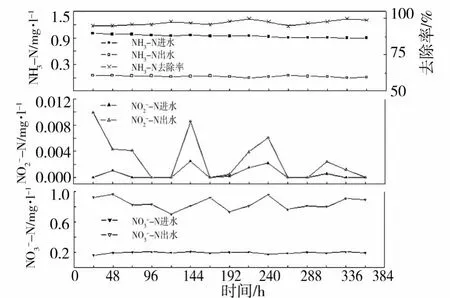
图3 砂石系统运行阶段进出水三氮检测结果Fig.3 Three nitrogen results of sand system at running stage
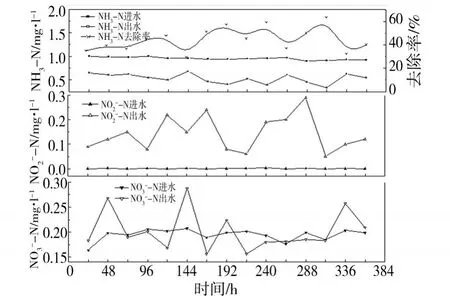
图4 海绵系统运行阶段进出水三氮检测结果Fig.4 Three nitrogen results of sponge system at running stage
2.3 砂石系统稳定运行条件的优化
2.3.1 HRT的影响
试验控制气水比为 1∶1,其它条件不变,改变水力停留时间 (HRT)3,4,5,6,7,8 min.测定进出水的 NH3-N变化情况,结果见图5.由图中得到,HRT<6 min时,NH3-N去除率随 HRT的增加而增大;HRT>6 min时,NH3-N去除率随 HRT的增加变化不大.这是因为,HRT过短会导致硝化反应进行不够完全,同时,水力冲刷会随着停留时间的缩短而增强,导致生物膜脱落很多.进而造成去除效率的下降;但由于硝化反应本身比较迅速,5 min左右就能获得较高的降解能力[2],HRT如果继续增大,只要营养充足,硝化反应实际在填料柱的下半部就已基本完成,而填料柱的上半部对去除率几乎不产生作用,在实际工程中还会造成构筑物体积增加和投资的增大.综合确定试验条件下的HRT为6 min.
2.3.2 反冲洗周期和强度
水头损失的大小决定了生物膜反应器运行的周期和反冲洗时间.砂石载体生物膜滤池总水头损失随时间变化的曲线如图6所示,运行 6 d后水头损失已达 1 m左右,得出反冲洗周期为 6 d.反冲洗气水比为 2∶1,气、水反冲洗时间分别为 3—5 min.
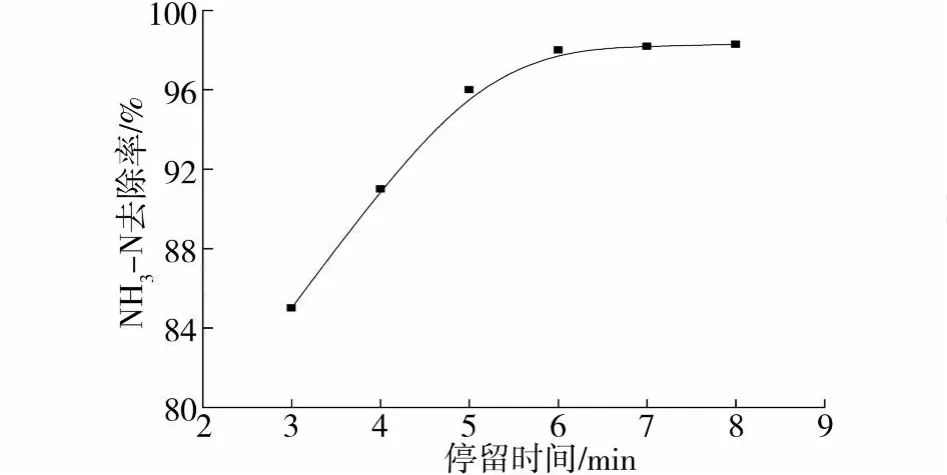
图5 HRT对砂石滤池 NH3-N去除效果的影响Fig.5 Effect of HRT on NH3-N removal in sand system
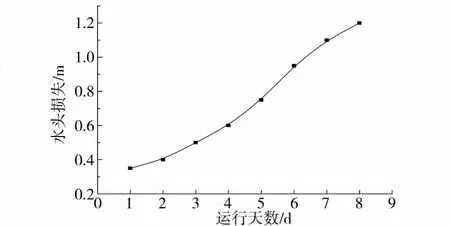
图6 砂石滤池总水头损失随时间变化曲线Fig.6 Total head loss at differant time in sand system
2.3.3 气水比的影响
试验控制 HRT为 6 min,保持进水 DO<0.5 mg·l-1,其他条件不变;改变气水比 2∶1,1.5∶1,1∶1,1∶1.5和 1∶2,测定出水的 DO变化情况,结果分别为: >8.0,>7.0,>6.0,>5.0,>3.0 mg·l-1.国内外文献报道,在好氧污水生物处理中,DO应维持在 2 mg·l-1以上,就能满足生物体对溶解氧的需要,达到稳定的去除效果[2].在微污染水的生物处理中,氧的传质条件要比污水中好得多.较高的气水比一方面可以提供充足的DO,保证微生物对氧的需求;另一方面,上升的气泡及由此产生的水的流动对生物膜表面的冲刷作用,有利于老化生物膜的脱落、更新[6].但采用过高的气水比,也会造成能耗的浪费.由于微孔曝气的氧利用率较高,采用过高的气水比还会造成曝气头上方即下层填料上生物膜的过分冲刷.由试验结果得出合适的气水比范围是 1.5∶1—1∶1.5,试验条件下采用的气水比为 1∶1.
2.4 氮元素衡算
为了探索反应系统中氮元素的转化途径,在砂石系统的运行阶段选取 5个检测时间点进行氮元素衡算,结果见表1.根据硝化反应方程式和氮素守恒规则,反应中产生的 (N-N+N-N)总量应与反应中去除的NH3-N量相等[8].但计算结果显示,(N-N+N-N)总量小于 NH3-N去除量.由此推测在此反应中NH3-N并未完全转化为 N-N和N-N,某些氮素气体 (如 N2O,N2)可能作为硝化及反硝化的中间产物,并从体系中挥发.由此推测,载体空隙处存在缺氧区域,促进了反硝化过程的进行及气体的产生.

表1 砂石系统在运行阶段的氮元素衡算Table 1 Nitrogen balance at running stage in sand system
3 结论
硅锰砂石载体较海绵载体对 1mg·l-1NH3-N具有更好的处理效果,出水 NH3-N浓度小于 0.05 mg·l-1,出水三氮浓度能够稳定达标;海绵载体具有生物可降解性,反硝化过程优先,NH3-N去除效果不明显,出水三氮浓度不能够稳定达标,但海绵载体系统的挂膜启动较硅锰砂石载体系统快.试验条件下,硅锰砂石载体生物膜系统达到最优运行的水力停留时间为 6 min,气水比为 1∶1,反冲洗周期为 6 d;控制合适的水力运行条件后,对低浓度NH3-N能够实现彻底的脱除.表明硅锰砂石可以成为含低浓度NH3-N原水生物膜净化处理的载体选择.
[1] 朱南文,高廷耀,周增炎,饮用水生物脱氮技术现状 [J].水处理技术,1999,25(4)∶214—219
[2] 王占生,刘文君,微污染水源饮用水处理 [M].第一版.北京:中国建筑工业出版社,1999,133—153
[3] Zhang Shu-Lin,Huck PM,Parameter Estimation forBiofilm Processes in BiologicalWater Treatment[J].Wat.Res.,1996,30(2)∶456—464
[4] LeChevallierM W,Babcock TM,Lee R G,Examination and Characterization of Distribution System Biofilms[J].Appl.Environ.M icrobiol.,1987,53(12) ∶2714—2724
[5] 陈汉辉,孙国胜,生物接触氧化法处理微污染水源水的研究进展与应用 [J].环境污染治理技术与设备,2000,1(3)∶55—60
[6] Costerton J W,Lewandowski Z,CaldwellD E et al.,MicrobialBiofilms[J].Ann.Rev.M icrobiol.,1995,49∶711—745
[7] W ilderer P A,Arnz P,Arnold E,Application ofBiofilms and Biofilm SupportMaterials as a Temporary Sink and Source[J].W ater,Air,Soil Pollut.,2000,123∶146—158
DEAMMONIA OF TRACE NH3-N IN DRINKING WATER USING NITRIFY ING BI OFI LM S
HAN Hong1,2W EI Chao-hai2
(1 College ofLife Science and Chemical Engineering,Huaiyin Institute of Technology,Huaian,223003,China;2 College of Environmental Science and Engineering,South China University of Technology,Guangzhou,510006,China)
Silicide-manganese sand and PU sponge were introduced as biofilm carriers in a self-manufactured fixedbed biofilm reactor(FBR),and removal effects of 1mg·l-1ammonia nitrogen in drinkingwaterwere investigated.After one month’s continuous running,the sand system reached an ammonia nitrogen removal rate between 95%—100%,with an output ammonia nitrogen concentration near zero and an output nitrite nitrogen concentration between 0—0.02 mg·l-1.While the sponge system had a shorter generation t ime but an ammonia nitrogen removal rate only between 10%—35%,the output ammonia nitrogen concentration could not achieve the standard;further more,sponge was biodegradable,the output nitrite nitrogen accumulated because of predomination of denitrifying process.In addition,working parameters of silicide-manganese sand biofilms system were discussed.Under optimal conditions,HRT was 6 min,gas-water ratio was 1∶1,and back wash period was 6 d.Silicide-manganese sand has favorable physical porosity,size distribution and density,aswell as,good chemical stability and biological safety.It proves to be preferred nitrifying biofilms carrier choice for raw water purification containing trace ammonia nitrogen.
biofilms,nitrification,ammonia nitrogen,silicide-manganese sand,PU sponge,drinking raw water.
2009年5月9日收稿.
*国家高技术研究发展计划 (863项目)(No.2006AA06Z378);“十一五”国家科技支撑计划重点项目(No.2008BAC32B06-1).
**通讯联系人,E-mail:hanhong99@163.com

