电沉积纳米镍合金在模拟海水溶液中的析氢性能
宋利君 孟惠民,2,*
(1北京科技大学腐蚀与防护中心表面科学与技术研究所,北京 100083;2北京市腐蚀、磨蚀与表面技术重点实验室,北京 100083)
电沉积纳米镍合金在模拟海水溶液中的析氢性能
宋利君1孟惠民1,2,*
(1北京科技大学腐蚀与防护中心表面科学与技术研究所,北京 100083;2北京市腐蚀、磨蚀与表面技术重点实验室,北京 100083)
采用电沉积法获得Ni、Ni-Fe和Ni-Fe-C合金镀层电极,在90℃模拟海水(0.5 mol·L-1NaCl,pH=12)的稳态极化曲线表明Ni-Fe-C合金电极具有最好的析氢催化性能.通过扫描电子显微镜(SEM)观察电极表面形貌、X射线衍射(XRD)与高分辨透射电子显微镜(HRTEM)分析合金的成分和晶体结构,发现电极材料的晶粒尺寸影响析氢催化性能,晶粒尺寸越小析氢催化活性越好.用电化学阻抗方法(EIS)研究电极析氢催化性能的本质原因,结果表明电极表面活性点数目和电极的本质电催化活性对合金电极析氢催化活性有重要的影响.
电沉积;催化活性;析氢反应;纳米镍合金
氢能是人类能够从自然界获取的储量最丰富且高效的能源,用氢能代替目前所用的化石燃料,既能解决化石能源短缺又不带来任何环境负担,最有希望成为21世纪人类所企求的清洁能源.目前工业化生产氢气的能耗高,降低电解槽的超电势是降低成本,减少能耗的主要途径,电解槽的阴极材料是至关重要降低超电势的因素之一.已有的析氢阴极材料主要包括贵金属及其合金和过渡金属及其合金材料两大类[1-5].贵金属析氢超电势低,具有优异的电化学催化活性,但由于贵金属价格昂贵,限制了其广泛应用.研究发现,过渡金属特别是不含贵金属的镍及其合金具有低析氢超电势和低成本的双重优势[6-7].
提高电极材料析氢催化活性有增加电极材料表面有效反应面积和提高电极材料本身电催化活性两种方式.多组元合金电极材料的晶粒尺寸减小、晶体结构细化、表面积增加等都能增加电极材料表面缺陷、表面能、反应活性点,从而提高电催化活性.含有非金属的多组元合金镀层电极(如Ni-P,Ni-S-Mn, Ni-P-C及Ni-S)表现出更高的析氢反应催化活性[8-12].
目前地球淡水资源日益馈乏、污染严重且分布不均,而海水储量极为丰富,所以发展电解海水制氢材料更具有现实性.本文采用直流电镀技术电沉积Ni、Ni-Fe和Ni-Fe-C合金镀层电极,比较它们在碱性海水溶液中的析氢催化活性.研究在相同电流密度下电沉积获得的合金电极成分、晶体结构及表面形貌对电化学催化性能的影响,结合稳态极化曲线和电化学阻抗技术研究提高合金电极在碱性海水溶液中的析氢催化活性的本质原因.
1 实验
1.1 镀层电极制备
采用20 mm×20 mm的A3钢片作为基体.用砂纸去除氧化膜,然后用去离子水反复冲洗干净.将去除表面氧化膜的A3钢片在0.5 mol·L-1H2SO4和0.5 mol·L-1HNO3混合溶液中侵蚀30 s,去离子水冲洗后在0.5 mol·L-1H2SO4溶液中,电流密度100 A· m-2条件下阳极活化10 min.活化后在电镀液中电镀,分别获得Ni、Ni-Fe和Ni-Fe-C合金电极.镀液成分如表1所示,所用试剂均为分析纯.采用H2SO4调节电镀液的pH为1.5,电镀的电流密度为200 A· m-2,电镀时间为1 h.
1.2 表面形貌、成分及结构表征
采用SUPRA 55型场发射扫描电子显微镜观察镀层表面的微观结构.D/max-RB型X射线衍射仪分析镀层相结构,测试条件为Cu靶Kα线,镍滤波,扫描速率为2(°)·min-1,扫描范围为30°-80°.JEM 2100型高分辨透射电子显微镜分析镀层的晶体结构.采用Varian 715-ES电感耦合等离子体发射光谱仪和CS-2008碳硫分析仪分析镀层中Ni、Fe和C成分.
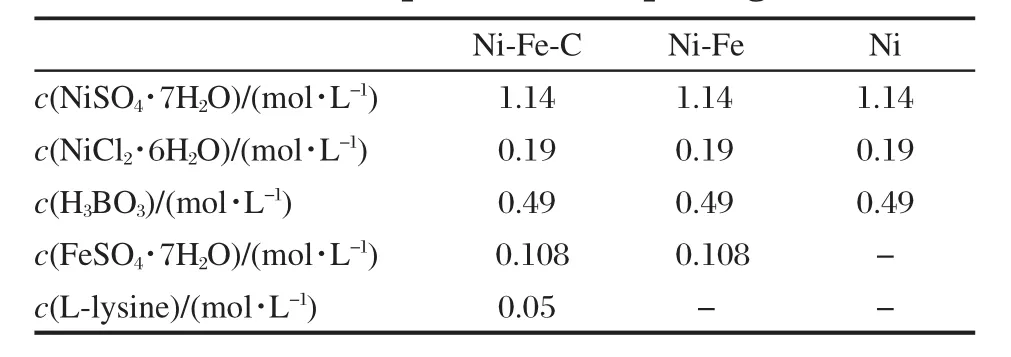
表1 镀液配方Table 1 Component of the plating baths
1.3 电化学测量
采用传统的三电极体系进行电化学测试,试样作为工作电极,所有试样均在90℃的碱性海水溶液(0.5 mol·L-1NaCl,pH=12)中进行测试,氧化汞电极(Hg/HgO,1 mol·L-1NaOH)作为参比电极,2 cm×2 cm铂金片作为辅助电极.极化曲线的测试在EG&G型273A恒电位器上进行,阳极极化曲线的电位扫描速率为5 mV·s-1.阻抗谱测试在相同的恒电位仪和PAR5301型锁相放大器上进行,频率扫描范围为10 mHz-10 kHz.测试实验过程中不断通入氮气,所有的测试试样被固定在一个专门的试样固定器上,每个试样的面积为1 cm2.
2 结果与讨论
2.1 电极的极化曲线
图1是Ni、Ni-Fe和Ni-Fe-C合金电极的极化曲线,可以看出,在碱性海水溶液中,Ni-Fe-C电极具有最好的电化学催化析氢性能,Ni-Fe合金电极次之,最后是Ni电极.通过线性拟合电极动力学参数,在表观电流密度0.1 A·cm-2条件下,Ni、Ni-Fe和Ni-Fe-C电极过电势η分别为335、143及92 mV.比较Ni、Ni-Fe和Ni-Fe-C合金电极析氢动力学参数:它们的斜率b分别为161、190、239 mV·dec-1;交换电流密度分别为6.92×10-4,6.04×10-4和0.039 A· cm-2;传递系数分别为0.45、0.38、0.31.Ni-Fe-C合金电极的Tafel斜率最大,交换电流密度最大,传递系数最小.交换电流密度表征电化学标准活化能[13],其值反映其本质电催化活性.Ni-Fe-C合金电极的交换电流密度最大,反映其本质电催化活性高于Ni-Fe合金和Ni镀层电极.

图1 不同电极的极化曲线Fig.1 Polarization curves of the electrodes
2.2 镀层成分和表面形貌
表2列出了合金镀层电极的各组元的成分,相对Ni镀层而言,Ni-Fe和Ni-Fe-C合金镀层中有很高的Fe含量,而Ni-Fe和Ni-Fe-C合金镀层中的Fe元素和Ni元素的含量相差不大.Ni-Fe合金中45.58%的Ni含量低于Ni-Fe-C合金中52.48%,而Ni-Fe合金中54.42%的Fe含量高于Ni-Fe-C合金中46.07%,但Ni-Fe-C合金中含有1.45%的C.在电镀液中添加少量的Fe2+离子后,电镀时发生异常共沉积,得到较高Fe含量的Ni-Fe合金,在电镀液中同时添加Fe2+离子和赖氨酸,电镀获得的Ni-Fe-C合金中不仅含有一定量的C,同时让Ni的含量稍微增加,Fe含量降低.

表2 合金镀层电极的成分Table 2 Composition of alloy electrodes
图2为Ni、Ni-Fe和Ni-Fe-C合金电极表面的扫描电镜图.由图2可见,Ni、Ni-Fe和Ni-Fe-C合金电极表面微观形貌有很大的不同.Fe和C掺杂的Ni-Fe-C合金表面组织更加细小、平坦、光滑.图2a′Ni电极的表面分布着多边形的凸状组织.相对图2a′Ni电极而言,图2b′Ni-Fe合金的表面分布着均匀的包状形貌,图2c′中Ni-Fe-C合金的表面分布着较小的包状形貌和一些微裂纹.这些微裂纹有利于气泡的生成、聚集、长大,进而提高析氢催化活性.
2.3 镀层的结构



图4 (a)Ni-Fe和(b)Ni-Fe-C合金镀层的HRTEM图与选区电子衍射Fig.4 HRTEM and SAED images of the(a)Ni-Fe and(b)Ni-Fe-C alloy
图3 给出了Ni,Ni-Fe和Ni-Fe-C合金电极的X射线衍射谱.图3a的XRD衍射谱的峰形很尖锐,强度很高,表明电沉积的Ni单质金属结晶良好.根据Scherrer公式,由(111)晶面数据计算得到的晶粒尺寸为36 nm.图3b Ni-Fe合金电极镀层的XRD衍射图的峰宽化,强度减弱,根据PDF卡确认合金镀层是(Ni,Fe)合金相结构.由Ni-Fe合金(111)晶面数据计算得到的晶粒尺寸为9.6 nm.图3c Ni-Fe-C合金镀层的XRD衍射谱图中2θ为43.96°、50.36°和75.18°有宽化的峰,它与图3b Ni-Fe合金的(Ni,Fe)合金相峰位一致,但峰更加宽化,衍射强度减弱.表明镀层的晶粒进一步细化.经分峰由Ni-Fe-C合金(111)晶面数据计算得到的晶粒尺寸仅仅3.4 nm.而2θ为44.46°和64.78°非常尖锐的峰属于基体Fe的峰,Ni-Fe-C合金镀层表面的微观裂纹可能是造成较强基底峰的主要原因之一.一般来说,电极材料的晶粒尺寸减小,表面缺陷增多、表面能升高,有利于析氢反应的发生,电极的催化活性随着晶粒尺寸减小而增加.
图4是Ni-Fe和Ni-Fe-C合金镀层的高分辨透射电镜(HRTEM)图和它们的选区电子衍射(SAED). Ni-Fe和Ni-Fe-C合金的选区电子衍射都表现出一系列同心圆,只是Ni-Fe-C合金的衍射环比Ni-Fe衍射环更加弥散一些.Ni-Fe和Ni-Fe-C合金的HRTEM和SAED图表明两种镀层都是纳米镍基合金,而Ni-Fe-C合金的晶体结构更加细化,其与XRD衍射谱图的结果一致.
2.4 电极的电化学阻抗
电化学阻抗是一种研究电化学催化活性的有力方法.采用图5所示的等效电路Rs(QctRct)对Ni-Fe和Ni-Fe-C合金电极的电化学阻抗(EIS)(如图6所示).Rs是溶液电阻,Qct为常相位角元件CPE,Rct为反应电阻.
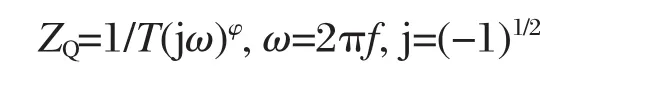

其中T为电容参数,ω为相位角,φ为弥散指数(0<φ<1).Tdl数据在一定程度上反应涂层表面(裂纹、晶界等表面)的活性.活性电极/溶液界面的双电层电容Cdl体现电极表面的活性点数目.
采用非线性最小平方法进行EIS数据拟合,拟合后的结果列于表3.Ni-Fe和Ni-Fe-C合金电极都随着过电位的增加,反应电阻Rct减小.且在相同的过电位下Ni-Fe-C合金电极的反应电阻Rct更小, Ni-Fe-C合金电极的平均电容Cdl大于Ni-Fe合金电极的,而Ni-Fe-C合金电极表观表面更加光滑,表明Ni-Fe-C合金电极表面的活性点数目更多.
电极材料的本征活性可以采用在某一电位E的条件下表观电流密度与粗糙度的比(i/Rf)表征[14],它的粗糙因子是Rf=Cdl/20 μF·cm-2,其中20 μF·cm-2是理想双电层电容值.如表3所示Ni-Fe-C合金电极在电位E=-0.95 V的i/Rf比值是Ni-Fe合金电极的2倍,Ni-Fe-C合金电极的平均电容Cdl比Ni-Fe合金电极的3倍还多,而极化曲线上的Ni-Fe-C合金电极的表观电流密度是Ni-Fe合金电极的3倍,这些数据表明电极催化活性的提高不仅仅由于电极材料真实反应表面积增加,还在于电极材料表面活性点数目增加,电极材料的本质催化活性的提高.与Meguro[15]和Shervedani[16]等在NaOH溶液中的研究结果一致.

图5 拟合EIS的等效电路图Fig.5 Equivalent circuit used for fitting EIS resultsRs:solution resistance,Rct:charge transfer resistance, Qct:constant phase angle element
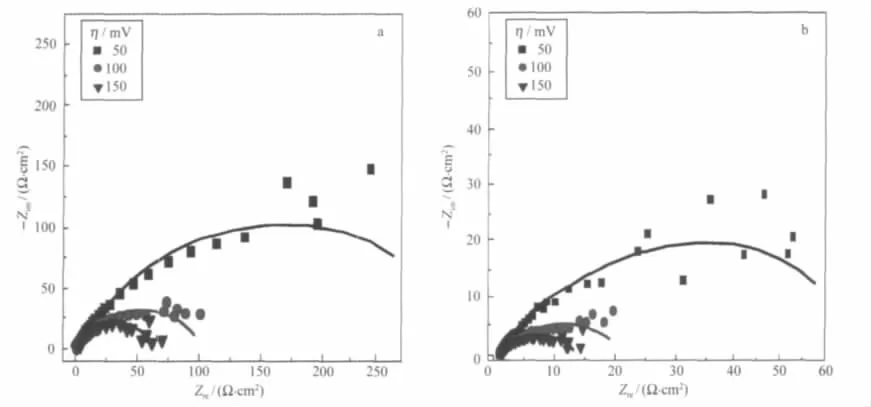
图6 (a)Ni-Fe和(b)Ni-Fe-C电极在不同过电位下的Nyquist图Fig.6 Nyquist diagrams recorded at different overpotentials on the(a)Ni-Fe and(b)Ni-Fe-C alloy coatingSquares,circles,and triangles represent experimental points,while solid lines represent fitting results.
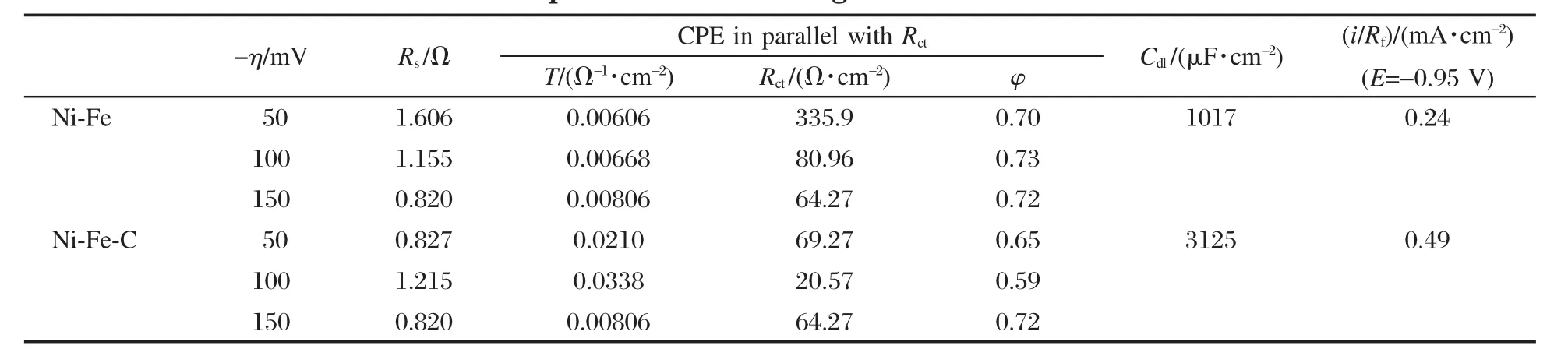
表3 采用非线性最小平方法拟合Ni-Fe和Ni-Fe-C电极的析氢动力学参数Table 3 Kinetic parameters of the HER on Ni-Fe and Ni-Fe-C by approximation of EIS experimental data using CNLS method
元素掺杂合金主要有两种方式,一种替代并占据原有的原子点阵位置,另一种是进入点阵的空隙.金属原子的半径相差不大时,常常采用第一种方式.非金属原子的半径较小时,主要是通过第二种方式掺杂合金.这两种掺杂方式都能减小晶粒尺寸同时产生晶格畸变,间隙掺杂的晶格畸变更大一些.晶格畸变能的增加能提高表面的活化能,可以使得电极表面的反应更加容易.由于Ni和Fe的原子半径相差不大,Fe原子掺杂主要通过占据Ni的点阵位子.那么,相对Ni-Fe合金而言,碳原子半径比较小,总是进入合金的间隙,C原子钉扎在Ni基合金的点阵间隙后使得Ni-Fe-C合金的晶格畸变进一步增加,有利于电极催化活性提高.根据电负性理论,非金属原子的电负性常常较大,能将电负性小的原子的电子吸引到自己的轨道上,削弱金属与刚形成吸附的Hads,即M-Hads的键合能力,形成H2步骤加快,使得析氢速度加快,在很大程度上提高了合金电极的本质析氢催化性能.
2.5 电极的稳定性
Ni、Ni-Fe和Ni-Fe-C合金电极在模拟海水溶液中稳定性如图7所示.由图7可知,Ni-Fe-C合金电极在i=0.1 A·cm-2电流密度电解,槽电压随着电解时间增加不断减小,接着稳定在一定范围,最后上升失效.Ni与Ni-Fe电极的槽电压先增加,然后再减小,最后上升失效.三种电极的比较表明Ni-Fe-C电极具有最低的槽电压,最好的析氢活性,最好的稳定性与寿命.
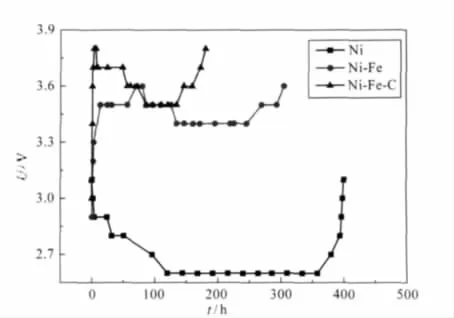
图7 Ni、Ni-Fe及Ni-Fe-C电极的稳定性Fig.7 Stability of Ni,Ni-Fe,and Ni-Fe-C electrodes
3 结论
电沉积法获得了Ni、Ni-Fe和Ni-Fe-C三种合金电极.在3.5%NaCl,pH=12,90℃的模拟海水中Ni-Fe-C合金电极表现出较好的电化学催化析氢性能.Fe、C元素掺杂使Ni-Fe与Ni-Fe-C电极的晶粒尺寸减小,使得电催化析氢性能提高.电极稳态极化曲线和电化学阻抗技术的研究结果表明电极的析氢活性点数目增加,加快析氢反应速度,提高电极的本质电催化析氢活性.三种电极中Ni-Fe-C合金电极在模拟海水溶液中具有最好的析氢稳定性与较长的寿命.采用电镀技术电沉积Ni、Ni-Fe和Ni-Fe-C纳米镍基合金镀层电极.在碱性海水溶液中Ni-Fe-C合金电极表现出最好的析氢催化活性.Ni-Fe和Ni-Fe-C合金镀层电极中的Ni、Fe元素的含量相差不大;Ni-Fe-C合金电极的表面光滑有裂纹;且大量的非金属C元素钉扎在镍铁合金的间隙,使得Ni-Fe-C合金晶粒尺寸略小于Ni-Fe合金.稳态极化曲线和电化学阻抗谱(EIS)的数据结果表明,电极Ni-Fe-C合金电极电催化活性较高不仅在于电极表面的有效反应面积的增加,还在于析氢反应活性点的增加与电极材料的本质电催化活性的提高.
1 Stojkovic′,M.;Koteski,V.;Belo$evic′-Cˇavor,J.;Cekic′,B.;Stojic′, D.;Ivanovski,V.Phys.Rev.B,2008,77:193111
2 Angelo,A.C.D.Int.J.Hydrogen Energy,2007,32(5):542
3 Metiko$-Hukovic′,M.;Grubacˇ,Z.;Radic′,N.;Tonejc,A.J.Mol. Catal.A:Chem.,2006,249(1-2):172
4 Kibria,M.F.;Mridha,M.S.;Khan,A.H.Int.J.Hydrogen Energy, 1995,20(6):435
5 Sheng,J.F.;Ma,C.A.;Zhang,C.;Li,G.H.Acta Phys.-Chim. Sin.,2007,23(2):181 [盛江峰,马淳安,张 诚,李国华.物理化学学报,2007,23(2):181]
6 Huang,J.Z.;Xu,Z.;Li,H.L.;Kang,G.H.;Wang,W.J. Transactions of Nonferrous Metals Society of China,2006,16(5): 1092
7 Solmaz,R.;Kardas,G.Electrochim.Acta,2009,54:3726
8 Fundo,A.M.;Abrantes,L.M.J.Electroanal.Chem.,2007,600 (1):63
9 Shan,Z.Q.;Liu,Y.J.;Chen,Z.Int.J.Hydrogen Energy,2008,33 (1):28
10 Shervedani,R.K.;Madram,A.R.Int.J.Hydrogen Energy,2008, 33(10):2468
11 Han,Q.;Liu,K.;Chen,J.;Wei,X.J.Int.J.Hydrogen Energy, 2003,28(11):1 207
12 Cao,Y.L.;Wang,F.;Liu,J.J.;Wang,J.J.;Zhang,L.H.;Qin,S. Y.Acta Phys.-Chim.Sin.,2009,25(10):1979 [曹寅亮,王 峰,刘景军,王建军,张良虎,覃事永.物理化学学报,2009,25(10): 1979]
13 Jak$ic′,M.M.Electrochim.Acta,2000,45:4085
14 Krstajic′,N.V.;Jovic′,V.D.;Gajic′-Krstajic′,L.;Jovic′,B.M.; Antozzi,A.L.;Martelli,G.N.Int.J.Hydrogen Energy,2008,33 (14):3676
15 Meguro,S.;Sasaki,T.;Katagiri,H.;Habazaki,H.;Kawashima,A.; Sasaki,T.;Asami,K.;Hashimoto,K.J.Electrochem.Soc.,2000, 147:3003
16 Shervedani,R.K.;Madram,A.R.Electrochim.Acta,2007,53: 426
Electrodeposition of Nanocrystalline Nickel Alloys and Their Hydrogen Evolution in Simulated Seawater Solution
SONG Li-Jun1MENG Hui-Min1,2,*
(1Corrosion and Protection Center,Laboratory for Corrosion-Erosion and Surface Technology,University of Science and Technology Beijing,Beijing 100083,P.R.China;2Beijing Key Laboratory for Corrosion-Erosion and Surface Technology, Beijing 100083,P.R.China)
Ni,Ni-Fe,and Ni-Fe-C alloy electrodes were prepared by electrodeposition.Polarization curves showed that the Ni-Fe-C alloy electrode showed the best electrocatalytic activity for the hydrogen evolution reaction(HER)in simulated seawater solution(0.5 mol·L-1NaCl,pH=12)at a temperature of 90℃.The effects of morphology,composition, and crystal structure on hydrogen evolution were studied by scanning electron microscope(SEM),X-ray diffraction (XRD),high resolution transmission electron microscopy(HRTEM).We found that the grain size of the electrodes affected their electrocatalytic activity for the HER.A smaller grain size benefited the catalytic performance. Electrochemical impedance spectroscopy(EIS)indicated that an increase in active sites and intrinsic electrocatalytic activity was important for a major increase in the electrode catalytic activity for the HER.
Electrodeposition; Catalytic activity; Hydrogen evolution reaction; Nanocrystalline nickel alloy
O646;TQ153.2
Received:March 3,2010;Revised:April 29,2010;Published on Web:July 7,2010.
*Corresponding author.Email:ecm@mater.ustb.edu.cn;Tel:+86-10-62332067.
The project was supported by the National High-Tech Research and Development Program of China(863)(2007AA05Z103).
国家高技术研究发展计划项目(863)(2007AA05Z103)资助
ⒸEditorial office of Acta Physico-Chimica Sinica