小热休克蛋白Mj HSP16.5对多肽纤维生长的抑制及对成熟纤维的解聚作用
曹傲能 汪蔚学 宇文泰然 邓 巍 来鲁华,*
(1上海大学纳米化学与生物学研究所,上海 200444; 2北京大学化学与分子工程学院,分子动态与稳态结构国家重点实验室,北京分子科学国家实验室,北京 100871)
小热休克蛋白Mj HSP16.5对多肽纤维生长的抑制及对成熟纤维的解聚作用
曹傲能1,2,*汪蔚学2宇文泰然2邓 巍2来鲁华2,*
(1上海大学纳米化学与生物学研究所,上海 200444;2北京大学化学与分子工程学院,分子动态与稳态结构国家重点实验室,北京分子科学国家实验室,北京 100871)
包括老年痴呆症在内的许多疾病与蛋白质或多肽的淀粉样聚集(纤维化)有关.由于这类疾病的机制尚不清楚,因此还没有有效的预防和治疗手段.研究各种因素如小热休克蛋白对蛋白质或多肽淀粉样聚集的影响对开发防治相关疾病的药物具有重要意义.甲状腺素运载蛋白(TTR)及其突变体很容易形成淀粉样纤维,并与多种疾病相关.Mj HSP16.5是一种来源于嗜热古细菌Methanococcus jannaschii的小热休克蛋白,它在酸性条件下具有非常高的分子伴侣活性.本文研究了Mj HSP16.5对WTTR肽(在N端添加了色氨酸的TTR 105-115片段,序列为WYTIAALLSPYS)纤维化的影响,发现Mj HSP16.5能够显著地抑制WTTR肽纤维的生长,且在Mj HSP16.5存在下,WTTR肽形成的纤维比正常条件下形成的要显著细小.尤其是Mj HSP16.5还可以使已经成熟的WTTR肽纤维解离.结果表明,Mj HSP16.5抑制多肽纤维的机理可能在于其能够与多肽纤维及纤维种子结合.
淀粉样纤维; 抑制; 解聚; 小热休克蛋白;Mj HSP16.5
许多疾病(包括老年痴呆症、帕金森症、二型糖尿病、家族性神经系统综合症等)与蛋白质或多肽的淀粉样聚集(纤维化)有关,这类疾病也称为蛋白质构象病[1-7].现在一般认为所有蛋白质在一定的条件下都可能形成纤维化聚集,甚至无规结构的还原态溶菌酶都可以形成蛋白质纤维[8].迄今为止,蛋白质构象病的很多机制尚不清楚,还没有有效的预防和治疗手段.影响蛋白质或多肽的淀粉样聚集的因素很多,如低于化学计量比的小热休克蛋白就可以显著抑制纤维的形成[9-14].研究这些因素对蛋白质或多肽的淀粉样聚集的影响对于阐明蛋白质和多肽纤维的形成机制,开发防治蛋白质构象病的药物和治疗方法具有重要意义.
小热休克蛋白是生物体对抗不利环境时大量表达的一类重要蛋白,常以寡聚体形式存在.小热休克蛋白主要通过与变性蛋白或其折叠中间态结合形成复合物的方式来防止蛋白质不可逆的变性聚集,从而发挥其分子伴侣活性.在外界应急条件消失后,与小热休克蛋白结合的蛋白质可以在其他热休克蛋白的帮助下重新折叠[15-16].Mj HSP16.5来源于嗜热古细菌Methanococcus jannaschii(Mj),是最先得到晶体结构的小热休克蛋白[17].我们的前期研究工作表明Mj HSP16.5具有很高的抗变性剂稳定性[18-20],而且Mj HSP16.5在酸性条件下具有非常高的分子伴侣活性[21].酸性环境是很多蛋白质和多肽在体外实验中形成纤维化聚集的条件之一,因此Mj HSP16.5非常适合来研究小热休克蛋白对蛋白质纤维形成机理的影响,但至今尚未见相关研究报道.
甲状腺素运载蛋白质(transtheritin,TTR)及其突变体很容易形成淀粉样纤维,并与多种疾病相关,包括家族性神经系统综合症等.TTR的105-115片断被认为是最易发生聚集的部位,在酸性条件下非常容易形成纤维化聚集.以这段多肽为模型,我们曾发展了一种研究多肽纤维拓扑结构的FRET方法[22-23].本文选择TTR的105-115片断来研究Mj HSP16.5对纤维聚集的影响.为便于通过荧光来检测多肽构象的变化,我们在其N端增加了一个色氨酸残基(序列为WYTIAALLSPYS,以下简称WTTR).
1 实 验
1.1 材 料
Mj HSP16.5蛋白按照我们已报道的方法[19]进行表达提纯.WTTR多肽通过固相合成方法合成,经高效液相色谱(HPLC)提纯,并以冻干粉末形式保存.为改善WTTR多肽粉末在水中的溶解情况,防止溶液浑浊,并且使WTTR在新配制的溶液中以单体存在,先用少量二甲基亚砜(DMSO)溶解WTTR(2 mg WTTR多肽溶解于10 μL DMSO),并超声(CD-4800型,42 kHz,70 W)处理3 min,再用pH 2的盐酸稀释至所需的浓度,得到澄清的多肽溶液.除了特别说明,所有试剂均为分析纯,水为超纯水(Millipore).
1.2 纤维的培养
WTTR多肽(2 g·L-1)的pH 2水溶液在37℃恒温培养3个月可以得到成熟纤维.成熟纤维通过超声(CD-4800型,42 kHz,70 W)处理6-8 min制得纤维种子.
为检测Mj HSP16.5对WTTR多肽形成纤维形态的影响,2 g·L-1多肽的pH 2水溶液在不同浓度Mj HSP16.5存在下在37℃恒温培养45天.然后通过原子力显微镜(AFM,Shimadzu SPM-9600,日本)和透射电镜(JEM-100CX,JOEL,日本)(样品经磷钨酸负染)观察纤维形貌,并统计纤维直径.
为检测Mj HSP16.5对WTTR多肽形成纤维的动力学的影响,用紫外酶标仪(SpectraMax190 Microplate Spectrophotometer,Molecular Devices,美国)测定溶液350 nm处的混浊度随时间的变化,以表征存在/不存在Mj HSP16.5的条件下,种子引发的WTTR淀粉样纤维化聚集速率变化.
为检测Mj HSP16.5对WTTR多肽成熟纤维的影响,2 g·L-1成熟纤维(换算成WTTR单体浓度为1.4 mmol·L-1)与等体积0.39 mmol·L-1Mj HSP16.5混合,室温放置5天.作为对照,1.4 mmol·L-1成熟纤维稀释一倍,室温放置5天.然后样品经磷钨酸负染,电镜观察形貌,并统计纤维直径.
1.3 Mj HSP16.5与WTTR多肽、纤维及种子的相互作用研究
通过测定Mj HSP16.5溶液,WTTR溶液,以及含有等摩尔Mj HSP16.5与WTTR混合溶液(平衡15 min)的色氨酸荧光光谱,比较Mj HSP16.5与WTTR混合前后的荧光光谱,以检测两者是否发生相互作用.
通过测定与淀粉样纤维特异结合的荧光染料ThT(thioflavin T,Sigma,美国)的荧光变化来检测Mj HSP16.5与WTTR纤维及种子的相互作用.
所有荧光实验都在 Fluorolog-312荧光仪(HORIBA,Jobin Yvon,法国)上进行,并通过循环水浴控温在25℃.

2 结果与讨论
2.1 Mj HSP16.5抑制WTTR多肽自发纤维化
WTTR多肽可以自发纤维化,其溶液最终变成胶冻状.图1显示的是典型的WTTR多肽纤维AFM和电镜图片,可以明显看出WTTR多肽纤维是由多股细纤维缠绕而成的右旋结构.在Mj HSP16.5存在条件下,WTTR多肽溶液流动性较好,不会变成胶冻状,说明Mj HSP16.5对多肽纤维形成起到了抑制作用.电镜照片显示在Mj HSP16.5存在下,WTTR多肽纤维明显变细(图1(c)).
从大量纤维直径的统计结果(图2A)可以看出,在Mj HSP16.5存在下,WTTR多肽聚集形成的淀粉样纤维的直径分布发生显著变化,细纤维所占比例显著增多.在没有Mj HSP16.5存在时,没有观察到直径在5 nm以下的细纤维,5-7 nm的纤维所占比例仅9.4%;最粗的纤维直径可达26 nm.与此相比,在Mj HSP16.5存在下,直径7 nm以下的细纤维占样本总数的80%以上;而且没有发现直径大于15 nm的纤维.同时,在纤维形成的过程中,随着小热休克蛋白Mj HSP16.5浓度的增加,直径在5 nm以下的纤维比例增加.在0.061 mmol·L-1Mj HSP16.5存在条件下,多肽纤维直径在5 nm以下的占样本总数的 24.7%;而当 Mj HSP16.5的浓度增加到 0.39 mmol·L-1,直径在5 nm以下纤维的比例高达样本总数的50%以上.可以看出,小热休克蛋白Mj HSP16.5对淀粉样纤维的直径分布有显著影响,使细纤维增加,粗纤维减少.
2.2 Mj HSP16.5使成熟WTTR多肽变细
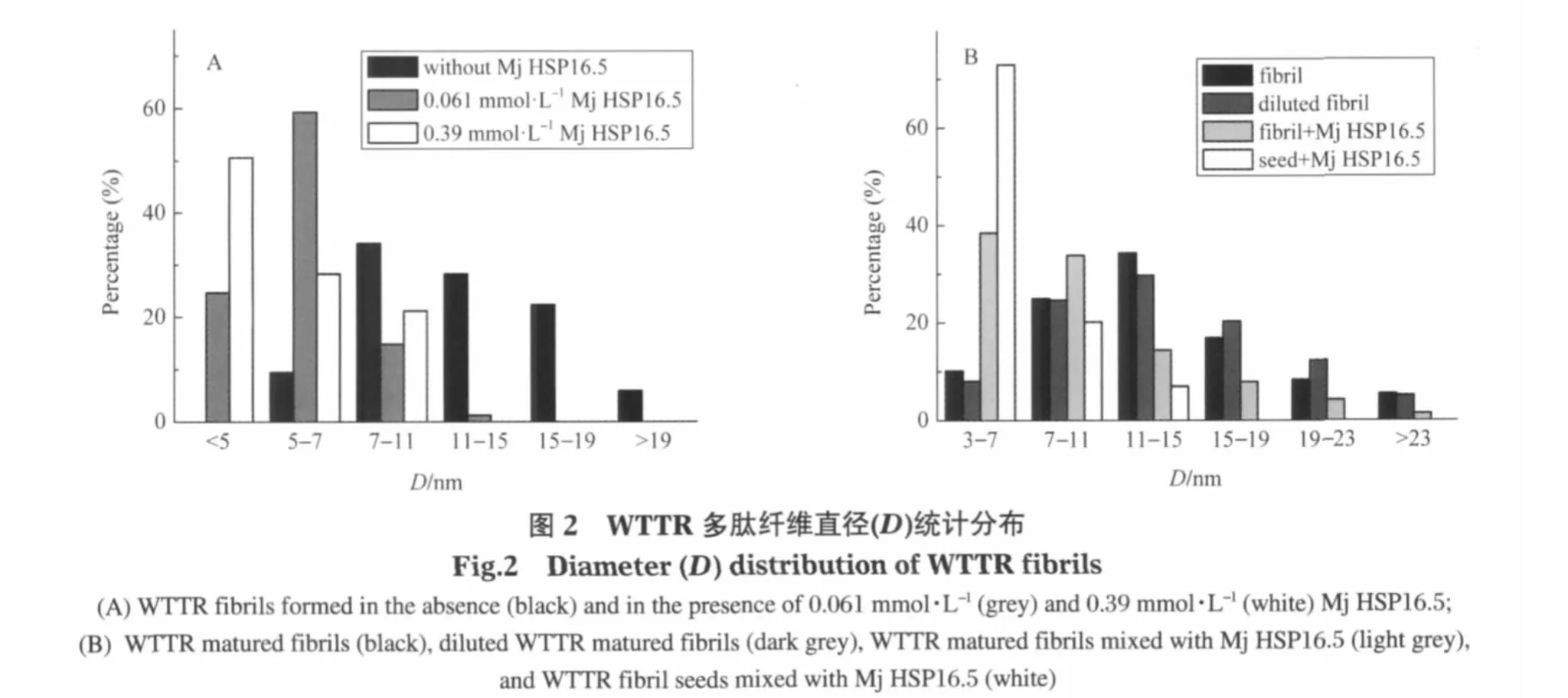
不仅在多肽纤维形成过程中加入Mj HSP16.5可以显著改变多肽纤维的形貌,在多肽自发形成成熟纤维后再加入Mj HSP16.5,也可以明显使成熟纤维变细.从图2B的统计结果可以看出,直接稀释成熟纤维对纤维直径基本没有影响,而加入Mj HSP16.5后,多肽纤维直径明显向细小方向移动.证明Mj HSP16.5有使多肽纤维解离变小的作用.被打碎成为小片段的纤维,即纤维种子中加入Mj HSP 16.5后种子的形貌改变更加显著.在Mj HSP16.5存在时,纤维种子中直径小于7 nm的占70%以上,而且没有直径大于15 nm的纤维种子(图2B).
2.3 Mj HSP16.5可以显著降低种子诱导的WTTR多肽纤维化速率
在没有纤维种子存在的条件下,蛋白质和多肽形成纤维都需要经过一个缓慢的形核过程;而在纤维种子存在的条件下,蛋白质和多肽形成纤维是一个快速的生长过程.为了研究Mj HSP16.5对WTTR多肽纤维生长过程的动力学影响,在加入种子后,我们比较了纤维生长早期的生长速率.实验结果表明,加入微量的Mj HSP16.5(Mj HSP16.5的浓度是9 μmol·L-1,而WTTR多肽的单体浓度是1.4 mmol· L-1,摩尔比1∶156)能够显著降低纤维聚集速率(吸光度变化速率从(1.32±0.09)×10-5s-1降低到(3.5±0.6)× 10-6s-1).如果用Mj HSP16.5预先和种子混合放置40 min,再加入WTTR多肽,则纤维聚集速率进一步减慢(吸光度变化速率降低到(2.4±0.2)×10-6s-1).
以上实验中,Mj HSP16.5的单体浓度仅是WTTR单体浓度的0.6%,而WTTR聚集速率降低了70%以上,显示Mj HSP16.5抑制纤维聚集的机理不可能是Mj HSP16.5与单体结合.比较合理的解释是,小热休克蛋白Mj HSP16.5与种子有相互作用.这也与上述Mj HSP16.5可以改变种子形貌相对应.多肽纤维被打碎成纤维种子后,在纤维断面处暴露出疏水性断面.而Mj HSP16.5能够与蛋白质/多肽疏水性强的部分结合,因而有可能结合到种子的断面处,使种子不能引发多肽单体聚集形成纤维. Mj HSP16.5预先与种子混合后,有足够的时间充分结合种子的生长断面;而未经此预处理的种子在诱导聚集时才加入Mj HSP16.5,Mj HSP16.5来不及与种子的断面充分结合,聚集开始时种子暴露的断面较多,因而其聚集速率比经预处理的种子诱导的聚集速率要快.
2.4 Mj HSP16.5与WTTR多肽单体、纤维及其种子的相互作用
为了揭示Mj HSP16.5对WTTR多肽纤维生长的抑制机制,我们首先通过荧光光谱来探索Mj HSP16.5是否与WTTR多肽单体、纤维或纤维种子发生相互作用.
WTTR这段小肽的单体在水溶液中主要采取伸展构象,位于其N端的色氨酸的侧链可以在极性亲水环境中自由转动,因此其荧光信号非常小,如图3A所示.而Mj HSP16.5具有较多的疏水结合界面,如果 Mj HSP16.5与 WTTR多肽单体结合,则WTTR多肽单体的疏水色氨酸将结合到Mj HSP16.5的疏水结合界面,从而改变WTTR多肽色氨酸的极性环境,并限制其侧链的运动,结果会导致WTTR多肽色氨酸荧光的增强[24-25].然而,图3A结果显示,WTTR多肽单体和Mj HSP16.5混合后荧光并没有增强,反而有微弱的降低,表明Mj HSP 16.5不与WTTR单体发生特异性相互作用,进一步证实Mj HSP16.5抑制多肽纤维的机制不是和多肽单体作用.


ThT是一种与淀粉样纤维特异结合而荧光显著增强的染料,因而常被用来定性和定量检测蛋白质和多肽纤维的生长[10].图3B显示了WTTR纤维及种子与Mj HSP16.5混合前后ThT荧光的变化.在加入少量Mj HSP16.5的WTTR纤维溶液中,ThT产生的荧光比未加入Mj HSP16.5的相同浓度的纤维样品有明显下降,比较合理的解释是Mj HSP16.5结合到了纤维表面,占据了部分ThT可结合部位所导致的结果.另一个可能的原因是Mj HSP16.5使纤维变细甚至可能溶解部分纤维.在超声处理后的纤维种子中加入Mj HSP16.5,也观察到了荧光强度的下降.表明Mj HSP16.5与WTTR纤维及种子都有明显的相互作用.而这种相互作用就是Mj HSP16.5抑制多肽纤维生长的根本原因.
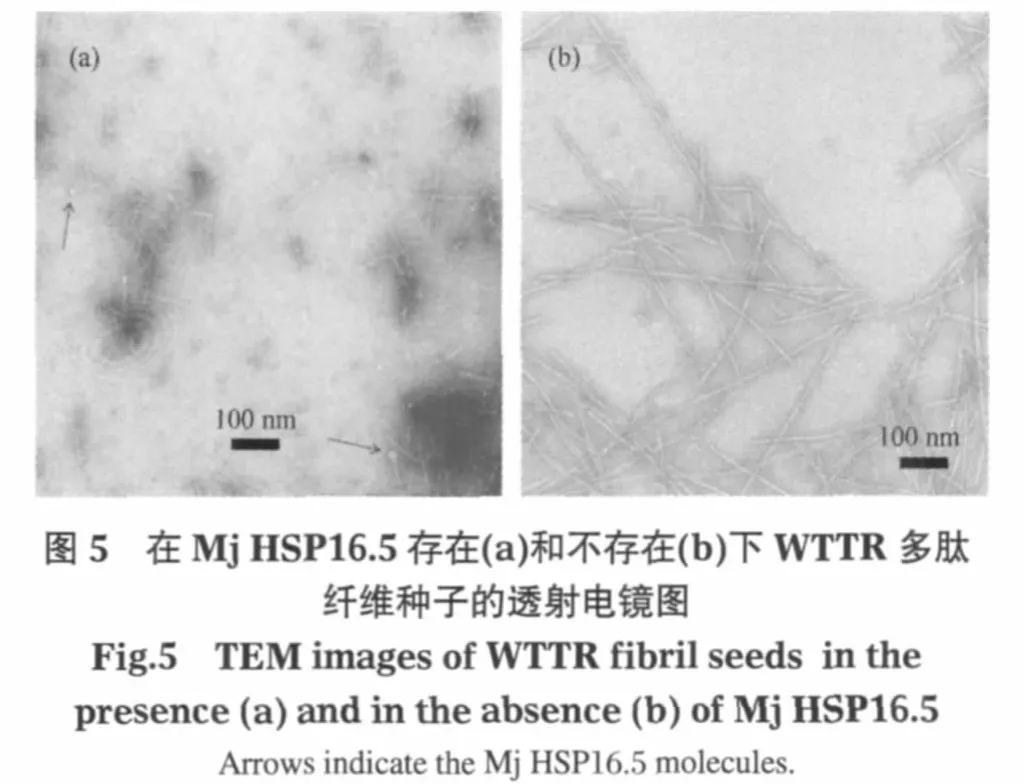
电镜实验结果也证实Mj HSP16.5与WTTR纤维及种子都有明显的相互作用.从Mj HSP16.5与WTTR多肽纤维及纤维种子结合的电镜照片(图4)中可以发现多处结合到纤维侧面的球状结构,即Mj HSP16.5(如图4中箭头所指).其中图4(a)显示了可能正在被Mj HSP16.5解离的WTTR纤维.在超声处理后的纤维种子中加入Mj HSP16.5后,也可以观测到Mj HSP16.5和种子结合的形态图(图4(b)).特别值得一提的是,作为对比,种子在放置一段时间后,细小的种子会逐渐恢复形成成熟的粗长纤维,而在Mj HSP16.5存在下,大量的纤维种子仍然保持为细小的纤维形态,不仅没有恢复形成成熟的粗长纤维(图5),而且直径进一步减小(见图2B统计分布).这可能就是Mj HSP16.5抑制多肽纤维生长速率的机制,同时也很好地解释了种子和Mj HSP16.5预先混合后纤维生长速率进一步下降的实验结果.
3 结 论
我们研究了小热休克蛋白Mj HSP16.5对来源于甲状腺素运载蛋白质的多肽WTTR的纤维化聚集的影响.结果表明,远低于化学剂量比的Mj HSP16.5可以明显抑制由种子引发的WTTR淀粉样纤维化速率.在 Mj HSP16.5存在的条件下, WTTR多肽形成的纤维明显比正常纤维细小.Mj HSP16.5还能够使成熟纤维和纤维种子解离变细. Mj HSP16.5抑制多肽纤维生长并解离成熟纤维的主要原因可能在于Mj HSP16.5可以结合到纤维和纤维种子上.研究结果对如何清除蛋白质和多肽纤维以及开发治疗蛋白质构象病的药物具有启示作用.
1 Dobson,C.M.Nature,2003,426:884
2 Harrison,P.M.;Bamborough,P.;Daggett,V.;Prusiner,S.B.; Cohen,F.E.Curr.Opin.Struct.Biol.,1997,7:53
3 Cohen,F.E.J.Mol.Biol.,1999,293:313
4 Rochet,J.;Lansbury,P.T.Curr.Opin.Struct.Biol.,2000,10:60
5 Sipe,J.D.;Cohen,A.S.J.Struct.Biol.,2000,130:88
6 Grätzel,M.;Aguzzi,A.Brain Res.Rev.,2001,36:241
7 Bellotti,V.;Mangione,P.;Stoppini,M.Cell.Mol.Life Sci.,1999, 55:977
8 Cao,A.;Hu,D.;Lai,L.Protein Sci.,2004,13:319
9 McLaurin,J.;Yang,D.S.;Yip,C.M.;Fraser,P.E.J.Struct.Biol., 2000,130:259
10 Raman,B.;Ban,T.;Sakai,M.;Pasta,S.Y.;Ramakrishna,T.; Naiki,H.;Goto,Y.;Rao,C.M.Biochem.J.,2005,392:573
11 Stege,G.J.J.;Renkawek,K.;Overkamp,P.S.G.;Verschuure,P.; van Rijk,A.F.;Reijnen-Aalbers,A.;Boelens,W.C.;Bosman,G.J. C.G.M.;de Jong,W.W.Biochem.Biophys.Res.Commun.,1999, 262:152
12 Hatters,D.M.;Lindner,R.A.;Carver,J.A.;Howlett,G.J.J.Biol. Chem.,2001,276:33755
13 Liang,J.J.N.FEBS Lett.,2000,484:98
14 Lee,S.;Carson,K.;Rice-Ficht,A.;Good,T.Biochem.Biophys. Res.Commun.,2006,347:527
15 Sun,Y.;MacRae,T.H.Cell.Mol.Life Sci.,2005,62:2460
16 Haslbeck,M.;Franzmann,T.;Weinfurtner,D.;Buchner,J.Nat. Struct.Mol.Biol.,2005,12:842
17 Kim,K.K.;Kim,R.;Kim,S.Nature,1998,394:595
18 Cao,A.;Wang,Z.;Wei,P.;Xu,F.;Cao,J.;Lai,L.Biochim. Biophys.Acta,2008,1784:489
19 Guan,Y.;Wang,Z.;Cao,A.;Lai,L.;Zhao,X.J.Am.Chem.Soc., 2006,128:7203
20 Wang,Z.;Lai,B.;Cao,J.;Li,Z.;Qu,L.L.;Cao,A.N.;Lai,L.H. ActaPhys.-Chim.Sin.,2008,24:1745 [王 铮,赖 兵,曹 洁,李 竹,瞿丽丽,曹傲能,来鲁华.物理化学学报,2008,24:1745]
21 Wang,Z.;Cao,A.;Lai,L.Sci.China Ser.B-Chem.,2009,52:325
22 Deng,W.;Cao,A.;Lai,L.Biochem.Biophys.Res.Commun., 2007,362:689
23 Deng,W.;Cao,A.;Lai,L.Protein Sci.,2008,17:1102
24 Cao,A.;Welker,E.;Scheraga,H.A.Biochemistry,2001,40:8536
25 Wang,X.;Deng,W.;Cao,A.N.;Lai,L.H.Acta Phys.-Chim.Sin., 2003,19:834 [王 旭,邓 巍,曹傲能,来鲁华.物理化学学报,2003,19:834]
Inhibition of Amyloid Fibrillization and Dissociation of Matured Amyloid Fibrils by Mj HSP16.5
CAO Ao-Neng1,2,*WANG Wei-Xue2YUWEN Tai-Ran2DENG Wei2LAI Lu-Hua2,*
(1Institute of Nanochemistry and Nanobiology,Shanghai University,Shanghai 200444,P.R.China;2Beijing National Laboratory of Molecular Sciences,State Key Laboratory for Structural Chemistry of Unstable and Stable Species,College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
The amyloid fibrillization of proteins and peptides is related to many human diseases including Alzheimer′s disease.Currently there is no effective therapy for these diseases,because the mechanism of the amyloid fibrillization is still not clear.Understanding how to effectively inhibit amyloid formation will shed light on the prevention and treatment of these diseases.Transtheritin(TTR)and its mutants easily form amyloid fibrils and are related tomanydiseases.MjHSP16.5,asmallheatshockprotein(SHSP)from Methanococcusjannaschii showshighchaperonelike activity under acidic conditions,and these conditions promote the fibrillization of many peptides.We studied the influence of Mj HSP16.5 on the fibrillization of the peptide WTTR(sequence:WYTIAALLSPYS,i.e.,the 105-115 fragment of TTR with a tryptophan added to its N-terminal).Mj HSP16.5 was found to significantly inhibit the growth and maturation of the WTTR fibrils resulting in much thinner fibrils compared to those under normal conditions.More interestingly,Mj SHSP16.5 can dissociate the matured WTTR fibrils.Based on our experimental results,a possible inhibition mechanism was proposed in which Mj SHP16.5 interacted with WTTR fibrils and/or seeds.
Amyloid fibril;Inhibition;Dissociation; Small heat shock protein;Mj HSP16.5
O641
Received:February 1,2010;Revised:May 10,2010;Published on Web:May 18,2010.
*Corresponding author.Email:ancao@shu.edu.cn,lhlai@pku.edu.cn;Tel:+86-21-66135277,+86-10-62757486.
The project was supported by the National Natural Science Foundation of China(20673003),National Key Basic Research Program of China(973) (2009CB930200),Shanghai Municipal Education Committee,China(09YZ16),and Shanghai Leading Academic Disciplines,China(S30109).
国家自然科学基金(20673003),国家重点基础研究发展规划项目(973)(2009CB930200),上海市教委(09YZ16)和上海市重点学科(S30109)资助
ⒸEditorial office of Acta Physico-Chimica Sinica

