利用Taqman实时荧光PCR检测市售肉制品中转基因大豆成分*
叶可萍,祝长青,2,周光宏
1(南京农业大学农畜产品加工与质量控制农业部重点开放实验室,教育部肉品加工与质量控制重点实验室,江苏南京,210095)2(江苏出入境检验检疫局,江苏南京,210001)
利用Taqman实时荧光PCR检测市售肉制品中转基因大豆成分*
叶可萍1,祝长青1,2,周光宏1
1(南京农业大学农畜产品加工与质量控制农业部重点开放实验室,教育部肉品加工与质量控制重点实验室,江苏南京,210095)2(江苏出入境检验检疫局,江苏南京,210001)
采用优化的CTAB法提取肉制品中的大豆DNA,利用Taqman探针Real-time PCR检测转基因大豆成分的内外源基因。实验表明,利用优化的CTAB法提取肉制品中大豆基因组DNA,内源基因扩增良好;19种样品中有7种检测出CaMV 35S启动子基因,5种检测出RRS基因。首次揭示转基因大豆成分在中国市售肉制品中的存在,转基因大豆蛋白已进入下游肉制品加工链。
转基因大豆,肉制品,实时荧光PCR
转基因生物自1994年获准推广以来[1],在食品中的应用已越来越广泛,源于这些生物的各种食品也丰富,并走上人们的餐桌。与传统食品不同,转基因食品可能对人体健康和生态环境存在潜在影响[2-5]。虽然我国尚未允许种植转基因大豆,但2008年我国进口大豆3 700万 t,大部分为转基因大豆(roundup ready soybean,RRS)已进入食品消费领域。大豆蛋白由于其独特的营养特性与功能特性,作为肉品工业必不可少的成分,占据重要角色,成为最广泛应用的植物蛋白。随着国产大豆的紧缺,转基因大豆越来越多地占据我国市场,由于美国大豆大部分是抗除草剂草甘膦转基因大豆,转基因里的成分很有可能进入到肉制品的加工链中。荧光定量PCR是新近出现的一种定量PCR检测方法,主要有非特异性染料结合和荧光探针标记2种。目前应用较多的是Taqman探针法,它是在常规PCR反应体系中加入一个特异性的Taqman荧光标记探针,通过荧光信号积累实时监测整个PCR反应进程[6]。由于Taqman探针Real-time PCR的特异性强、灵敏度高,因此近年来常被用于检测食品中转基因生物的基因成分。
目前,检测转基因大豆食品的技术路线通常为:首先对样品进行大豆内源基因检测并判断DNA提取效果;其次对样品进行筛选检测并判定其结果为阳性或阴性;最后对筛检阳性结果进行确认验证并做出肯定或否定的判定[7]。Fábio 等[8]对巴西市场上含大豆蛋白质的肉食品添加剂的研究表明,32个食品添加剂样本中25个样本检测到164 bp Lectin基因片段,15个样本中检测到抗草甘膦大豆的特异基因169 bp片段;在8种肉食品中检测到Lectin基因,3种检测到抗草甘膦大豆特异基因。Taski-Ajdukovic等[9]在塞尔维亚市场上销售的51个肉制品中,利用Realtime PCR法发现其中12种可检测到35S启动子的195 bp片段。Paola等[10]在检测大豆产品及可能含有大豆成分的加工品中发现6种香肠产品中有2种存在RR大豆DNA成分。Ralf等[11]抽查的100个样品中21%含有转基因成分,其中3种大豆分离蛋白中就有一种检测到含外源基因。Gabriella等[12]调查匈牙利市场21种肉制品,均检测到Lectin基因,同时定量检测外源基因时发现,5种样品转基因成分含量>5%,3种样品转基因成分含量在0.9%~5%,4种样品转基因成分含量<0.1%。国外转基因的大豆蛋白已作为食品成分在加工肉制品中商业化应用,对肉制品的安全性提出了新的挑战。
随着国产非转基因大豆的紧缺,我国肉制品企业有可能应用含转基因成分的大豆蛋白,但由于肉制品中大豆蛋白含量较少,且肉制品与大豆产品不同,属于大豆下游食品链产品,因此有必要对市售肉制品中转基因成分进行检测。因此,调研市售肉制品中转基因成分的存在状况,可提供转基因成分在我国肉制品链中加工及流通环节的信息,了解其在我国肉制品市场的分布现状,为下游食品中转基因成分的标识与追溯打下基础,确保“从农田到餐桌”全程将转基因与非转基因产品分开和标识。
1 材料与方法
1.1 主要实验材料与试剂
根据大豆蛋白在肉制品配料配方中的作用,购买6个企业的19种市售低温肉制品(如香肠、火腿等),于4℃保存,直至DNA提取。
实时荧光PCR反应的Premix预混液:TaKaRa DRR039A;标准物质:经过确认的转基因大豆提取核酸后经验证,稀释到合适浓度用于检测;引物和探针参照ISO 21570:2005和 GB19495.4-2004,由 TaKa-Ra公司合成,序列见表3;其他试剂均为分析纯。

表1 本研究所用引物及探针
1.2 主要仪器与耗材
Roche LightCycler 480实时荧光PCR扩增仪,瑞典罗氏公司;Nanodrop 1000 Thermal核酸蛋白测定仪,美国热电公司;Avanti J-E落地式高效冷冻离心机,美国Beckman Coulter公司;台式冷冻离心机,AllegraTM64R Centrifuge,美国Beckman Coulter公司;96孔荧光PCR反应板;200、20、10μL滤芯枪头;其他常规分子生物学实验室仪器设备。
1.3 试验方法
1.3.1 DNA提取
将GB/T 19495.3-2004中CTAB法进行改良优化,提取样品核酸。流程为:称取5 g样品,剪碎放于50mL离心管中,加入12.5mL CTAB提取缓冲液和39μL蛋白酶K(20mg/mL),颠倒混匀后于65℃孵育混匀机中30 min;20 000 g离心10 min,提取上清液1mL于1.5mL离心管,加入2μL RNase A酶(100mg/mL),60℃孵育15 min;18 000g离心3 min,取上清液700μL于1.5mL离心管;加入与上清液等体积的三氯甲烷,颠倒混匀后,20 000 g离心10 min,转移上清液600μL于2mL离心管;加入2×体积CTAB沉淀液,颠倒混匀后,室温静置12 h;20 000 g离心10 min,弃去上清液,向沉淀中加入400μL NaCl溶液,使沉淀溶解;在溶解液中加入等体积三氯甲烷,颠倒混匀后,20 000 g离心10 min,转移上层水相至1.5mL离心管中;加入0.6倍体积经4℃预冷的异丙醇,颠倒混匀后,于4℃下静置30 min;4℃下20 000 g离心10 min,小心弃去上清液;加入750μL经4℃预冷的75%乙醇,倾斜离心管,轻轻转动数圈后,4℃下20 000 g离心10 min,小心弃去上清液;用经4℃预冷的75%乙醇按相同方法重复洗1次。室温下后放置挥干液体;加 50μL AE缓冲液(60℃预热)溶解DNA,-20℃保存备用。
1.3.2 DNA浓度与纯度测定
以AE缓冲液为空白调0,取2μL样品,滴于Nanodrop核酸蛋白测定仪的镜片上,对DNA浓度与纯度进行测定。
1.3.3 Taqman探针实时荧光PCR
按表2配制实时荧光PCR反应体系。反应程序:第1阶段预变性95℃/20 s;第2阶段95℃/10 s、60℃/30 s,循环数55;第3阶段40℃/20 s冷却仪器。在第2阶段的退火延伸时段收集荧光值,PCR反应结束后,根据收集的荧光曲线和Ct值判定结果。阳性对照以转基因大豆的DNA溶液为模板;试剂空白对照(以水代替DNA模板)。每个样品作2个重复。
2 结果与讨论
2.1 肉制品中转基因大豆成分核酸提取效果
肉制品是利用畜禽肉为主要原料,经调味制作的熟肉制成品或半成品[13],它是一种混合物质,包含瘦肉、肥肉、添加剂、调味料等。利用优化的CTAB法提取的核酸,经Nanodrop测定得到,样品DNA浓度均大于50 ng/μL,A260/A280均在 1.8~2.0,提取的DNA均适合于PCR的扩增。

表2 Real-time PCR反应体系
2.2 大豆内源Lectin基因检测
提取到一定数量的大豆基因组DNA是进行转基因成分PCR扩增的前提条件,对被检测样品内标基因进行PCR扩增,是判断食品组分和DNA提取质量的有效方法。大豆基因植物凝集素基因(Lectin)在大豆细胞中的表达量或在其基因组中的拷贝数是恒定的,受环境因素影响较小,其数量多少可作为大豆基因组大小的参照[14-17]。通过对 Lectin基因的扩增,可以判断所提取大豆DNA是否适合于PCR扩增,避免假阴性结果的出现。从图1可看到,试剂空白对照的荧光曲线平直,阳性对照出现典型的扩增曲线,表明反应体系工作正常。样品同样出现典型的扩增曲线,表明肉制品中大豆蛋白的基因组DNA可利用优化的CTAB法及Real-time PCR得到检测。
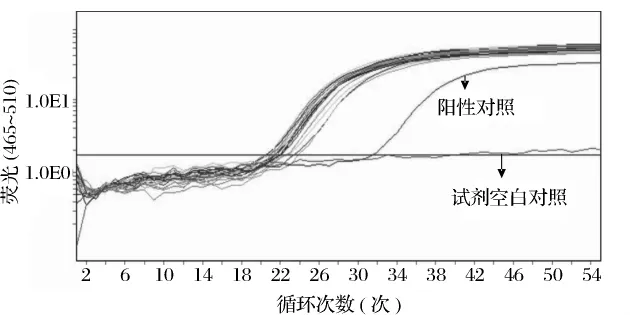
图1 19种样品Lectin内源基因扩增曲线
2.3 CaMV 35S启动子基因检测
筛选检测主要是以转基因植物的通用元件和标记基因作为特异性扩增片段[18]。由于相同的通用元件和标记基因常被用于多种转基因植物的研究与生产,从而大大降低了筛选PCR检测的特异性,只能用于转基因植物检测的初步筛选。检测到这些通用元件只预示着检测样品中存在有转基因成分。
CaMV 35S启动子是转基因大豆使用的启动子,CaMV 35S启动子基因存在于外源插入基因表达框架中,非转基因植物中不存在该基因。因此,对CaMV 35S启动子进行扩增可以对转基因食品进行初筛,确定肉制品中是否存在转基因成分。由图2可看出,反应体系工作正常,部分样品出现典型的扩增曲线,即检测的19种肉制品中有7种扩增出CaMV 35S启动子特异性片段。由结果可得,市售肉制品可能已受转基因植物成分污染,对样品进行初步的筛选。

图2 19种样品CaMV 35S启动子基因扩增曲线
2.4 RRS基因检测
构建特异性检测是通过检测外源插入载体中两个元件的连接区DNA序列的扩增实现的,具有相对较高的特异性,能确证抗草甘膦转基因大豆成分的存在。本研究选取35S与CTP的连接区RRS基因进行扩增确证。由图3可看出,反应体系工作正常,部分样品出现典型的扩增曲线,即检测的19种肉制品中有5种扩增出RRS特异性片段。
3 讨论
对市场上销售的肉制品调查发现,市场上许多肉制品的配料表中均含有大豆蛋白,说明许多肉品加工企业添加一定量的大豆蛋白等增稠剂来提高其出品率。本试验根据大豆蛋白在肉制品配料表中的位置,购买6个企业的19种市售低温肉制品(如香肠、火腿等),保证样品中含有足够检的大豆蛋白用于检测。
对于肉制品中RRS成分的检测,需要高效率高质量的核酸提取方法。CTAB法主要通过CTAB分离缓冲液将DNA溶解出来,再经氯仿-异戊醇抽提除去蛋白质,最后得到DNA,适用于混合物的DNA提取。由于肉制品中物质比较复杂,且大豆蛋白含量较少(一般为2%~6%)[19],因此有必要采取一些措施如提高取样量、延长DNA沉降时间等来提高DNA提取效率。由结果可看出本试验优化的CTAB法适用于肉制品中大豆组织DNA的提取。同时,由于大豆蛋白已为大豆的加工品,在进入下游食品链时又经过肉制品的相关工艺过程,DNA可能发生不同程度的降解,选择较短的DNA片段进行扩增是进行成功检测的关键[20]。有研究发现,靶标序列在100 bp时可以抵御恶劣的加工工艺[21]。因此本试验选取的扩增片段均小于100 bp,分别为Lectin(81 bp)、CaMV 35S(74 bp)和RRS(83 bp),提高检测的准确性。
本试验选取南京市场上6个企业的19种市售肉制品,7种样品扩增出CaMV 35S启动子特异性片段,5种样品扩增出RRS特异性片段,这5种产品中含转基因大豆成分,仅扩增出CaMV 35S启动子的产品可能含有转基因植物。同时这些检测出的转基因阳性品并非来自同一个企业,说明国内有些肉品企业应用的大豆蛋白已含有转基因成分。
4 结论
本试验在南京市场选取的19种肉制品中有5种产品检测出转基因成分,说明我国市场中流通的一些大豆蛋白中含转基因,我国肉制品企业应用了这些含转基因成分的大豆蛋白,使其进入下游肉制品加工链,这对转基因的标识与追溯提出了新的要求。同时抗除草剂草甘膦大豆(RRS)的大豆蛋白已作为食品成分在加工肉制品中商业化应用,也对肉制品的安全性提出了新的挑战。
[1]叶增民,潘婕.转基因大豆及其制品的安全性研究现状况[J].生物技术通讯,2009(2):26-28.
[2]Barabara eeler.Buried data in Monsanto’s study on round up ready soybean,whole life time[EB/OL],http://www.biotech-info.net/buried.data.html,2000-08.
[3]Hardell L,Eriksson M.New study links world’s biggest selling pesticides to cancer,Swedish study finds exposure to glyphosate and MCPA increases risk for nonhodgkin’s lymphoma[M].Sweden:Press Release PAN AP Penang Malaysis,1999.
[4]Charles M Benbrook.Troubled times amid commercial success for roundup ready soybeans:glyphosate efficacy is slipping and unstable transgene expression erodes plant defenses and yields[EB/OL].http://www.mindfully.ory/GE/GE2/RRS-Troubled-Benbrook.htm,2001-05-01.
[5]沈晓峰,栾凤侠,陶波.抗草甘膦转基因大豆生物与环境安全性[J].东北农业大学学报,2007,38(3):401-404.
[6]敖金霞,高学军,仇有文,等.实时荧光定量PCR技术在转基因检测中的应用[J].东北农业大学学报,2009,40(6):141-144.
[7]王小花.食品中抗草甘膦转基因大豆实时PCR检测方法的建立与应用[J].苏州:苏州大学硕士论文,2009:6.
[8]Fábio C,Brod A,Ana C M,et al.Recombinant DNA in meat additives:specific detection of Roundup ReadyTM soybean by nested PCR[J].J Sci Food Agric,2007,87(10):1980-1984.
[9]Taski-Ajdukovic K,Nikolic Z,Vujakovic M,et al.Detection of genetically modified organisms in processed meat products on Serbian food market[J].Meat Science,2009,81(1):230-232.
[10]Cardarelli P,Branquinho M R,Ferreira R T B,et al.Detection of GMO in food products in Brazil:the INCQS experience[J].Food Control,2005,16(10):859-866.
[11]Greiner R,Konietzny U,Villavicencio A L C H.Qualitative and quantitative detection of genetically modified maize and soy in processed foods sold commercially in Brazil by PCR-based methods[J].Food Control,2005,16(8):753-759.
[12]Ujhelyi G,Vajda B,Béki E,et al.Surveying the RR soy content of commercially available food products in Hungary[J].Food Control,2008,19(10):967-973.
[13]周光宏.肉品加工学[M].北京:中国农业出版社,2008.
[14]Hurst C D,Knight A,Bruce I J.PCR detection of genetically modified soya and maize in foodstuffs[J].Breed-ing,1999,5(6):579-586.
[15]Vollenbofer S,Burg K,Schmidt J,et al.Genetically modified organisms in food-screening and specific detection by polymerase chain reaction[J].J Agric Food Chem,1999,47(12):5 038-5 043.
[16]Windels P,Taverniers I,Depicker A,et al.Characterization of the roundup ready soybean insert[J].Eur Food Res Techno,l 2001,213:107-112.
[17]Meyer R,Chardonnens F,Hubner P,et al.Polymerase chain reaction in the quality and safety assurance of food:detection of soya in processed meat products[J].Z Lebensm Unters-Forsch,1996,203(4):339-334.
[18]梁杉,梁宁,蒋继志,等.转基因豆粕调控元件在饲料加工中降解变化的初步研究[J].华北农学报,2009,24(2):201-205.
[19]Boabc.China Food Additive Market Report 200808[EB/OL]. http://www.boabc.com/en/productservice/reports/foodadditive/07302290.shtml,2008-08.
[20]Bogani P,Minunni M,Maria M,et al.Transgenes monitoring in an industrial soybean processing chain by DNA-based conventional approaches and biosensors[J].Food Chemistry,2009,113(2):658-664.
[21]柯纳德J.海勒.基因工程食品——生产方法与检测技术[M].北京:化学工业出版社,2005.
Detection of Genetically Modified Soybean Ingredients in Meat Products by Taqman Real-time PCR
Ye Ke-ping1,Zhu Chang-qing1,2,Zhou Guang-hong1
1(Key Laboratory of Food Processing and Quality Control,Ministry of Agriculture/Key Laboratory of Meat Processing and Quality Control,Ministry of education,Nanjing Agricultural University,Nanjing 210095,China)2(Jiangsu Exit-Entry Inspection and Quarantine Bureau,Nanjing 210001,China)
This article used the cety-ltrimehyl ammonium bromide(CTAB)method with some modifications to extract DNA,endogenous and exogenous genes of genetically modified soybeans were detected using Taqman Realtime PCR.Nineteen samples of meat products containing soy proteins were tested for the presence of soybean amplifiable DNA using the CTAB extraction methods with modifications,all the samples gave a positive signal for the lectin gene,7 samples returned a positive signal for CaMV 35S promoter detection,and 5 samples for specific RR detection confirming the presence of genetically modified soybean.These results demonstrate for the first time the presence of RR soybean in meat products sold commercially in China,and genetically modified soybean proteins have got into the downstream chains of meat products.
genetically modified soybean,meat products,Real-time PCR
硕士研究生(周光宏教授为通讯作者)。
*农业部转基因生物新品种培育重大专项课题:食品链中转基因生物的溯源与污染评估模型的研究(2009ZX08012-014B)
2010-06-19,改回日期:2010-09-27

