仙山人掌冻干粉提取工艺优化和抗敏功效检测
赵 华,邳 楠,何聪芬,王海涛,李 伟,董银卯
(北京工商大学,北京市植物资源研究开发重点实验室,北京 100037)
仙山人掌冻干粉提取工艺优化和抗敏功效检测
赵 华,邳 楠,何聪芬,王海涛,李 伟,董银卯*
(北京工商大学,北京市植物资源研究开发重点实验室,北京 100037)
[目的]研究仙人掌冻干粉提取工艺和抗敏效果,为其在功能食品中的开发利用提供部分参考。[方法 ]选用酶解法提取仙人掌的活性成分,采用透明质酸酶体外抑制实验测定其抗过敏功效,对仙人掌冻干粉的纤维素酶解提取物和 22种中药提取物的抗敏效果进行了对比。[结果]仙人掌冻干粉最终的提取工艺流程:所采用的酶为纤维素酶,提取的工艺条件为:温度50℃,pH为5,添加量为0.15u/mL,固液比为1∶20,纤维素酶解时间为1h。仙人掌酶解水提取物的抗敏效果最好。[结论]仙人掌冻干粉的水提物具有优异的抗敏功效。
仙人掌冻干粉,酶提法,工艺优化,抗敏功效
过敏是机体受抗原性物质刺激后引起的组织损伤或生理紊乱。目前过敏人群已占全世界人口的40%,如在美国 20%以上的人都受过过敏疾病的困扰。从天然的植物中提取出活性成分,具有低毒高效的作用效果,越来越受到人们的青睐,可作为新型的食品添加剂,用于保健食品的研究开发[1-2]。仙人掌(cactus)为仙人掌科仙人掌属植物,主要分布于南美洲、非洲、东南亚、南亚和我国南方等热带、亚热带地区,云南省境内具有丰富的资源分布。仙人掌中含有 SOD、多糖、生物碱、黄酮甙、皂甙等成分,具有抑菌、消炎、镇痛、增强免疫、降血糖、抗脂质过氧化等药理作用,并有多种临床用途[3-6]。但是,迄今为止,国内外关于仙人掌的抗敏抗刺激作用方面的文献很少,尤其是关于仙人掌粉提取物添加到抗敏食品中的研究。本文以仙人掌粉为原料,采用酶转化法作为前处理手段,并对仙人掌粉提取工艺进行优化,提高有效成分的提取率并对其抗敏功效进行检测,为其应用于抗敏食品中提供理论依据。
1 材料与方法
1.1 材料与仪器
扭刺仙人掌粉 昕圣生物科技发展有限公司,其中粗蛋白含量为 0.65%~0.68%,脂肪含量为 0.30%~0.31%;酶制剂 均为天津诺维信酶制剂公司,具体性质见表 1;其余试剂 均为实验室常用试剂。
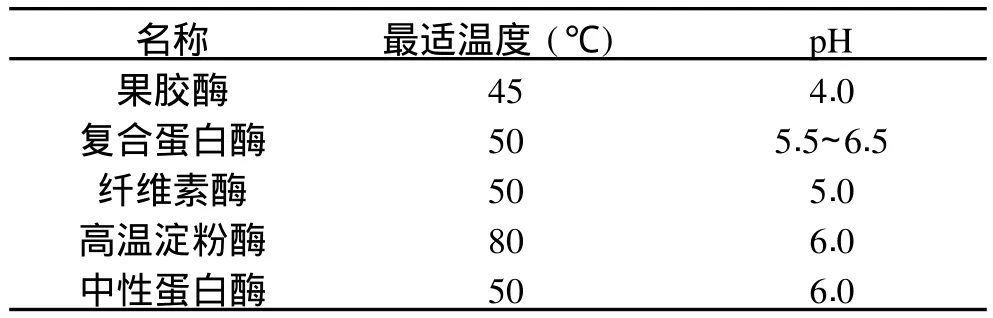
表 1 实验用酶制剂的性质
pH计、电导率仪 上海天达仪器有限公司; 2WAJ阿贝折光仪 上海光学仪器厂;HH·S1-M电热恒温水浴锅 北京长安科学仪器厂;UV-2300紫外光谱分析仪 上海天美科学仪器;RE-52C旋转蒸发仪 上海青浦沪西仪器厂。
1.2 实验方法
1.2.1 酶解法提取仙人掌冻干粉的工艺流程 仙人掌冻干粉→预处理→调节温度和 pH→加酶→酶解→灭酶→除渣→脱色→离心→旋蒸→高温灭菌→防腐
按料液比 1∶20(50g∶1000mL)配料[10],以 E/S为0.15u/mL添加酶[11],调节适宜的 pH和温度,水浴提取一定时间后,于 80℃高温灭酶 10min,再静置 2h除渣。添加 1%活性炭 70℃下脱色 1h,5000r/min离心15min后,取上清液,在压力 0.08MPa、温度 70℃下旋蒸至原体积的 1/5。90℃下灭菌 30min,加入 0.6% LGP防腐剂,得到仙人掌冻干粉提取液。
1.2.2 不同种类的酶对仙人掌粉有效成分含量的影响 分别添加果胶酶、纤维素酶、中性蛋白酶、淀粉酶、复合酶,以不添加酶的水提仙人掌粉作为空白对照。在各种酶最适 pH和温度下进行提取,根据检测各阶段仙人掌粉提取液中可溶性固形物的含量和多糖含量,确定最佳用酶。
1.2.3 不同酶解时间对仙人掌粉有效成分含量的影响 对每种酶进行六个不同酶解时间的研究,按 1.2.1所示工艺流程进行反应,根据检测各阶段仙人掌粉中提取液可溶性固形物的含量和多糖含量确定最佳酶解时间,反应时间分别为 20、40、60、80、100、120min。
1.2.4 提取液中多糖和蛋白含量测定
1.2.4.1 多糖的测定 采用 Dubois[7]法,即苯酚-硫酸法。用分析纯葡萄糖作标准曲线,回归方程为Y=[(X+0.0049)/0.0101]×稀释倍数 (相关系数r=0.9999),其中:X代表吸光度值,Y代表葡萄糖溶液浓度(μg/mL)。
1.2.4.2 蛋白质测定 采用 Folin-酚法测定。用牛血清蛋白作标准曲线,回归方程为 X=[(Y-0.0415)/0.0027]×稀释倍数 (相关系数 r=0.9969),其中:X代表牛血清蛋白溶液浓度(μg/mL),Y代表吸光度值。
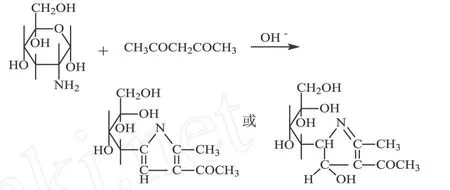
1.2.5 仙人掌提取液抗敏功效检测 本方法采用透明质酸酶体外抑制实验 Elson-Morgan法[8-9]测定抗过敏功效。透明质酸酶是过敏反应的参与者,研究表明透明质酸酶与炎症、过敏有强相关性,许多抗过敏药物有强抑制透明质酸酶活性的作用。透明质酸酶能够不加选择地水解透明质酸中的β-N-乙酰葡糖胺与D-葡糖醛酸盐之间的 1,4-键,而得到β-N-乙酰葡糖胺,β-N-乙酰葡糖胺在碱性条件下可以与乙酰丙酮缩合生成生色原 2-甲基-3-二乙酰吡咯衍生物,生色原与对-二甲氨基苯甲醛在浓盐酸乙醇中生色。基本反应方程式为:
2-甲基-3-乙酰-吡咯衍生物 +P-DAB→生色(结构不明)
取 0.1mL 0.25mmol/L CaCl2溶液和 0.5mL透明质酸酶液,37℃保温培养 20min;加入样品液 0.5mL,继续 37℃保温培养 20min;加入 0.5mL透明质酸钠液37℃保温 30min,常温放置 5min;加入 0.1mL 0.4mol/L NaOH溶液和 0.5mL乙酰丙酮溶液,置于沸水浴中加热 15min后,立即用冰水进行冷却 5min;加入埃尔利希试剂 (Ehrlich reagent,称取 0.8g对-二甲氨基苯甲醛溶于 15mL浓盐酸和 15mL无水乙醇中)1.0mL并用 3.0mL无水乙醇进行稀释,放置 20min显色,用分光光度计测定其吸光度值。
抗过敏活性计算公式为:
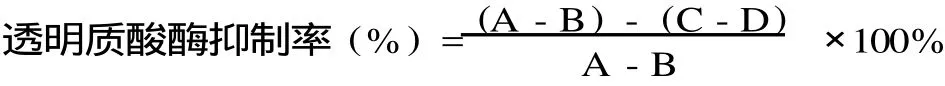
式中:A-对照溶液ABS值(用醋酸缓冲溶液代替样品溶液);B-对照空白溶液ABS值(用醋酸缓冲溶液代替样品溶液及酶液);C-试样溶液ABS值;D-试样空白溶液ABS值(用醋酸缓冲溶液代替酶液)。
实验时先对A组试样进行450~700nm范围的波长扫描,以确定最大吸收波长,然后以去离子水作为参比,在该最大吸收波长处分别进行 ABS值测定。同一样品的两次测定值之差应不超过两次测定平均值的10%。
2 结果与分析
2.1 不同种类的酶和不同酶解时间对仙人掌粉有效含量的影响
在确定最佳酶和酶解时间过程中,可溶性固形物含量和多糖含量为两个重要参数。由图 1可知,添加了六种不同酶的仙人掌粉提取液在相同的提取条件下,可溶性固形物含量在 60min均达到最大值,其中纤维素酶解液和中性蛋白酶解液的可溶性固形物含量最大;继续延长反应时间,可溶性固形物含量值整体趋于平稳。

图 1 仙人掌粉提取过程中可溶性固形物含量变化关系图
由图 2可知,添加了六种不同酶的仙人掌粉提取液在相同的提取条件下,多糖含量在 60min均达到最大值,其中纤维素酶解液的多糖含量最大; 60min后,多糖含量呈下降趋势。
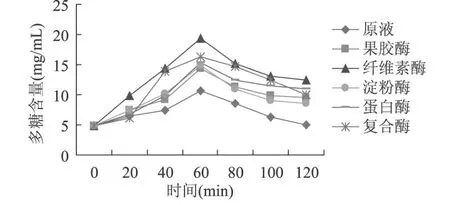
图 2 仙人掌粉提取过程中多糖量变化关系图
由图 1、图 2可以确定,最佳添加酶为纤维素酶,最佳酶解时间为 60min。
2.2 仙人掌纤维素酶解提取液中有效成分比较
由表 2可以看出,仙人掌粉提取液中添加纤维素酶每毫升的多糖含量高于仙人掌粉水提液 8mg/mL,每微升的蛋白质含量高于仙人掌粉水提液 8.3μg/mL。说明纤维素酶有助于提高仙人掌粉中多糖、蛋白质的提取。

表 2 仙人掌粉提取液多糖、蛋白质含量对比
2.3 仙人掌提取液抗敏功效检测
本实验对 22种中草药提取物的抗敏功效进行了检测,提取物均来自本实验室。将各种草药配制为浓度均为 1%的水溶液,实验结果见表 3。

表 3 22种中草药透明质酸酶抑制率(%)
在 22种实验原料中,抗过敏效果相对较好的实验原料透明质酸酶抑制率依次是:仙人掌冻干粉提取物 97.0%,茶多酚 93.2%,葡萄籽 72.5%,麦冬71.3%,槲皮素 67.4%。
3 结论
传统仙人掌粉提取工艺采用水提法,但由于仙人掌细胞粗大,壁厚,有效成分难以从胞内扩散出来,需要多次浸提,操作时间长,收率低。本实验利用酶促反应高效特异性、条件温和、转化效率高、副产物少的特点,采用了生物技术代替化学方法,工艺简便、省时,再加上酶解条件和离子交换条件的优化,使有效成分的提取率有一定的提高,并且产品安全性高。
本实验研究结果表明,纤维素酶酶解法优于其他各种酶。这主要原因是因为植物细胞壁由大量纤维素构成,纤维素酶可有效溶解植物细胞壁,使植物细胞内的生物功能性成分可以被有效提取,对于仙人掌的综合开发利用及提高其经济价值具有实际意义。
目前抗敏人群数量急剧增多,但据市场调查分析发现,在当今食品市场中宣称抗敏的添加剂较少,真正有效的抗敏添加剂更少。本论文在充分调研我国中药功效的基础上,以期通过结合体外生化和人体实验开发出安全,稳定功效显著的抗敏植物食品添加剂。
综合以上分析,采用纤维素酶,酶解条件:温度50℃,pH为 5,E/S为 1%,固液比为 1∶20,酶解时间为 1h的条件下提取,得稳定澄清的仙人掌提取液,有效成分提取率优于传统的水提方法。
[1]黄丽,冯志臣,韦保耀,等 .地榆与桂枝抗过敏作用的研究[J].食品科技,2007(6):135-137.
[2]黄丽,韦保耀,滕建文 .紫苏叶过敏有效成分的研究[J].食品科技,2005(5):90-93.
[3]王者悦 .中国药膳大辞典 [M].大连:大连出版社, 1992:222.
[4]陶美华,曾富华,卢向阳 .仙人掌属植物的化学成分、药理作用及开发利用[J].亚热带植物科学,2004,33(1):64-68.
[5]周立刚,杨成宗,吴建勇 .仙人掌属药用植物的研究进展[J].中草药,2004,35(1):103-105.
[6]陈朝银,赵声兰,曹建新 .仙人掌茎有效成分分析[J].中国野生植物,2004,16(4):24-27.
[7]MichelDubois,K A Gilles,J K Hamilton,et al.Colori metric method for deter mination of sugars and related substances[J]. Anal Chem,1956,28:350-354.
[8]李晚谊.云南茶叶、甜菜和紫苏抗过敏功能的研究[D].重庆:西南农业大学,2001.
[9]井上俊夫.辣薄荷中的抗过敏成分[J].国外医学中医中药分册,2003,25(4):249.
[10]马瑞君,郭守军,杨永利,等 .正交实验法优选坛紫菜多糖的提取工艺[J].食品科学,2006,27(12):524-526.
[11]梁靖,须海荣,等 .纤维素酶在速溶茶中的应用研究[J].茶叶,2002,28(1):25-26.
Study on opti m ization of the extraction technology of cactus powder and efficacy evaluation of its anti-allergy
ZHAO Hua,PI Nan,HE Cong-fen,WANG Ha i-tao,L IW ei,DONG Y i n-mao*
(Beijing KeyLaboratory of Plant Resources Research and Development, Beijing Technology and BusinessUniversity,Beijing 100037,China)
[O b jec tive]Op ti m iza tion of the extrac tion technology of cac tus p owde r and efficacy eva lua tion of its anti-a lle rgy,and it was exp ec ted theresults could g ive bas ic consulta tion on the deve lopm ent anti-a lle rgy func tiona l food by cac tus extrac tion.[M e thod]The ac tive ing red ients from cac tus we re extrac ted by enzym eass is ted m e thod.And the m e thod of hya luronidase inhib ition in vitro was used for eva lua tion the effec tiveness of its anti-a lle rgy.The results ind ica ted tha t the Ce llulase was the bes t one am ong Neutra lp rotease,Protam ex,Pec tinase and high-temp e ra ture am ylase for extrac tion the ac tive ing red ients from cac tus and the op ti m iza tion cond itions we re the temp e ra ture of50℃,pH of5,Ce llulase /Cac tus p owde r of0.15u/mL,solid-liquid ra tio of1∶20,and hyd rolys is ti m e for1h.Cac tus extrac tion by Ce llulase was the bes t for the anti-a lle rgy effec t am ong22kinds of Chinese M ed ic ine extrac tion.[Conc lus ion]Cac tus wa te r extrac tion from freeze-d ried p owde r had exce llent anti-a lle rgy effec ts.
cac tus p owde r;enzym e-ass is ted extrac tion;p rocess ing op ti m iza tion;anti-a lle rgy effec ts
TS201.2
A
1002-0306(2010)05-0305-03
2010-01-07 *通讯联系人
赵华(1965-),男,博士研究生,副教授,研究方向:天然产物分离及应用。
国家“863”资助项目(2007AA100404)。

