周期性张应变力对幼年和成年及骨关节炎软骨细胞产生糖胺多糖的影响
商鹏 陈维毅 卫小春 李晓娜
骨关节炎(OA)是关节疾病中最常见的类型之一。流行病学调查显示中老年人群中,60%有明显OA的影像学改变。疾病主要累及负重的大关节,其病理过程以关节软骨基质的降解破坏为特征,1995年国际OA专题会议提出了OA的最新定义,认为OA是力学和生物学因素共同作用下导致软骨细胞、细胞外基质以及软骨下骨三者降解和合成正常偶联失衡的结果。可见,软骨细胞代谢的改变是OA病变发展的关键。而软骨细胞合成、分泌基质活动受到机械应力的调控,异常的应力刺激会造成软骨细胞功能下降、失调,使基质合成减少,失去正常的更新替换,从而导致关节退变的启动及发展[1]。同时,人们发现,适宜的应力载荷能够促进软骨细胞增殖和合成细胞外基质[2,3],且常常由于体外培养的软骨细胞因培养条件、取材部位不同,以及所受作用力的形式和大小难以精确掌控而导致实验结果存在较大差异[4,5]。所以,我们进行了大量的前期研究,发现经过干预的同一类软骨细胞,其细胞骨架,粘弹性等力学参数均发生改变[6,7],故推测其对力学刺激的响应能力也应存在一定差别,而此类研究尚未见报道。对不同年龄及OA软骨细胞的力学生物学研究,对于揭示软骨组织在生长、成熟与退化过程中,软骨在细胞分子水平上与力学环境的相互作用特点具有一定意义。本研究通过使用新型的Flexercell-4000型力学加载系统,对体外培养的不同年龄兔膝关节软骨细胞施加更为精确的周期性张应变力,观察特定强度的力学刺激对幼年、成年及OA兔软骨细胞GAG表达的影响。
1 材料与方法
1.1 实验动物与分组 雄性新西兰白兔13只,购自山西医科大学动物实验中心。按年龄分为幼年(2月龄)3只作为幼年组,以及成年(5月龄)10只,随机分为成年组及OA组,各5只。
1.2 OA模型的制备
1.2.1 手术方法 OA组:新西兰白兔采用戊巴比妥钠(1 ml/kg)肌肉注射麻妥后,双侧膝关节备皮,仰卧固定于实验台上,消毒、铺巾。1%利多卡因局麻,取髌骨旁内侧切口,逐层切开皮肤及皮下筋膜,打开关节腔,将髌骨外翻脱位,极度屈膝下显露前交叉韧带,直视下尖刀切断(辅助检查前抽屉试验阳性),注意勿伤及周围组织。生理盐水冲洗关节腔,丝线缝合关节腔及皮肤,无菌敷料包扎固定。术后每只动物给予青霉素40万U/d,持续7 d。
成年组:实验动物采用同样的麻醉方法,打开关节腔后,同样将髌骨脱位,保持关节腔暴露时间大致同实验组,但不切断前交叉韧带,其余处理同上。建立动物模型后,置于动物饲养笼内(1 m×1 m×0.5 m),可以自由活动。
1.2.2 大体观察及及评判标准 手术后20周空气栓塞处死动物,无菌条件下取双侧膝关节标本。将左侧膝关节用锐刀去除周围软组织,保留关节软骨的部分并用咬骨钳修整成合适的形状,进行软骨改良Mankin’s评分[8]。
1.3 膝关节软骨细胞分离培养 每次取同一年龄组兔空气栓塞处死。无菌条件下取双侧膝关节,在超净工作台内将膝关节打开,锐刀刮取膝关节表面软骨,切成约1 mm3的碎片,无菌D-Hanks液冲洗,弃上清,称重。按12 ml/g软骨用0.4%Pronase酶37℃消化90 min,600rpm,5 min。弃上清,按12 ml/g软骨用无菌0.025%II型胶原酶37℃过夜消化,1200rpm,10 min。弃上清,无菌 D-Hanks液冲洗,100μm 及40 μm细胞筛网过滤于无菌培养瓶内,加入原代软骨细胞培养液,台盼蓝排除法染色后使用细胞计数板在镜下观察细胞存活率。
1.4 细胞计数板计数 依据下列公式计算每毫升DMEM中活细胞数:细胞总数=4大格细胞总数/4×104×4。细胞活性率=4大格活细胞数/4大格细胞总数。
1.5 周期性张应变(Cyclic Tensile Strain,CTS)作用于软骨细胞:本实验通过Flexercell-4000型力学加载系统施加周期性张应变于软骨细胞。该系统通过一个真空泵抽吸特制的柔性细胞培养膜(Bioflex6孔培养板)下方密封的加载底座,形成负压而使培养板基底膜产生拉伸应变,从而使黏附生长的细胞受到张力的作用(图1)。
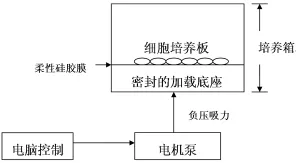
图1 Flexercell-4000型力学加载系统示意图
细胞所受力的大小正比于培养膜的牵拉幅度即为应变率百分比。加载装置置于CO2孵育箱内,外部由Flexercell-4000配套计算机加载程序调控电机泵,实现强度精确控制的力学加载。
各组细胞均按照 2 × 104/cm2[9,10]分 别接种于 2 个BioFlex6孔培养板上,共计6板,在培养箱内培养约60~72 h、当软骨细胞达到70% ~80%融合时,吸去原培养基,加入3 ml无血清培养基,将各个年龄组的2个BioFlex六孔培养板分别随机分为加载组及空白对照组,其中加载组板每隔18 h 进行 6 h 强度为 sin10% ,0.5Hz 正弦波[9,10,11]的力学刺激,对照组置于相同培养箱内不做特殊处理。从首次加载时算起的第24、48和72 h分别留取各年龄组的对照组及加载组各孔细胞培养基250 μl(并补充等量新鲜培养基),分装于Eppendorf管,-20℃冻存作为标本以备检测。
1.6 糖胺多糖的检测 采用Alcian Blue染色沉淀法测定[12]。培养液上清由-20℃取出,置于4℃冰箱中解冻。取标准品和样本各100 μl加入不同的1.5 ml eppendorf离心管中,分别加入8 mol/L盐酸胍50 μl,摇匀后再分别加入50 μl试剂1,摇匀静置10 min,各加入650 μl冰冻试剂2过夜。将过夜的溶液在12000 r/min的条件下离心15 min,各取700 μl上清液分别移人新的1.5 ml离心管,各加入500 μlAlcian blue染液,摇匀后静置至少1 h,然后再在同样条件下离心15 min,弃去上清液,分别加入750 μlDMSO洗液,震荡0.5 h,同样条件下离心15 min,弃去上清液,再分别加入500 μl分数液,震荡15 min后,在600nm波长下用酶标仪测定糖胺多糖含量。每孔重复测量2次取平均值。
2 结果
2.1 大体标本观察 幼年组的关节软骨表面光滑,色泽乳白,软骨表面未见无骨赘、裂纹或凹陷,软骨覆盖面积大。成年组的关节软骨表面光滑,色泽正常,未见软骨表面裂纹及凹陷,无骨赘形成。而OA组的关节均肿胀变形,软骨面色泽灰暗,表面粗糙糜烂,软骨表面裂隙、纤维化主要在滑车及股骨内髁,股骨双髁及胫骨内髁关节表面软骨有缺损,软骨下骨外露,骨赘增生明显,胫骨内侧髁尤显,软骨覆盖面积小。
2.2 糖胺多糖的检测结果(见表1):

表1 加载前后各组细胞培养基上清液中GAG随加载时间变化(μg/ml),n=6
2.3 数据比较结果 相较于对照组,CTS加载后各组软骨细胞的GAG含量均有显著升高(P<0.05)。通过对CTS作用前后幼年和OA组间;及成年和OA组间GAG含量随时间变化趋势的统计分析显示,两组均存在明显差异(P<0.05)。
与同类细胞对照组相比,老年细胞CTS组GAG升高较在48 h时最显著,幼年及成年组则较晚(72 h);且幼年组及成年组细胞GAG最大升幅较OA组大(P<0.05)。
3 讨论
大量研究表明,适宜的力学刺激是骨骼正常生长不可缺少的条件之一。力学刺激强度适当与否影响着多种骨与软骨疾病和损伤的发生、发展和修复的进程[13]。关节软骨由少量的软骨细胞和大量的细胞外基质组成。基质的主要成分是蛋白多糖(Proteoglycan,PG)与胶原蛋白,它是软骨区域之间相互联系的媒介,是敏感的应力传递者[14]。GAG占PG相对分子量90%以上,是其决定性功能基团。许多关节退变所导致的骨科疾病均与细胞外基质的减少密切相关。因此,研究力学刺激对软骨细胞外基质合成的作用特点具有重要意义,而此类研究以往尚不多见。
同时,我们知道不同干预类型的软骨细胞在其形态、结构以及功能等多个方面可能具有差异,故而推测其在相同条件的应力作用下所产生的效应特点也应存在一定差异,我们已进行的力学生物学实验亦证明了这一点[6,15]。因此,本实验利用新型的Flexercell-4000型力学加载系统,直接对离体培养的软骨细胞施加精确的CTS刺激,比较各组细胞响应的差别。本次结果可以观察到:各组细胞在CTS作用后GAG分泌量均有所升高,同时响应特点又存在差异。OA细胞对力学刺激的响应能力明显偏低。
OA细胞对力学反应能力的明显降低,是由于相应细胞器的减少老化,细胞扩增能力减低,或是细胞基质内各种细胞炎性因子含量的变化;还是合并有细胞骨架重排,细胞膜通道及信号传导、基因表达调控方式改变等方面的共同影响?详细机制尚待进一步研究。我们希望通过比较正常及OA软骨细胞的力学生物学研究,初步认识软骨细胞在生长、成熟和退化过程中的自然规律及相应变化,有助于了解软骨疾病的发病及修复特点,同时也为骨退行性病变的预防与治疗提供一条新途径。
[1] 余存泰,徐中和,黄公怡.应力导致关节软骨退变机制的实验研究.实用骨科杂志,2004,10(5):414.
[2] Wong M,Carter DR.Articular cartilage functional histomorphology and mechanobiology:a research perspective.Bone,2003,33:1-13.
[3] Lee DA,Bader DL.Compressive strains at physiological frequencies influence the metabolism of chondrocytes seeded in agarose.J Orthop Res,1997,15(2):181-188.
[4] 舒茂国,郭树忠.机械牵拉培养方法与机械应力对培养细胞影响的研究进展.中国美容医学,2001,10(5):443-446.
[5] 李彬,张西正,张永亮,等.骨组织工程中的应力与生长.国外医学生物医学工程分册,2003,26(3):129-134.
[6] 卫小春,李春江,张全有,等.不同年龄兔关节软骨细胞的力学特性.中华医学杂志,2009,89(33):2360-2363.
[7] 李昊,卫小春.不同年龄兔关节软骨细胞细胞骨架的观察:[硕士学位论文].山西:山西医科大学,2008.
[8] Sommerlath K,Gillquist J.The effect of a meniscal prosthesis on knee biomechanics and cartilage.An experimental study in rabbits.Am.J.Sports Med,1992,20:73-81.
[9] Elder SH,Kimwa JH,Soslowsky LI.Effect of compressive loading on chondrocyte differentiation in agarose cultures of chick limb-bud cells.J Orthop Res,2000,18(1):78-86.
[10] Lee DA,Noguchi T,Knight MM,et al.Response of chondrocyte subpopulations cultured within unloaded and loaded agarose.J Orthop Res,1998,16(6):726-733.
[11] 何川,邓廉夫.关节软骨细胞的生物力学特征研究进展.国外医学·骨科学分册,2001,22(3):139-142.
[12] L.Stefen Lohmander.Markers of cartilage metabolism in arthrosis.Acta Orthop Scand,1991,62(6):623-632
[13] 李伟,肖德明.应力状态下软骨细胞研究进展.国外医学,骨科学分册,2005,26(3):180-181.
[14] Greco F,Specchia N,Falciglia F,et al.Ultrastructure analysis of the adaption of articular cartilage to mechanical stimulation.Ital J Orthop Traumtol,1992,18(3):311.
[15] Wei XC,Rasanen T,Messner K.Maturation-related compressive properties of rabbit knee articular and volume fraction of subchondral tissue.Osteoarthritis Cartilage,1998,6:400-409.

