钯催化的交叉偶联反应
——2010年诺贝尔化学奖简介
肖唐鑫 刘 立 强琚莉 王乐勇
①②博士研究生,③博士,④教授,南京大学化学化工学院,南京210093
钯催化的交叉偶联反应
——2010年诺贝尔化学奖简介
肖唐鑫①刘 立②强琚莉③王乐勇④
①②博士研究生,③博士,④教授,南京大学化学化工学院,南京210093
钯催化 偶联反应 诺贝尔化学奖
2010年10月6日,瑞典皇家科学院宣布将2010年诺贝尔化学奖授予美国科学家Richard F.Heck,日本科学家Ei-ichi Negishi和Akira Suzuki。这三名科学家是因为在有机合成领域中钯催化交叉偶联反应方面的卓越研究而获奖。它为化学家提供了一款精致的工具来合成复杂的有机分子。这一成果广泛应用于制药、电子工业和先进材料等领域。笔者对钯催化交叉偶联反应领域作了粗浅的介绍,以期起到抛砖引玉之作用。
2010年的诺贝尔化学奖揭晓后,很多专业人士对此并不感到惊讶,认为这次的评选结果实乃众望所归。确实如此,三位科学家都已近耄耋之年,他们所做的贡献早已造福全球,按理早应摘取这个桂冠了。当瑞典皇家科学院在2010年10月6日宣布将诺贝尔化学奖颁发给美国科学家 Richard F.Heck和日本科学家 Ei-ichi Negishi,Akira Suzuki时,Heck所说的一句话——这是个圆满的结局——道出了所有人的心声。目前,钯催化的交叉偶联反应在全球的科研、医药生产、电子工业和先进材料等领域都有广泛应用。以在此领域有卓越贡献的科学家名字命名的有机反应对于从事化学的人来说是耳熟能详的,如 Heck反应、Negishi反应、Suzuki反应、Stille反应、Kumada反应、Sonogashira反应以及Hiyama反应等等。
众所周知,有机合成化学以其强大的生命力制造出了几千万种新的物质,并且这个数目仍在迅速的膨胀,而有机合成化学的基础核心是新型、高效有机合成方法学的研究和发展。我们从21世纪这10年来三次与有机合成方法学相关的诺贝尔化学奖授予情况可以看出这一领域的重要性:2001年W.S.Knowles,R.Noyori和K.B.Sharpless因在发展催化不对称合成研究方面获奖;2005年 Y.Chauvin,R.H.Grubbs和 R.R.Schrock因在发展烯烃复分解反应所作出的贡献而获奖;最后就是2010年的钯催化交叉偶联反应的获奖。下面对钯催化交叉偶联反应的早期研究、反应机理以及发展应用等做一个粗浅的介绍,以期达到抛砖引玉之作用。
1 早期研究
有机合成化学制造出的这几千万种新的物质绝大多数都是以碳原子为主来构建的。为了制备结构更复杂、功能更强大的新型材料,就要想办法通过各种化学反应将碳原子连接在一起。然而碳原子本身是十分稳定的,在化学反应中并不活泼,所以就得想办法来激活碳原子,让它更容易参与反应并与其他碳原子连接起来,逐步形成更高层次的碳基骨架。1912年,法国人Grignard因发明有机镁试剂(格氏试剂)而荣获诺贝尔化学奖,可以说是碳基活化史上的第一个里程碑。随着时代的发展,人们对碳基的研究愈加深入。在研究的前期,要么无法活化碳基,化合物难于参加反应;要么使碳原子过于活跃,虽然能有效地制造出很多简单的有机物,但要是合成复杂分子却有大量的副产物生成。正如大家所知,在有机合成操作中提纯是一项繁琐的工作。Heck,Negishi和Suzuki等人通过实验发现,当碳原子和钯原子连接在一起,会形成一种“温和”的碳钯键,在这里钯既活跃了碳基,又使其不至于过于活泼,然后又可以把别的碳原子吸引过来,这样使得两个碳原子距离拉近,容易成键而偶联起来。在这里钯原子就相当于“媒人”的作用,只需使用催化剂就行。所以“钯催化交叉偶联反应”就是一款精致的工具,让化学家得以像艺术家一样来雕刻和拼接类似积木的模块(小的基团),构筑令人叹为观止的艺术品(有机复杂分子)。与此同时还避免了过多不必要副产物的生成。
Heck 1931年出生于美国麻省斯普林菲尔德(Spri-ngfield)。1954年在美国加州大学洛杉矶分校(UCLA)获得博士学位,师从Saul Winstein教授。他现在是美国特拉华大学名誉退休教授。特拉华大学自2004年起,以Heck的名字命名了一个教授席位以显示对他所取得成就的尊重。2006年,Heck荣获 H.C.Brown创新合成方法研究奖。在这次获奖的三名科学家中,Heck是最早着手研究钯催化偶联反应的。20世纪60年代末,他就开始致力于在室温条件下苯基钯卤代物在烯烃原位上的加成反应。特别是在1968年,Heck在美国化学会会志(J.Am.Chem.Soc.)上以唯一作者发表一系列连续论文[1-7],介绍了钯催化下芳基汞化合物的偶联反应。1971年,日本化学家 Tsutomo Mizoroki在 Heck等人的研究基础上,对以往方法进行了改进,报道了乙酸钾作碱和氯化钯催化下,使用毒性较低的卤代芳烃(碘苯)与苯乙烯偶联为二苯乙烯的反应[8]。因此 Heck反应也称为Mizoroki-Heck反应。不幸的是,Mizoroki因癌症在1980年就英年早逝,这不得不说是科学界的一大损失,令人无限惋惜!1972年,Heck对Mizoroki的反应又做了改进,并将成果发表在当年的J.Org.Chem.上[9],是为“Heck反应”。具体来讲,Heck反应是由一个不饱和卤代烃(或三氟甲磺酸酯)和一个烯烃在钯催化和碱存在下生成取代烯烃的偶联反应(图1),它是一种均相催化反应,反应产物烯烃具有立体专一性、产率高,是形成碳-碳键的一个非常好的方法。可以说,Heck反应的出现是金属有机催化活化碳基的又一个里程碑。Heck反应自发现起,其在有机合成中的重要性逐步增长。1982年,Heck在 Organic Reactions上仅用45页,便总结了当时Heck反应的应用实例。但到2002年,发表在Organic Reactions上,仅与分子内 Heck反应相关的文章,就已达377页。现今,Heck反应是有机合成中构建碳-碳键的常用方法之一,也是日后发现众多钯催化反应的基础。曾被Heck研究的一个以炔烃为底物的偶联反应,1975年被日本化学家Sonogashira详细研究,他向反应液中加入亚铜盐以改进反应产率,取得较好的结果。这一偶联反应现称为Sonogashira偶联反应,亦是有机合成重要技术之一。在生物医学上,将荧光染料与DNA碱基偶联时用到的正是Sonogashira偶联反应,这对自动DNA测序和阐明人类基因组起到了重要的作用。
Negishi和Suzuki都是日本公民。Negishi 1935年出生,1963年从美国宾夕法尼亚大学获得博士学位,1979年起任教于美国普渡大学至今。他虽定居美国,但仍保持日本国籍。Suzuki于1930年出生,1959年从日本北海道大学获得博士学位,现为北海道大学名誉退休教授。他二人都曾师从著名诺贝尔奖获得者——普渡大学已故学者 H.C.Brown教授,所以Suzuki也算是Negishi的同门师兄了。在20世纪70年代初,Negishi就着手研究偶联反应的一些温和试剂,从最初的有机锆试剂和有机铝试剂到后来的有机锌试剂。现在所说的Negishi反应就是有机锌、锆、铝等化合物在零价钯催化下的芳基化、烯基化反应[10-11](图1)。目前,Negishi仍然活跃于科学研究的最前沿。例如最近他和他的学生王光伟博士等在J.Org.Chem.上以很长的篇幅报道了钯催化下偶联反应研究的进展[12]。Suzuki于1963年至1965年在Brown的实验室做博士后的时候正是硼氢化反应在Brown的实验室被发现后几年。Brown也正是因为硼氢化反应而获得1979年的诺贝尔奖。在这种背景下,Suzuki开始了大量有机硼试剂的研究,在20世纪70年代末证明了有机硼化合物在碱性条件和钯催化下能够与烯基卤和芳基卤偶联[13-14](图1)。Suzuki反应的产物也具有立体专一性,反应条件温和,醛、酮、酯、羟基等官能团均不受影响,这正是Suzuki反应的优势所在。

图1 钯催化交叉偶联反应的主要类型
2 反应机理简介
一个有机化学反应被发现后,接下来最重要的工作就是来探究它们的反应机理,搞清楚反应在微观层次上的实质,以便更好地调控反应。Heck,Negishi和Suzuki当初各自发现新的反应后更是毫不例外地花大工夫来探究它们的反应机理,这可以从他们的原始文献上获知。现在我们也扼要介绍一下Heck反应、Negishi反应和Suzuki反应的机理。
2.1 Heck反应
Heck反应以有机钯配合物为催化剂得到具有立体专一性的芳香代烯烃(图2)。反应物主要是卤代芳烃(碘、溴)与含有α-吸电子基团的烯烃。该反应的催化剂通常用Pd(0),Pd(II)或含Pd的配合物(常用醋酸钯和三苯基膦)。卤代烃首先与A发生氧化加成反应,C-X键的断裂与Pd-C和Pd-X键的形成是同步进行的。氧化加成反应是偶联反应中最常见的决速步骤,经过氧化加成化合物A生成中间体B,B再经过配体解离,得到化合物RPdL X。RPdL X先与烯烃配位,然后再经烯烃插入,配体配位得到中间体C。中间体 C的C-C键旋转,得到其构象异构体,从而可以进行β-消除反应,生成化合物D和目标产物——烃基化的烯烃。在碱性(如三乙胺)条件下,碱与化合物D生成具有催化活性的零价钯,完成整个催化循环反应。

图2 Heck反应机理
2.2 Negishi反应
Negishi反应的催化剂也是用具有催化活性的零价金属,如钯、镍等。反应整体上经历氧化加成、金属转移、还原消除等步骤(图3)。芳基卤代烃首先与零价钯发生氧化加成反应,得到中间体RPdX,卤化烃基锌 R′ZnX向中间体RPdX迁移,并进行金属转移得到 ZnX2和中间体RPdR′,中间体RPdR′经异构化得到顺式的络合物从而能很快地发生还原消除反应,得到化合物RR′,钯催化剂进入下一轮的催化。

图3 Negishi反应机理
2.3 Suzuki反应
溴代芳烃和碘代芳烃是Suzuki反应(图4)中常见的亲电试剂,当然也可以是三氟甲基磺酸酯、重氮盐等。芳基硼酸通常是由芳基锂或格氏试剂与烷基硼酸酯反应制得,芳基硼酸在空气中稳定,可以长期保存。Suzuki反应机理与Negishi反应类似,经历了三个过程:氧化加成、芳基阴离子向金属中心迁移和还原消除。卤代芳烃首先与Pd(0)进行氧化加成,得到ArPdX中间体,该中间体再与一分子碱作用得到中间体ArPdOH;另一分子的碱与硼酸作用得到硼酸盐,从而使得芳基具有更强的富电性,有利于芳基向ArPdOH中间体的金属原子迁移,一般来说,只有Pd(II)才能发生金属中心迁移。金属中心迁移作用是通过一个四员环过渡态(four-center intermediate)进行的。但是值得注意的是,一些反应的添加剂可以通过改变过渡态的结构加速金属中心迁移作用,例如碱可以加速Suzuki反应。在Ar′PdOH和ArB′OH的协同作用下,得到配合物中间体ArPdAr′,该中间体经过还原消除得到芳基偶联产物和零价钯,完成整个循环过程。
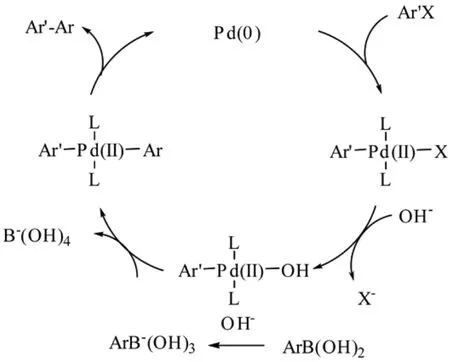
图4 Suzuki反应机理
3 偶联反应的应用
钯催化偶联反应有如下优点:可允许多种活性官能团存在,缩短反应步骤;副产物少,使得后处理变得容易;可与手性配体结合,催化不对称交叉偶联反应。这些优点决定了它潜在的应用价值。在基础科研领域,每个有机合成实验人员都会或多或少地用到钯催化的交叉偶联反应,各大化学期刊刊登这方面的文献近年来更是犹如雨后春笋;在实际工业领域,按瑞典皇家科学院的表述,钯催化的交叉偶联反应已广泛应用于制药、电子工业和先进材料等领域。实验室的基础科研成果不断地促进着工业的发展,工业的发展又反过来刺激基础科研的进步。也正因为钯催化交叉偶联反应是一项基础的研究,它的出现就像当年发明塑料一样将给现实社会带来革命性的变化。钯催化的偶联反应能使碳-碳键更容易的连接起来,而我们的这个世界有这么多的东西都需要碳基来连接,如各种药物、塑料和液晶、聚合物材料以及一些太阳能电池等先进功能材料等等。像有些天然产物,它们巨大的分子量令以往的科学家咋舌,但是当拥有这个精致的工具后,事情似乎就变得容易起来,如借助Suzuki反应,科学家们成功合成了水螅毒素(palytoxin)这个巨型分子(分子式C129H223N3O54)[15]。
Heck反应已经被用于抗炎药萘普生(图5左)、抗癌药物紫杉醇和哮喘药孟鲁司特等的大规模生产;最近,Scott及其合作者[16]以 Heck反应为基础,探索出了合成丙型肝炎病毒聚合酶抑制剂 HCVP-1的有效路径(图5右),其数量可达公斤级;另外,工业生产的肉桂酸酯类衍生物和防晒油中的主要成分桂皮酸盐都是通过Heck反应生产的。
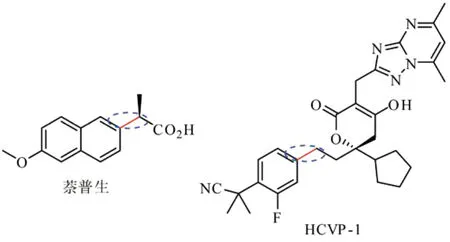
图5 Heck反应在药物合成中的两例应用 (椭圆内的化学键即为偶联处)
Negishi反应和Suzuki反应也都以各自的特点在药物合成和电子工业上发挥着重要的角色,它们的应用与日俱增。例如Jacks等人以数公斤级的量来制备内皮素拮抗剂Cl-1034[17],所用的关键步骤之一就是Suzuki偶联(图6右)。显然,偶联反应并不是独立的,它们相互补充,以发挥更大的潜力。尤其是在天然产物的全合成中,最终的目标产物就可能涉及多个偶联反应,例如在2010年的美国化学会会志(J.Am.Chem.Soc.)上报道的聚酮类天然产物似蛇霉素(Anguinomycin)的全合成就用到了两次Negishi反应和一次Suzuki反应[18](图6左)。

图6 Negishi反应和Suzuki反应应用实例(椭圆内化学键由Negishi反应生成,圆内化学键由Suzuki反应生成)
4 近年发展情况
经过了近40年的发展,钯催化的偶联反应取得了巨大的成就。其中重要的一环就是催化剂的不断改进。如今偶联反应的催化剂逐步形成了一定规模,由最初的富电子的含膦(磷)配体,逐步发展到了卡宾配体、含氮配体以及其他含杂原子配体。Pd(PPh3)4是通常采用的磷配体催化剂,其具有热稳定性好、不易分解等优点。后来又发展了许多新型双膦配体以及联苯结构的二烷基单膦配体,配体的存在大大提高了催化效率。氮杂卡宾是具有两电子给予体的中性优良有机配体,它们具有较高的富电子性、稳定性和配位性,常常作为有机膦配体的替换物,已经被成功地用在了芳卤与胺、有机镁、有机锡以及有机硼的偶联反应中。近年来人们对环钯化合物也进行了广泛的研究,其在偶联反应中也表现出良好的催化活性。对于 Heck反应,除了Pd可以作催化剂,Ni也可以用做催化剂,它的反应活性高于钯,但反应的选择性不如钯,但是好于铑、钌、钴、铂等催化剂。相较于价格昂贵的贵金属钯,镍具有廉价易得等优点,作为催化剂成本较低,易于实现工业化,因此对镍催化的偶联反应的研究更具有现实意义,目前就有许多课题组在从事Ni催化偶联反应的研究。
Heck反应、Suzuki反应和Negishi反应作为芳香卤代烷(硼酸酯,有机锌)和含有α-吸电子基团的烯烃的偶联反应是当今有机合成中构成C-C键的重要反应,并已得到了广泛的应用。前两种偶联反应通常需要过渡金属钯的催化以及有机膦配体的辅助作用,由于钯催化剂比较昂贵,同时有机膦化合物不易重复使用,一定程度上限制了其在工业上应用。近年来,将贵金属钯和膦配体负载于无机或有机高分子材料上,使得催化剂既可以保持催化活性又能够较好的回收利用,催化剂的重复使用可以大大降低生产成本,从而使得这类精细有机合成能得到更广泛的工业化应用。另外,近年来C-C偶联反应的概念也被用于合成更多的X-Y偶联反应,如很多科学家将C-C偶联反应应用到C-O,C-N键的形成,很大程度上促进了偶联反应的发展。其中在钯催化交叉偶联反应基础上发展起来的碳氢键活化是近年来发展迅速的热门领域。碳氢键的直接官能团化反应由于具有多种突出的优点以及很大的挑战性,吸引越来越多科学家的关注。
“综合所得是一项涉及整个征管模式上改进的问题,哪些要计入综合所得,为何计入综合所得?这些都需要考虑。而且还涉及到对应的群体利益的问题,以及汇算清缴、申报核对等问题,这也是改革迟迟没有推进的原因。”刘剑文向记者表示。
近年来,钯催化的偶联反应在中国也得到了迅速发展。中国科学院上海有机化学研究所的陆熙炎院士和戴立信院士对钯催化偶联反应研究做出了突出贡献(编者注:戴院士曾为我刊撰文介绍2005年诺贝尔化学奖“烯烃复分解反应”),他们发表的论文被国内外科学家大量引用。还有许多年轻科学家如麻生明院士、施章杰教授等在钯催化偶联反应方面也获得很大的成就,得到了国内外同行学者的认可。
5 后 记
以Heck反应、Negishi反应和Suzuki反应为代表的钯催化交叉偶联反应经过不断发展,正在催生出新的方法学,对有一个世纪之久的Grignard反应作出一个新的挑战。相比于Grignard反应,钯催化的偶联反应更加精细。更重要的是这些方法之间可以相互弥补,人们可以设计出更加令人满意的路线,从而更加方便地得到需要的化合物。未来的发展将有以下几个方面:寻找更好的催化剂来实现偶联反应的绿色性和原子经济性;如何获得更多可以应用钯催化的偶联反应的卤代烃和烯烃;将C-C偶联反应的概念应用于更多的其他原子间的偶联反应。纵观所有钯催化的偶联反应的实例,它们的应用相对还是十分有限的,因而还需要进一步的发展来扩大偶联反应在工业上的应用,让实际的生产生活受益更大。我们相信钯催化交叉偶联反应前方的道路还十分宽敞,它的前景必定更加辉煌!
另外,我们从这次获奖情况可以看到,不经过艰苦卓绝和锲而不舍的努力,是无法攀上科学的高峰的,三位科学家不管在什么条件下,都是在自己的实验室里数十年如一日地辛勤工作,最终都默默地做到了极致。如今Negishi教授仍在科学的道路上笔耕不辍,值得我们深刻思考和学习。再就是要树立远大的志向,如Negishi教授在接受 Science采访时说:“在半个世纪前(宾夕法尼亚大学学习期间)我就梦想获得这个奖。”可以说这次他们获奖是一个迟到的荣誉,更是一个圆梦的结局。诺贝尔奖是对全球科学家的一个表彰和认证,它并不是高不可及,这就要求我们少一分浮躁,多一分脚踏实地,共同来营造一个好的科研氛围,以便早日有中国人能够摘此桂冠!
在准备此论文时,我们也发现 Angew.Chem.Int.Ed.上,也以Highlight形式对2010年诺贝尔化学奖进行了点评,该文写的短小精悍,值得有兴趣的读者查阅[19]。
致谢:在撰写本文期间,笔者有幸与Negishi教授的学生王光伟博士当面交流,他提出了许多宝贵的意见并提供了相关的有价值的材料,在这里对他表示诚挚的感谢;同时我们也感谢南京大学吴有庭教授的帮助!
(2010年11月16日收到)
[1]HECK R F.Acylation,methylation,and carboxyalkylation of olefins by group VIII metal derivatives[J].J Am Chem Soc,1968,90:5518-5526.
[2]HECK R F.The arylation of allylic alcohols with organopalladium compounds.A new synthesis of 3-aryl aldehydes and ketones[J].J Am Chem Soc,1968,90:5526-5531.
[3]HECK R F.Allylation of aromatic compounds with organopalladium salts[J].J Am Chem Soc,1968,90:5531-5534.
[4]HECK R F.The palladium-catalyzed arylation of enol esters,ethers,and halides.A new synthesis of 2-aryl aldehydes and ketones[J].J Am Chem Soc,1968,90:5535-5538.
[6]HECK R F.The addition of alkyl-and arylpalladium chlorides to conjugated dienes[J].J Am Chem Soc,1968,90:5542-5546.
[7]HECK R F.A synthesis of diaryl ketones from arylmercuric salts[J].J Am Chem Soc,1968,90:5546-5548.
[8]MI ZORO KI T,MORI K,O ZA KI A.Arylation of olefin with aryl iodide catalyzed by palladium[J].Bull Chem Soc Jpn,1971,44:581-581.
[9]HECK R F,NOLL EYJ P.Palladium-catalyzed vinylic hydrogen substitution reactions with aryl,benzyl,and styryl halides[J].J Org Chem,1972,37:2320-2322.
[10]KING A O,O KU KADO N,NEGISHI E I.Highly general stereo-,regio-,and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides[J].J Chem Soc,Chem Commun,1977:683-684.
[11]NEGISHI E I.Palladium-or nickel-catalyzed cross coupling.A new selective method for carbon-carbon bond formation[J].Acc Chem Res,1982,15:340-348.
[12]NEGISHI E I,WANG G W,RAO H H,et al.Alkyne elementometalation-Pd-catalyzed cross-coupling.Toward synthesis of all conceivable types of acyclic alkenes in high yields,efficiently,selectively,economically,and safely:“Green Way”[J].J Org Chem,2010,75:3151-3182.
[13]MI YAURA N,YAMADA K,SU ZU KI A.A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides[J].Tetrahedron Lett,1979,20:3437-3440.
[14]MI YAURA N,SU ZU KI A.Stereoselective synthesis of arylated(E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst[J].J Chem Soc,Chem Commun,1979:866-867.
[15]SU H E M,KISHI Y.Synthesis of palytoxin from palytoxin carboxylic acid[J].J Am Chem Soc,1994,116:11205-11206.
[16]CAMP D,MATTEWS C F,NEVILL E S T,et al.Development of a synthetic process towards a hepatitis C polymerase inhibitor[J].Org Process Res Dev,2006,10:814-821.
[17]JACKS T E,BELMONT D T,BRIGGS C A,et al.Development of a scalable process for CI-1034,an endothelin antagonist[J].Org Process Res Dev,2004,8:201-212.
[18]BONA ZZI S,EIDAM O,GU TTINGER S,et al.Anguinomycins and derivatives:Total syntheses,modeling,and biological evaluation of the inhibition of nucleocytoplasmic transport[J].J Am Chem Soc,2010,132:1432-1442.
[19]WU X F,ANBARASAN P,NEUMANN H,et al.From noble metal to Nobel Prize:palladium-catalyzed coupling reactions as key methods in organic synthesis[J].Angew Chem Int Ed,2010,49:2-6.
(责任编辑:温文)
Palladium-Catalyzed Cross-Coupling Reactions:A Brief Introduction to the Nobel Prize in Chemistry 2010
XIAO Tang-xin①,LIU Li②,JIAN G Ju-li③,WAN G Le-yong④
①②Ph.D.Candidate,③Ph.D.,④Professor,School of Chemistry&Chemical Engineering,Nanjing University,Nanjing 210093,China
On Oct 6th,2010,the Royal Swedish Academy of Sciences announced that the Nobel Prize in chemistry for 2010 was awarded jointly to an American scientist Richard F.Heck and two Japanese scientists Ei-ichi Negishi and Akira Suzuki for their great contributions to palladium-catalyzed cross-coupling.It provides one of the most sophisticated tools available to chemists to create complicated organic molecules.This tool has been widely used in pharmaceuticals,electronics industry,and advanced materials.A brief introduction for palladium-catalyzed cross-coupling was presented in this paper.
palladium-catalyzed,cross-coupling reaction,Nobel Prize in Chemistry
10.3969/j.issn 0253-9608.2010.06.005

