剖析乙肝病毒的包膜
——乙肝表面抗原的生物学功能及其致病机制
田晓晨 闻玉梅
①讲师,②中国工程院院士,复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海200032
剖析乙肝病毒的包膜
——乙肝表面抗原的生物学功能及其致病机制
田晓晨①闻玉梅②
①讲师,②中国工程院院士,复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海200032
乙型肝炎病毒 表面抗原 病毒受体 致病机制
乙肝表面抗原作为病毒的包膜蛋白,在病人体内大量存在,甚至远远超过成熟病毒颗粒的含量。这表明表面抗原在乙肝病毒感染过程中具有特殊的作用,在乙型肝炎发病机制中扮演了重要的角色。笔者介绍了乙肝表面抗原在乙肝持续性感染致病机制方面的最新研究进展。
自1965年美国科学家Blumberg博士首次在澳大利亚土著人血清中发现“澳大利亚抗原”,并确定其为乙型肝炎的病毒标志物以来,人类与乙型肝炎病毒(hepatitis B virus,HBV)的斗争已经持续了40余年。在这40多年里,科学家将乙肝病毒层层剖开,利用分子生物学和免疫学的手段对乙型肝炎的发病机制和临床表现进行了广泛的研究,在乙肝病毒的预防和治疗方面都有了深入的认识和重大的突破。尽管如此,乙肝病毒感染仍然是目前最为严重的健康问题之一。据世界卫生组织估计,全世界累计有20亿人口曾受 HBV感染,约有3.5亿人口现行慢性感染,每年新增感染约500万人。在如此庞大的感染人群中,每年有约100万人死于包括慢性活动性肝炎(chronic active hepatitis)、肝硬化(liver cirrhosis)及原发性肝癌(primary liver cancer)等在内的各类由乙肝病毒感染引起的肝脏疾病[1-2]。中国是乙肝病毒感染的高危区,尽管乙肝疫苗的广泛接种已经有效地控制了乙肝病毒的传播,但是仍有非常庞大的感染群体,据估计全国有1.2亿人长期携带乙肝病毒,其中慢性乙肝病人2000万。乙肝病毒感染严重危害了人类的健康,同时也引发了一系列社会和经济的问题,是中国现阶段最为突出的公共卫生问题之一。目前,市场上已经有了包括干扰素、核苷类似物在内的一系列抗病毒药物,但是由于耐药性、药物毒性以及适应症等问题的存在,现有的治疗手段仍然无法彻底地清除病毒,解除病人痛苦。因此,对于乙肝病毒的研究,尤其是病毒致病机制研究以及新型抗病毒药物的开发仍然任重而道远。
1 乙肝病毒的生物学特性
1.1 乙肝病毒的基因组结构
乙肝病毒属于嗜肝DNA病毒科(hepadnaviridae),是一个带有包膜的DNA病毒,完整的病毒颗粒大小约为42 nm,具有独特的基因组结构和生物学特性。其基因组为松弛环型部分双链DNA(relaxed circular partial double stranded DNA),具有一条全长的负链和一条不完全封闭的正链(图1)。HBV基因组长度为3.2 kb,共编码7个蛋白,分别为由包膜蛋白基因(preS1/preS2/S-ORF)编码的三个表面抗原(hepatitis B surface antigen,HBsAg),大蛋白(L HBs,L)、中蛋白(MHBs,M)以及主蛋白(SHBs,S);由衣壳蛋白基因(preC/C-ORF)编码的核心抗原(hepatitis B core antigen,HBcAg)和e抗原(hepatitis B e antigen,HBeAg);由聚合酶基因(P-ORF)编码的带有反转录酶功能的聚合酶蛋白(polymerase);以及由X基因(X-ORF)编码的 X蛋白(hepatitis B x protein,HBx)。
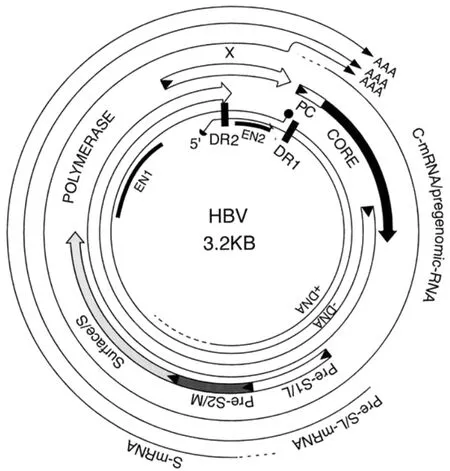
图1 乙肝病毒基因组结构示意图[3]
1.2 乙肝病毒复制周期
HBV在细胞内的复制过程较为复杂,最主要的特征是其基因组的复制要经过由RNA中间体到DNA的这样一个逆转录过程。
成熟病毒颗粒侵入人体以后,在细胞表面未知受体的介导下进入肝脏细胞,病毒包膜与细胞膜发生融合,病毒核衣壳被释放入细胞中。在细胞质中,病毒进一步将衣壳蛋白脱去,暴露出松弛环状的DNA基因组,并将其转运入细胞核。随后,在细胞DNA聚合酶的作用下,松弛环状的DNA基因组被修复成为共价闭合环状DNA(covalently closed circular DNA,cccDNA),并以此作为病毒基因组复制以及转录的模板,转录出包括病毒前基因组RNA(pregenomic RNA,pgRNA)在内的一系列基因组和亚基因组产物。随后病毒利用宿主细胞的蛋白翻译系统将亚基因组转录产物翻译为病毒的包膜蛋白、核心蛋白、e抗原、X蛋白以及聚合酶蛋白。新合成的病毒衣壳蛋白将病毒pgRNA与病毒聚合酶蛋白包裹在一起组装成核衣壳,并在病毒核衣壳中启动反转录过程,以pgRNA为模板,在病毒反转录酶的作用下,合成子代病毒基因组。当反转录过程完成后,病毒核衣壳会在细胞的内质网中包裹病毒包膜蛋白,然后通过细胞的囊泡运输系统分泌到细胞外,产生新的病毒,开始新一轮的感染。
1.3 乙肝病毒感染的特性
研究发现HBV除了通过上述的复制周期产生成熟的病毒颗粒(Dane particle)以外,还能合成并分泌大量的亚病毒颗粒(图2)。这些亚病毒颗粒直径在22 nm,形状为球形或管状,不包含病毒基因组和衣壳蛋白,主要由病毒的包膜蛋白以及宿主细胞来源的脂质成分组成。在HBV感染病人的血清中,HBsAg亚病毒颗粒的含量远远超过Dane颗粒,血清浓度能达到1012/mL,是Dane颗粒的10000到1000000倍。甚至在检测不到病毒DNA的情况下,HBsAg仍能持续大量存在。这种独特的现象是乙肝病毒所特有的,迄今尚未在其他病毒中发现,这提示表面抗原在HBV感染过程中具有特殊的作用,在乙型肝炎发病机制中扮演了重要的角色。然而到目前为止,我们仍然不清楚如此大量且持续性的病毒包膜蛋白表达究竟有何生物学意义,对其在病毒感染和肝炎发病机制中的作用也知之甚少,而且 HBsAg的血清清除也是当前临床治疗的一个难点。

图2 乙肝病毒颗粒的电镜照片[4]
2 乙肝表面抗原的研究现状
目前,在乙肝病毒领域里,最重要也最迫切需要解决的问题有以下几个方面:第一、乙肝病毒的细胞受体究竟是什么?第二、乙肝的慢性化机制,病毒是如何逃逸机体免疫系统建立免疫耐受状态的?第三、慢性乙肝的致病机制,持续感染的病毒是如何影响机体功能?第四、如何能够打破免疫耐受,增强免疫应答,从而清除病毒。所有这些问题都与表面抗原有着千丝万缕而又紧密的关系。因此对于表面抗原的研究就显得格外重要。
尽管从病毒学、细胞生物学以及免疫学等不同角度出发,已经对 HBsAg的结构和生物学功能有了一定程度的认识,但是对于 HBsAg持续表达的机制及其对宿主细胞功能的影响,以及其在乙肝病毒致病机制中的作用,仍然缺乏全面而深入的认识。据推测,过量的 HB-sAg可能起到了结合HBV中和抗体anti-HBs的作用,从而帮助感染性病毒颗粒逃避宿主免疫系统的监控并建立持续性感染[5]。此外,有报道认为 HBsAg能模拟凋亡细胞的特征并与机体的凋亡细胞清除系统相互作用从而阻止获得性免疫反应的发生[6]。迄今为止,尚无充分的实验证据支持这些理论推测。HBsAg的生物学功能及其在乙肝持续性感染中发挥的作用仍需要进一步的深入研究。
笔者所在的实验室从事乙肝病毒研究已有二十余年,尤其在乙肝慢性化机制以及表面抗原生物学功能方面做了系统的工作并取得了一定的成果。现将实验室近年来在乙肝表面抗原方面的最新进展作一介绍。
2.1 表面抗原与细胞表面受体
从病毒颗粒的结构来看,HBV表面抗原位于病毒颗粒的最外层,是病毒与细胞相互作用的前哨,它们与细胞表面的受体结合,介导了病毒的吸附与侵入。迄今为止,肝细胞表面受体的蛋白本质研究始终是HBV研究中的难点,是难以突破的瓶颈和障碍。
近年来,越来越多的实验证据表明乙肝表面抗原的PreS1功能域中的21-47位多肽表位才是病毒包膜蛋白与细胞表面受体吸附结合的最主要区域。研究表明有很多细胞表面蛋白能与PreS1功能域结合,并与 HBV的感染有关,比如,IgA受体、白介素6(interleukine 6,IL-6)、3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPD)、无涎糖蛋白受体(asialoglycoprotein receptor)、Serpin家族的SCCA21蛋白、金属蛋白酶以及一些其他的细胞表面糖蛋白都曾被认为是HBV的细胞受体。谢幼华教授也在乙肝病毒受体方面进行了系列的研究工作[7]。以 HBV的PreS功能域为靶标,用噬菌体表面随机展示技术高通量筛选能够特异性结合PreS区段并且具有高亲和力的短肽。对筛选得到的特异性结合短肽的序列特征进行系统分析发现,这些短肽主要结合在PreS1的21-47区段,而且这些短肽序列中与结合相关的关键性氨基酸保守序列为-W1T2X3W4W5-。进一步以此序列为模板,搜寻具有类似一级结构特征的蛋白,发现脂蛋白脂肪酶(lipoprotein lipase,LPL)可能是一个潜在的HBV结合蛋白。这一发现提出了一个新的感染模型,HBV病毒粒子在肝外结合于血液循环中游离的LPL蛋白,由LPL作为载体向肝脏转运,在肝细胞表面LPL结合蛋白或者其他分子的协同作用下,促进HBV在细胞上的粘附和侵入。LPL蛋白在HBV感染过程中可能发挥了“桥梁”的功能。
进一步的研究发现,鉴于PreS1的21-47区段在病毒感染过程中的重要作用,这些短肽以及HBV结合蛋白可以成为药物干预的重要靶点。PreS1的特异性结合短肽可以在体外培养细胞系统中阻断表面抗原与细胞的结合,从而抑制病毒的感染。在此基础上我们可以构建基于PreS和短肽相互作用的药物筛选体系进行小分子抑制剂筛选,并进一步在培养细胞和小鼠、树鼩等感染模型中验证短肽和小分子抑制剂对HBV感染靶细胞的抑制作用。这将在开发新型抗病毒药物方面具有十分重要的价值。
虽然已经认识到病毒表面抗原是与细胞表面受体结合的最重要的部位,而且到目前为止已报道了很多可能起作用的病毒受体,但由于缺乏有效的体外感染系统,仍无法确定到底是哪一个受体起决定性作用。乙肝病毒表面抗原与细胞受体的相互作用是一个非常复杂的过程,病毒包膜蛋白上可能包含有不止一个结合位点,而细胞表面也可能存在多个受体以及辅助蛋白,在它们的共同作用下,病毒才能成功地感染细胞。
2.2 表面抗原与机体免疫应答
当乙肝病毒侵入人体,感染肝脏细胞以后,机体的免疫系统就开始发挥作用,努力清除病毒。通常情况下,免疫系统足够强大,能战胜病毒并将其清除,成功抵御并击退乙肝病毒的入侵,而且免疫系统还能产生特异性针对HBV的抵抗力,包括保护性抗体(针对表面抗原的抗体)以及特异性的细胞免疫。免疫系统建立起保护我们身体健康的防线,避免我们再次感染。然而一旦机体的免疫系统由于这样那样的原因,无法消灭病毒,乙肝病毒就将在体内长期存在,最终发展成为慢性肝炎,持续危害我们的健康。事实上在成人中,约有10%的乙肝病毒感染者会由于无法完全清除病毒而最终发展成为持续性感染(图3),而在儿童中,由于免疫系统尚未发育完全,这一比例更高,经历母婴传播这一途径的婴儿感染者中,90%以上会发展成为慢性肝炎。已有的研究表明机体免疫功能低下,尤其是对乙肝表面抗原的免疫耐受是引起乙肝感染慢性化的重要原因。因此,如何打破免疫耐受状态,增强免疫应答反应,重建有效地针对HBV的免疫功能就成为乙肝慢性化治疗中一个及其重要而且长盛不衰的话题。

图3 乙肝感染后肝脏疾病发展进程
国际上有包括法国巴斯德研究所在内的多个科研机构正从事相关的研究工作,中国第三军医大学的吴玉章教授应用分子模拟的方法设计了新型的抗原表位,并以此来刺激机体的免疫系统,以希望达到清除病毒的目的。本实验室闻玉梅院士课题组长期从事乙肝免疫耐受机制研究,在这方面做了大量的工作。我们将重组表达的乙肝表面抗原与针对表面抗原的抗体组成免疫复合物型治疗性疫苗(YIC),多年的实验研究发现其对乙型肝炎治疗有效。在转基因鼠等动物模型中,免疫复合物可以有效的增强抗原递呈效果,逆转对病毒的免疫耐受性。随后已完成的IIA和IIB临床试验结果表明,60 μg疫苗治疗组与对照组 HBeAg的转阴率分别为21.8 %(17/78)和 9%(7/78),两者之间有显著差异(P=0.03),而且60μg疫苗治疗组中41.8%的患者HBV DNA下降超过2个log,其中22.4%患者 HBV DNA低于103拷贝/mL[8-9]。研究表明:抗原-抗体免疫复合物型治疗性疫苗的作用机制可能为抗原与抗体作用后凝集成较大的分子颗粒,而后免疫复合物借助抗体的Fc片段与抗原提呈细胞表面的相应受体结合,从而改变了抗原的提呈与加工过程,使得表面抗原更容易被捕获、加工、递呈,从而刺激免疫系统产生免疫应答反应,消除免疫耐受。进一步的研究发现,抑制性的 Fcγ受体IIB介导的细胞免疫调节功能可能是治疗性疫苗发挥作用的分子机制之一。
尽管免疫复合物型治疗性疫苗在慢性乙肝治疗方面的应用前景已经初见端倪,但是对于疫苗打破免疫耐受的具体作用机制仍然值得进一步研究。
2.3 表面抗原与乙肝致病机制
与很多病毒不同,乙肝病毒并不表现直接的细胞毒性作用,也就是说乙肝病毒感染造成的肝脏损伤并不是由病毒直接引起,乙肝病毒的复制相对比较温和,不会直接对肝细胞造成很大的破坏。对于乙肝病毒感染的致病机制,学界一般认为,肝脏的炎症损伤是由于机体的免疫系统持续攻击感染病毒的肝脏组织所造成。乙肝病毒侵入并感染肝细胞后,被免疫系统识别,激活的免疫系统为了清除病毒,就会产生大量的特异性以及非特异性的免疫细胞和免疫分子,攻击病毒以及病毒所感染的肝脏细胞。病毒感染的最终命运取决于两者相互较量的结果。如果免疫系统力量较强,则会在与病毒的斗争中取胜,最终清除病毒恢复健康。如果相反免疫系统由于种种原因力量不足,那么其与病毒的斗争就会处于下风,无法清除病毒,病毒长期存在于人体内,长此以往就会发展成为慢性肝炎,而且在这种情况下,免疫系统会以一种低水平的方式持续的攻击肝脏,从而造成一种长期的慢性的肝脏炎症损伤。
那么,乙肝病毒究竟是通过什么样的致病机制来引起炎症反应的呢?笔者所在实验室最近的研究工作揭示了由表面抗原引起的新的致病机制[10-11]。我们的研究发现,表面抗原的表达能促进一种名为亲环素A(cyclophilin A,CypA)的细胞蛋白的分泌。在体外培养细胞、HBV转基因小鼠模型以及慢性乙肝病人体内均发现表面抗原能够特异性的促进CypA由细胞内向细胞外的分泌。进一步的研究表明表面抗原与CypA之间具有直接的蛋白-蛋白相互作用,借助这种相互作用两者结合在一起,并通过共用的囊泡分泌途径转运至胞外。HBsAg促进的CypA分泌有什么样的生物学意义呢?CypA是一个多功能的细胞蛋白,在不同的微环境中发挥不同的作用。当CypA在表面抗原作用下分泌至肝脏细胞外后,起到了趋化因子的功能,借助细胞表面受体CD147的作用下将巨噬细胞、T细胞等免疫细胞吸引至感染的细胞周围并引起局部的炎性浸润。如果使用CypA的抑制剂或者CD147的抗体阻断CypA的趋化功能后,HBV感染引起的炎症反应则明显好转。这一结果表明HBsAg诱导分泌的CypA在乙肝炎症反应中起到了重要的作用。
表面抗原对机体的影响并不仅限于CypA蛋白,HBsAg的表达分泌对很多细胞正常生理功能都有显著的影响。利用基因芯片技术和蛋白质组学的方法对表面抗原的生物学功能进行了系统的分析,发现包括糖代谢和脂类代谢、细胞的生长和凋亡、细胞骨架和细胞外基质的形成以及一些细胞内重要信号转导通路在内的许多细胞功能都受到了不同程度的影响。HBsAg的持续性表达使得机体胆固醇合成增强、糖酵解途径受到抑制而糖原生成作用加强。机体物质和能量代谢水平发生改变造成微环境相对不稳定,使得机体极易受外界因素干扰而发生功能的改变[12]。HBsAg引起细胞内包括GRP78在内的一系列胞内凋亡相关蛋白含量变化,从而促进肝细胞的凋亡[13]。HBsAg还能通过调控转录因子L EF-1影响Wnt信号通路的激活,从而在肝癌的发生发展过程中起到重要的作用[14-15]。
3 小结与展望
作为乙肝病毒的包膜蛋白,表面抗原在病毒生活周期中起到了非常关键的作用。在病毒的复制过程中,表面抗原影响或者干扰了宿主细胞很多重要的生理功能,与疾病的发生发展密切相关。作为最早被发现的病毒蛋白,对表面抗原的研究已经超过了40年,然而对于表面抗原的生物学功能依然知之甚少。究竟是什么细胞生理机制支持表面抗原的持续性表达和分泌?表面抗原的大量表达又会对细胞正常生理功能产生什么样的影响?表面抗原在乙肝致病机制中究竟扮演了什么样的角色?这些问题是表面抗原研究中最重要的课题。正是为了探索这些问题的答案,我们从基础理论研究及转化型研究两个方面持续地进行着研究。我们相信在不断分析问题、解决问题的过程中,最终将全面解析乙肝表面抗原在致病机制中的作用并将可研制出新的抗乙肝病毒与清除乙肝表面抗原的有效药物,造福于人类。
(2010年8月11日收到)
[1]KAO J H,CHEN D S.Global control of hepatitis B virus infection[J].Lancet Infect Dis,2002,2:395-403.
[2]OCAMA P,OPIO C K,L EE W M.Hepatitis B virus infection:current status[J].Am J Med,2005,118:1413.
[3]SEEGER C,MASON W S.Hepatitis B virus biology[J].Microbiol Mol Biol Rev,2000,64:51-68.
[4]WHO.Hepatitis B[M/OL].[2010-09-08].http://www.who.int/csr/disease/hepatitis/HepatitisB_whocdscsrlyo2002_2.pdf.
[5]REHERMANN B,NASCIMBENI M.Immunology of hepatitis B virus and hepatitis C virus infection[J].Nat Rev Immunol,2005,5:215-229.
[6]VANLANDSCHOOT P,L EROU X-ROELS G.Viral apoptotic mimicry:an immune evasion strategy developed by the hepatitis B virus?[J].Trends Immunol,2003,24:144-147.
[7]DENG Q,ZHAI J W,MICHEL M L,et al.Identification and characterization of peptides that interact with hepatitis B virus via the putative receptor binding site[J].J Virol,2007,81:4244-4254.
[8]YAO X,ZHENG B,ZHOU J,et al.Therapeutic effect of hepatitis B surface antigen-antibody complex is associated with cytolytic and non-cytolytic immune responses in hepatitis B patients[J].Vaccine,2007,25:1771-1779.
[9]XU D Z,ZHAO K,GUO L M,et al.A randomized controlled phase IIb trial of antigen-antibody immunogenic complex therapeutic vaccine in chronic hepatitis B patients[J].PLoS ONE,2008,3:e2565.
[10]TIAN X,ZHAO C,ZHU H,et al.Hepatitis B virus(HBV)surface antigen interacts with and promotes cyclophilin a secretion:possible link to pathogenesis of HBV infection[J].J Virol,2010,84:3373-3381.
[11]ZHAO C,FANG C Y,TIAN X C,et al.Proteomic analysis of hepatitis B surface antigen positive transgenic mouse liver and decrease of cyclophilin A[J].J Med Virol,2007,79:1478-1484.
[12]任军,赵超,方彩云,等.乙型肝炎表面抗原阳性转基因小鼠肝组织基因表达谱及蛋白组学的初步研究[J].微生物与感染,2006,1:7-14.
[13]ZHAO C,ZHANG W,TIAN X,et al.Proteomic analysis of cell lines expressing small hepatitis B surface antigen revealed decreased glucose-regulated protein 78 kDa expression in association with higher susceptibility to apoptosis[J].J Med Virol,2010,82:14-22.
[14]TIAN X,ZHAO C,REN J,et al.Gene-expression profiles of a hepatitis B small surface antigen-secreting cell line reveal upregulation of lymphoid enhancer-binding factor 1[J].J Gen Virol,2007,88:2966-2976.
[15]TIAN X,LI J,MA Z M,et al.Role of hepatitis B surface antigen in the development of hepatocellular carcinoma:regulation of lymphoid enhancer-binding factor 1[J].J Exp Clin Cancer Res,2009,28:58.
(责任编辑:沈美芳)
Dissection of HBV Envelope:Recent Progress on Biological Function and Pathogenesis of Hepatitis B Surface Antigen
TIAN Xiao-chen①,WEN Yu-mei②
①Lecturer,②CAE Member,Key Laboratory of Medical Molecular Virology,Shanghai Medical College,Fudan University,Shanghai 200032,China
As the envelope protein of hepatitis B virus,surface antigen typically outnumbers the mature virions by a factor of 10000-to 1000000-fold in HBV infected patients.This unique phenomenon indicates that HBsAg plays an important role in HBV infection and pathogenesis of the disease.In this review,recent progress on pathogenic mechanisms of HBV persistent infection was discussed in detail.
HBV,HBsAg,receptor,pathogenic
10.3969/j.issn 0253-9608.2010.06.002

