养殖场饲养鸡对苯并[a]芘的摄入、排泄和积累
杨意峰,周东旭,礼晓,杨宇,王文涛,沈国锋,王戎,王斌,陶澍
北京大学城市与环境学院地表过程分析与模拟教育部重点实验室,北京100871
养殖场饲养鸡对苯并[a]芘的摄入、排泄和积累
杨意峰,周东旭,礼晓,杨宇,王文涛,沈国锋,王戎,王斌,陶澍*
北京大学城市与环境学院地表过程分析与模拟教育部重点实验室,北京100871
在北京市郊区一家中等规模养鸡场采集了不同品种和不同生长阶段的饲养鸡的肌肉和内脏样品,并同步采集了鸡蛋、饲料、粪便和大气样品,测定了其中苯并[a]芘的浓度,据此分析了苯并[a]芘在饲养鸡体内的积累、排泄和代谢的动态过程.结果显示,饲养鸡体内各组织苯并[a]芘的湿重浓度在0.024~0.15ng·g-1之间,肌肉中的浓度显著低于其它组织;饲料和粪便中的浓度显著高于体内各组织浓度.饲养鸡体内摄入的苯并[a]芘约60%在体内代谢,约三分之一直接排泄进入粪便,仅有少量残留在体内如表皮、肌肉和其他器官中.肌肉、肝脏和胃中苯并[a]芘浓度和总累积量的动态变化规律不尽相同.北京居民摄食类似鸡肉导致的对苯并[a]芘的暴露量较春、秋、冬季呼吸暴露量低两个量级,与夏季呼吸暴露量相当.
苯并[a]芘;鸡;吸收;代谢
1 引言(Introduction)
由于具有确认的强致突变性,苯并[a]芘是多环芳烃中最受关注的化合物(Charles et al.,2000;Ramesh et al.,2004),许多环境标准也以苯并[a]芘代表多环芳烃类污染(WHO,2000;IPCS,1998).与其他多环芳烃化合物一样,除自然成因外,苯并[a]芘主要来自化石燃料或生物质的不完全燃烧.虽然与其他已列入持久性有机污染物公约的化合物不同,多环芳烃不具有生物富集能力(Wan et al.,2007),但由于其持续排放量大,在各种环境介质中污染严重(Guo et al.,2003;Wang et al.,2004;Xu et al.,2006),人群对多环芳烃的暴露风险往往高于其他持久性有机污染物.
我国是多环芳烃排放密度最高的国家之一,目前排放总量占全球排放的五分之一以上,且其中包括苯并[a]芘在内的高环致癌化合物比例高于发达国家(Zhang and Tao,2009).正因为如此,我国居民面临相当高的暴露风险.相关研究估计,中国居民多环芳烃呼吸暴露的人群肺癌归因分数在1.6%左右(Zhang et al.,2009).事实上,对非职业人群而言,呼吸暴露只占人群对多环芳烃暴露的一小部分,进入人体的多环芳烃更多来自食物.据估计,通过膳食摄入的多环芳烃占总环境暴露量的70%~90%(Phillips,1999;李新荣等,2009).如果考虑高环多环芳烃的弱挥发性,包括苯并[a]芘在内的高环多环芳烃的摄食暴露的比例可能更高.
由于在环境中无处不在,常见的食物种类,如谷物、蔬菜、鱼和肉类均有不同程度的多环芳烃污染.其中植物类食物中多环芳烃的积累直接源于环境(空气或土壤),故比较容易通过过程模型进行定量模拟.相比之下,动物类食物中多环芳烃来源复杂,它们既可以直接来自环境,也可能通过饲料间接摄取,因此很难在从环境到暴露的整体过程模型中定量描述.迄今为止,我们关于饲养动物对多环芳烃的富集过程了解甚少.本研究即以北京郊区的一家养鸡场为例,通过系统采样和测定,深入剖析鸡在饲养过程中对苯并[a]芘的摄入,以及苯并[a]芘在鸡体内的积累、排泄和代谢的动态过程,为全面认识多环芳烃在饲养动物体内的行为特征以及定量预测环境中多环芳烃对人体健康的影响积累基础资料.
2 材料与方法(Materials and methods)
2.1 样品采集
样品于2006年6月采集于北京市大兴区一家现代化中等规模养鸡场.采集样品包括四种饲养鸡、鸡蛋、鸡粪和养鸡场空气.采集的饲养鸡包括麻鸡、绿柴鸡、罗曼褐鸡、绿壳蛋鸡四种,前两种为肉鸡,后两种为蛋鸡.每种鸡分别采集雏鸡(10d)6只、中鸡(30d)和成鸡(58d)各3只.其中,绿柴鸡和绿壳蛋鸡属同一种鸡,一般绿柴鸡是公鸡,绿壳蛋鸡为母鸡,因此这两种鸡的雏鸡共采集6只.采集的饲料分为肉鸡料和蛋鸡料两种,主要成份为玉米、麸皮、豆饼、鱼粉、磷酸氢钙、果维素、辣椒粉等,雏阶段均喂肉鸡饲料,后期则分别喂肉鸡和蛋鸡饲料.所有采集的鸡就地宰杀后分取肌肉、胃(嗉)、心、肝和表皮等组织样品,用铝箔封装后运回实验室冷冻保存.用被动采样器(PAS-GP-1)采集养鸡场空气中气相和颗粒相苯并[a]芘.采样期3个月,检测结果根据相关校验研究结果换算为体积浓度(Tao et al.,2007).除样品采集外,同时收集与鸡生长过程相关的资料,包括不同生长阶段的饲料种类和喂食量、不同生长阶段的排泄量、呼吸速率等.
2.2 样品提取与净化
鸡的不同器官、饲料和粪便样品分析前在-18℃冷冻保存.样品均冷冻干燥4d(EYELA-FDU-830,-49.9℃、20.265kPa),称取3g样品与5g无水硫酸钠混合研磨至粉状.研磨后样品用100mL正己烷和二氯甲烷混合溶液(2:8)索氏提取24h,提取液经旋转蒸发浓缩至1滴后加入10mL正己烷再浓缩至3mL,定量转移至250mL分液漏斗.使用12mL正己烷和30mL乙腈混合液萃取两遍,收集萃取液后再用300mL 5%硫酸钠溶液萃取两遍,收集上层正己烷相.经硅胶层析柱净化后旋转蒸发并氮吹定容至0.2mL待测.
鸡蛋样品用不同方式处理.称取5g混匀鸡蛋样品置于10mL离心管中.依次用10、12和12mL乙腈离心萃取3次.在收集的上清液中加入120mL 2%无水硫酸钠溶液于空气浴振荡器中振荡1h,转移至250mL分液漏斗中后,再分别用30、15和15mL正己烷萃取,取正己烷相,经硅胶层析柱净化后旋转蒸发并氮吹定容至0.2mL待测.
2.3 样品分析
采用气相色谱-质谱联用仪测定提取样品中的苯并[a]芘.仪器条件如下:HP-5毛细柱(30.0m×250μm×0.25μm),载气为He,柱前压0.003Mpa,进样口温度250℃,采用不分流进样方式,进样量1μL;升温程序:以5℃·min-1升温至300℃(起始温度60℃),保留15min至样品完全流出色谱柱;质谱条件:EI电离源70eV,质量范围45~600aum,离子源温度200℃,光电倍增器电压950V,扫描速度0.82sec·scan-1,溶剂延迟5min.
2.4 质量控制
本研究涉及各类样品的加标回收率在81%~126%之间,回收率指示物(萘-d8、苊-dl0、葸-d10、屈-d12和苝-d12)回收率在54%~70%之间.苯并[a]芘仪器检测限为0.46ng·mL-1.每批样品同时加两个程序空白,每个样品保证至少3个平行.实验用乙腈使用色谱纯溶剂,其他均使用经重蒸处理的分析纯溶剂,实验使用的玻璃器皿经超声洗涤后于400℃灼烧6h.
3 结果与分析(Results and analysis)
3.1 实测浓度和器官分布
本研究测得的各类样品中苯并[a]芘湿重浓度和脂肪标化浓度列于表1.饲养鸡体内各器官中苯并[a]芘湿重浓度在0.024~0.15ng·g-1之间;饲料和粪便中的湿重浓度分别为(0.29±0.054)ng·g-1和(1.4±0.83)ng·g-1.饲养鸡体内各器官中苯并[a]芘的脂肪标化浓度在0.22~2.6ng·g-1之间;饲料和粪便中的脂标化浓度分别为(6.7±1.3)ng·g-1和(36±21)ng·g-1.鸡蛋、空气颗粒态与气态苯并[a]芘浓度均低于检出下限,未在表格中列出.虽然我国多环芳烃排放密度高,大气污染严重,但此次测得的鸡肉中苯并[a]芘浓度低于国外某些国家近年来报道的结果,例如,在埃及市场上购买的食物样品测定的结果发现苯并[a]芘在鸡肉中的湿重浓度高达0.16ng·g-1,较本研究测定结果高将近一个量级(Loutfy et al.,2007).导致这种差别的原因之一是饲料中苯并[a]芘含量的差异.该研究同时发现,埃及使用的鸡饲料中包括苯并[a]芘在内的8种多环芳烃含量的干重浓度为7.3ng·g-1(Loutfy et al.,2007),而本研究采集的饲料中的相应浓度为3.5ng·g-1.此外,最近报道的斯洛伐克(0.3ng·g-1)和西班牙加泰罗尼亚地区(0.04ng·g-1)市场上禽类产品中苯并[a]芘实测湿重浓度也高于本研究的结果(Dobrikova and Svetlikova,2007;Perello et al.,2009).
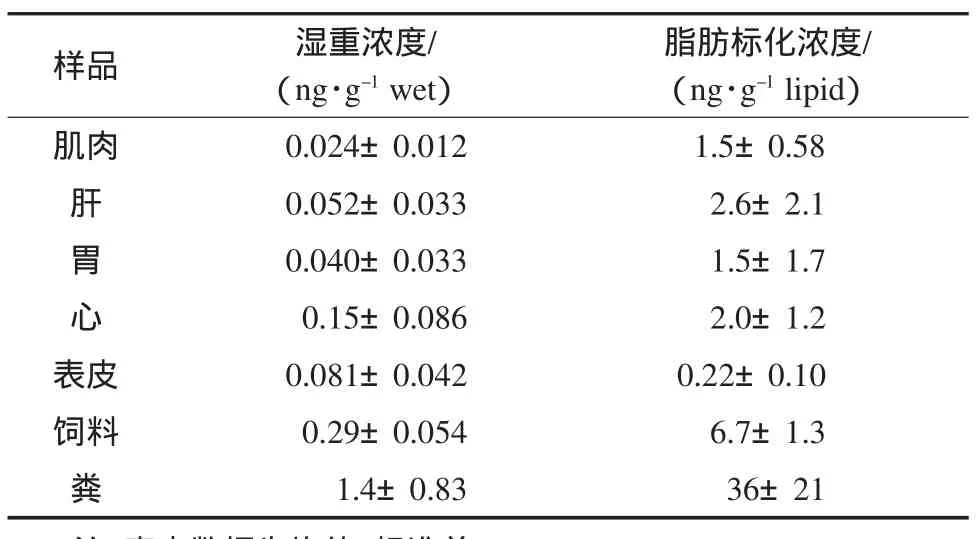
表1 各类样品中苯并[a]芘湿重浓度与脂肪标化浓度Table 1Wet weight concentrations and lipid normalized concentrations of benzo[a]pyrene in the samples
在研究测定的几种组织中,肌肉浓度显著低于其他器官(p<0.05).其他组织中含量则没有显著差异(p>0.05).肌肉中脂肪含量最低是导致这一差别的原因之一.但即便用脂含量标化,肌肉浓度仍低于内脏浓度,但高于表皮.肝脏浓度最高显然与肝首过效应有关.动物肝脏对有机污染物的富集在文献中多有报道.例如,有关研究发现暴露于16种多环芳烃的鸡胚胎中多环芳烃在肝脏中富集最多(Naf et al.,1992),有机氯农药也趋向于在肝脏富集(Covaci et al.,2004).特别需要指出的是,饲料和粪便,特别是粪便中的苯并[a]芘浓度显著高于各组织浓度(p<0.05).虽然饲料水分含量较低,但即便计算干重浓度,结果仍然如此.
本研究设计时分别采集了肉鸡(麻鸡、绿柴鸡)和蛋鸡(罗曼褐鸡和绿壳蛋鸡).对各种器官样品的测定结果进行统计检验,没有发现测定浓度在蛋鸡和肉鸡之间有显著差异.而品种之间的差别仅仅体现在麻鸡肌肉中苯并[a]芘浓度显著高于其它品种(p<0.05),因此,本文不再分析品种差异.
3.2 质量平衡
本研究除测定了各种样品中目标污染物的浓度外,还严格记录了各样品重量并采集了喂食和排泄的详细信息.利用这些信息和实测浓度计算了蛋鸡和肉鸡在58d饲养过程中苯并[a]芘在体系内的质量平衡关系(图1).由于实测空气浓度低于检出下限,可以忽略皮肤暴露,故摄食是唯一的输入途径.因喂食量不同(肉鸡各生长阶段的摄食量均高于蛋鸡),蛋鸡和肉鸡的总摄入量分别为1460ng和1900ng.本研究所采集饲料的的主要成份为鱼粉、玉米、麸皮、豆饼等.虽然没有分别测定,但这些组分中一般都有不同程度的多环芳烃污染(Phillips et al.,1999).根据质量平衡计算,摄入苯并[a]芘总量中约三分之一(蛋鸡摄入量的32%和肉鸡摄入量的34%)直接随粪便排泄出体外,其余部分或者残留在体内,或者在体内代谢.代谢量可以通过质量差减获得.从计算结果看,进入体内的苯并[a]芘约三分之二(蛋鸡摄入量的66%和肉鸡摄入量的63%)在体内代谢,残留在体内的部分仅占总摄入量的1.9%(蛋鸡)和2.5%(肉鸡),因此在体内各组织中的残留总量很低.这样的低体内残留量也是本研究鸡蛋中苯并[a]芘浓度未检出的主要原因.
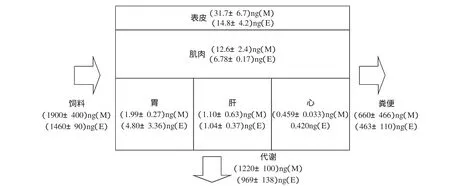
图158 d成熟饲养蛋鸡(E)和肉鸡(M)体内苯并[a]芘质量平衡Fig.1Mass balances of benzo[a]pyrene in laying chicken(E)and broilers(M)during a growth period of 58 days
多环芳烃在动物体内的代谢已有大量报道(Magnusson et al.,2000;Harris et al.,2008).这一特性正是多环芳烃不发生生物富集和放大的根本原因.苯并[a]芘的体内代谢可以发生在肠道这样的主要吸收器官中,也可以在肠道吸收后发生在其他器官中.模拟人体消化道的体外模拟实验结果观察到多环芳烃在消化过程中的代谢(Tang et al.,2006).虽然鸡的消化系统不同于人的消化系统,但类似的代谢过程完全可能在化学和微生物作用下发生.
富集于体内的少量苯并[a]芘主要存在于总质量最大的表皮和肌肉中(蛋鸡和肉鸡的表皮富集量占体内总富集量的百分数分别为1.0%和1.6%,肌肉分别为0.46%和0.66%).两种鸡胃中富集量的差别目前无法解释,这或许与采样前的喂食状况有关.
3.3 动态变化
为了解饲养鸡对苯并[a]芘吸收和代谢的动态过程,分别采集了生长期为10、30和58d的样品,测定了各组织含量.图2为本研究肌肉、肝和胃组织中苯并[a]芘浓度的动态变化(10d小鸡表皮和心脏组织样品太少,没有可靠的测定结果).虽然3个数据点无法支持定量数据拟合,但仍可以看出苯并[a]芘在不同组织中的浓度表现出一定的趋势性变化(图中曲线仅用于表示趋势).这样的变化实际上取决于两个作用相反的动力学因素,即苯并[a]芘的累积总量和组织的生长量.前者导致苯并[a]芘的不断积累,后者则持续稀释积累的物质.其结果是,不同组织中最终浓度的变化趋势反映了两种过程作用的相对强度.当积累速率高于稀释速率时(如胃),组织中苯并[a]芘浓度持续上升,当稀释作用强于累积过程时,表现为组织内苯并[a]芘浓度的不断下降(如肌肉).
由于两种过程在不同组织中表现不同,如果用累积量作图(图3),得到的结果与浓度图不完全相同.比较图2和图3,肝脏和胃组织苯并[a]芘浓度和累积量变化趋势一致,说明两种相反作用在生长过程中的变化趋势恒定.相比之下,肌肉中生长后期累积量显著上升,但浓度却持续下降.显然,肌肉的生长在后期显著加速(现代化饲养鸡的特点),稀释作用明显,尽管累积总量快速增加,但仍然低于肌肉生长引起的稀释作用.相比之下,肝脏和胃等器官在成鸡生长阶段的质量增加远不如肌肉明显.如前所述,苯并[a]芘累积量在组织中的变化与吸收和代谢两者有关.这两种过程在图3中3种器官中表现出来完全不同的变化规律.作为主要的消化/吸收器官,胃中苯并[a]芘的吸收速率始终快于代谢,因此累积总量持续加速上升.与之相反,虽然吸收后的苯并[a]芘可以先到达肝脏(肝首过效应),但作为主要的代谢器官,肝脏内苯并[a]芘累积量持续下降,说明代谢比累积更快.肌肉中出现的转折可能与生长速率的改变有关,成鸡生长阶段加速增加的肌肉除稀释作用外,也可以导致吸收和累积量的上升.

图2 不同组织中苯并[a]芘浓度的动态变化Fig.2Dynamic changes of benzo[a]pyrene concentrations in different tissues

图3 不同组织中苯并[a]芘积累量的动态变化Fig.3Dynamic changes in total quantities of benzo[a]pyrene in different tissues
3.4 食用暴露贡献
本研究只采集了一个养鸡场的样品,获得的数据显然不足以代表北京市场食用鸡苯并[a]芘的浓度水平,不能用做评估区域人群通过食用鸡肉导致的苯并[a]芘暴露量的依据.但是由于相关文献资料非常缺乏,考虑到目前大型养鸡场的饲养方式和饲料来源完全市场化,饲料的配方相似,因此,以本研究实际测定浓度为参照,半定量评估食用本养鸡场产品(或相似饲料来源养鸡场产品)对人体总暴露的贡献仍可提供具有一定的参考价值的信息,且为将来可能的基于人群的暴露评估提供第一手资料.
根据相关膳食调查结果,不同年龄组北京居民(男女平均)平均禽肉摄入量(湿重)分别为2~10岁0.80g·kg-1(体重)·d-1、11~17岁0.71g·kg-1(体重)·d-1、18~44岁0.40g·kg-1(体重)·d-1、45~59岁0.34g·kg-1(体重)·d-1、大于60岁0.30g·kg-1(体重)·d-1(翟凤英和杨晓光,2006).由于北京居民食用禽肉以鸡肉为主,如果不严格区分肉鸡和蛋鸡,可以估计,不同年龄组居民通过食用本养鸡场或相似饲料来源养鸡场的成鸡产品的苯并[a]芘暴露量在0.33~0.69ng·d-1之间(图4).青年组暴露量较高的原因是较高的单位体重摄入量和略高于儿童组的体重.值得注意的是,这样的暴露量与当地居民在春、秋、冬季通过呼吸对大气中苯并[a]芘的暴露相比可以忽略.据有关文献报道,北京城区春、夏、秋、冬四季大气苯并[a]芘浓度均值分别为5.3ng·m-3、0.030ng·m-3、5.6ng·m-3和14.3ng·m-3(Zhou et al.,2005).以11~23岁居民为例,北京居民呼吸率均值为15.7m3·d-1(朱广瑾,2006).春、夏、秋、冬四季对苯并[a]芘的日均呼吸暴露量分别为83.3ng·d-1、0.47ng·d-1、87.8ng·d-1和224.9ng·d-1.上述11~17岁居民鸡肉食用暴露比春、秋、冬季的呼吸暴露低两个量级,而与夏季呼吸暴露相当.最近相关研究证明,对多环芳烃的呼吸暴露可能造成值得关注的健康风险(Zhang et al.,2009).相比之下,经鸡肉摄取的苯并[a]芘导致的风险要低得多.当然,由于鸡肉摄取只占摄食暴露的很小比例,在获得全面的食物暴露浓度之前,不能就摄食暴露风险下任何明确结论,比如相关研究就曾证明,膳食是天津居民对多环芳烃暴露的优势途径(李新荣等,2009).

图4 不同年龄北京城区居民食用本养鸡场产品对苯并[a]芘的日暴露量Fig.4Daily oral intake of benzo[a]pyrene by Beijing residents who consume the poultry product from the investigated chicken farm
Charles G D,Bartels M J,Zacharewski T R,Gollapudi B B,Freshour N L,Carney E W.2000.Activity of benzo(a)pyrene and its hydroxylated metabolites in an estrogen receptor-alpha reporter gene assay[J].Toxicological Sciences,55(2):320-326
CovaciA,GheorgheA,SchepensP.2004.Distributionof organochlorinepesticides,polychlorinatedbiphenylsandalpha-HCH enantiomers in pork tissues[J].Chemosphere,56(8):757-766
Dobrikova E,Svetlikova A.2007.Occurence of benzo[a]pyrene in some foods of animal originintheSlovakRepublic[J].Journal of Food and Nutrition Research,46(4):181-185
Guo H,Lee S C,Ho K F,Wang X M,Zou S C.2003.Particle-associated polycyclic aromatic hydrocarbons in urban air of Hong Kong[J].Atmosphere.Environment,37(38):5307-5317
Harris D L,Huderson A,Niaz M S,Ford J J,Archibong A E,Ramesh A.2008.Comparative metabolism of benzo(a)pyrene by ovarianmicrosomesofvariousspecies[J].Environmrntal Toxicology,24(6):603-609
IPCS(InternationalProgrammeonChemicalSafty).1998.EnvironmentalHealthCriteria202:Selectednon-heterocyclic polycyclic aromatic hydrocarbons[M].Lyon,France:International Programme on Chemical Safety.World Health Organization
Li X R,Zhao T K,Yu Y X,Zhang C J,Li P,Li S J.2009.Population exposure to PAHs and the health risk assessment in Beijing area[J].Jouranl of Agro-Environment Science,28(8):1758-1765(in Chinese)
Loutfy N,Fuerhacker M,Tundo P,Raccanelli S,Ahmed M T.2007.Monitoringofpolychlorinateddibenzo-p-dioxinsand dibenzofurans,dioxin-likePCBsandpolycyclicaromatic hydrocarbons in food and feed samples from Ismailia city,Egypt[J].Chemosphere,66(10):1962-1970
Magnusson K,Ekelund R,Ingebrigtsen K,Granmo A,Brandt I.2000.Tissuedispositionofbenzo[a]pyreneinbluemussel(Mytilus Edulis)and effect of algal concentration on metabolism and depuration[J].Environmental Toxicology and Chemistry,19(11):2683-2690
NafC,BromanD,BrunstromB.1992.Distributionand metabolism of polycyclic aromatic hydrocarbons(PAHs)injected into eggs of chicken(Gallus Domesticus)and common eider duck(SomateriaMollissima)[J].EnvironmentalToxicologyand Chemistry,11(11):1653-1660
Perello G,Marti-Cid R,Castell V,Llobet J M,Domingo J L.2009.Concentrations of polybrominated diphenyl ethers,hexachlorobenzene and polycyclic aromatic hydrocarbons in various foodstuffs before and after cooking[J].Food and Chemical Toxicology,47(4):709-715
Phillips D H.1999.Polycyclic aromatic hydrocarbons in the diet[J].Mutation Research-Genetic Toxicology and Environmental Mutagenesis,443(1-2):139-147
Ramesh A,Walker S A,Hood D B,Guillen M D,Schneider K,Weyand E H.2004.Bioavailability and risk assessment of orally ingested polycyclic aromatic hydrocarbons[J].International Journal of Toxicology,23(5):301-333
Tang X Y,Tang L,Zhu Y G,Xing B S,Duan J,Zheng M H.2006.Assessmentofthebioaccessibilityofpolycyclic aromatic hydrocarbons in soils from Beijing using an in vitro test[J].Environmental Pollution,140(2):279-285
Tao S,Liu Y N,Xu W,Lang C,Liu S Z,Dou H,Liu W X.2007.Calibration of apassivesamplerforbothgaseousand particulatephasepolycyclicaromatichydrocarbons[J].Environmental.Science&Technology,41(2):568-573
Wan Y,Jin X H,Hu J Y,Jin F.2007.Trophic dilution of polycyclic aromatic hydrocarbons(PAHs)in a marine food web from Bohai Bay,North China[J].Environmental.Science&Technology,41(9):3109-3114
Wang X J,Chen J,Zhang Z H,Piao X Y,Hu J D,Tao S.2004.Distribution and sources of polycyclic aromatic hydrocarbons in soil profiles of Tianjin area,People’s Republic of China[J].Bulletin Environmental Contamination Toxicolology,73(4):739-748
WHO(World Health Organization).2000.Air Quality Guidelines for Europe(2ndedition)[R].European Series No.91.WHO.Copenhagen:WHO Regional Publications
XuSS,LiuWX,TaoS.2006.Emissionofpolycyclic aromatic hydrocarbons in China[J].Environmental.Science&Technology,40(3):702-708
Zhang Y X,Tao S,Shen H Z,Ma J M.2009.Inhalation exposure to ambient polycyclic aromatic hydrocarbons and lung cancerriskofChinesepopulation[J].ProceedingsofThe National Academy of Sciences of The United States of America,106(50):21063-21067
Zhang Y X,Tao S.2009.Global atmospheric emission inventory of polycyclic aromatic hydrocarbons(PAHs)for 2004[J].Atmosphere Environment,43(4):812-819
Zhou J B,Wang T G,Huang Y B,Mao T,Zhong N N.2005.Seasonal variation and spatial distribution of polycyclic aromatic hydrocarbons in atmospheric PM10 of Beijing,People’s Republic ofChina[J].BulletinofEnvironmentalContaminationand Toxicology,74(4):660-666
中文参考文献
李新荣,赵同科,于艳新,张成军,李鹏,李顺江.2009.北京地区人群对多环芳烃的暴露及健康风险评价[J].农业环境科学学报,28(8):1758-1765
翟凤英,杨晓光.2006.2002膳食与营养素摄入状况:中国居民营养与健康状况调查报告之二[M].北京:人民卫生出版社
朱广瑾.2006.中国人群生理常数与心理状况-21世纪初中国部分省市人群调查报告[M].北京:中国协和医科大学出版社◆
Intake,Excretion and Accumulation of Benzo[a]pyrene in Chickens from a Chicken Farm in Beijing
YANG Yi-feng,ZHOU Dong-xu,LI Xiao,YANG Yu,WANG Wen-tao,SHEN Guofeng,WANG Rong,WANG Bin,TAO Shu*
Laboratory for Earth Surface Processes,College of Urban and Environmental Sciences,Peking University,Beijing 100871
Chicken muscle,viscera,egg,feed,dropping and air samples were collected at a medium-size poultry farm in Beijing.The concentrations of benzo[a]pyrene of these samples were measured to address intake,accumulation,excretion,and metabolism of benzo[a]pyrene in chicken.The wet weight concentrations of benzo[a]pyrene in different tissues were from 0.024 to 0.15ng·g-1.The concentration in muscle was significantly lower than those in other tissues while the concentrations in feed and droppings were significantly higher than those in all tissues.Approximately one third of benzo[a]pyrene intake was excreted and around 60%was metabolized.Only a small fraction remained in skin and muscle as residues.Dynamic changes of benzo[a]pyrene concentrations in muscle,liver and stomach showed different patterns.Daily oral intake of benzo[a]pyrene via consumption of similar poultry product in Beijing is approximately two orders of magnitude lower than those of inhalation exposure in spring,fall,and winter,and in the same range of that of inhalation exposure in summer.
benzo[a]pyrene;chicken;absorption;metabolism
1 February 2010accepted15 March 2010
1673-5897(2010)2-162-07
X171.5
A
2010-02-01录用日期:2010-03-15
国家重点基础研究发展计划(973)项目(No.2007CB407303);国家自然科学基金项目(No.40771179;No.40730737);国家环保部公益项目(No.200809101)
杨意峰(1984—),男,硕士研究生;*通讯作者(Corresponding author),E-mail:taos@urban.pku.edu.cn
陶澍(1950—),男,博士,北京大学教授.

