三丁基锡和菲对鳗鲡的毒性效应
徐文菊,李远友,夏小安,王树启,吴清洋,徐树德
1.汕头大学广东省海洋生物技术重点实验室,汕头515063
2.韩山师范学院生物系,潮州521041
三丁基锡和菲对鳗鲡的毒性效应
徐文菊1,2,李远友1,*,夏小安1,王树启1,吴清洋1,徐树德1
1.汕头大学广东省海洋生物技术重点实验室,汕头515063
2.韩山师范学院生物系,潮州521041
采用腹腔注射方式(每周1次,共5次)将生活于淡水或海水中的日本鳗鲡(Anguilla japonica)暴露于三丁基锡氯化物(TBTCl)和菲(Phe),以研究这两种污染物对鳗鲡的毒性效应以及该效应与鱼体所处环境盐度的关系.鳗鲡暴露于TBTCl或Phe 1w后,其肝脏和脾脏的组织结构就已发生明显病变,且病变程度随着暴露时间的延长而加剧,其中海水鳗鲡比淡水鳗鲡表现更为严重;但肝体指数(HSI)和性腺组织结构均无明显变化.暴露于TBTCl 4~5w后,海水鳗鲡肝脏的谷胱甘肽-S-转移酶(GST)活性比对照组显著升高,而淡水鳗鲡组无明显变化;暴露于TBTCl或Phe 3w后,淡水鳗鲡的血浆皮质醇水平显著升高,但海水鳗鲡组无明显变化.TBTCl和Phe对淡水或海水鳗鲡的血浆雌二醇(E2)水平均无明显影响.以上结果表明:有机锡和菲对鳗鲡的肝脏、脾脏有毒性作用,对皮质醇分泌具有内分泌干扰作用,且该效应与暴露时间和鱼体所处环境盐度有关.
有机锡;菲;日本鳗鲡;毒性效应
1 引言(Introduction)
三丁基锡(Tributyltin,TBT)和菲(Phenanthrene,Phe)是典型的环境污染物,目前已在自然界中广泛存在.20世纪60年代以来,三丁基锡化合物被广泛用于船舶防生物附着油漆的活性添加剂,每年大概有3×106kg的TBT和三苯基锡(Triphenyltin,TPT)被释放到水环境中(Hoch,2001).TBT毒性极强,水环境中ng·L-1水平即会对海洋软体动物产生不良影响(Bryan and Gibbs,1991).Phe是一种典型的低环类多环芳烃(Polycyclic aromatic hydrocarbons,PAHs),化学结构特殊,具有与致癌性相关的“K区”(Harvey,1991).研究菲的毒性效应可为了解PAHs的致癌机理提供一定的证据.
水环境是大部分污染物的最终聚集场所,也是水生动物赖以生存的环境,而TBT和Phe具有长期残留性和高蓄积性,因此,它们在水生动物中的含量通常会比水环境中高得多,其毒性可以通过食物链逐级传递和放大,甚至危害陆生动物和人类的健康.由于鱼类具有与哺乳动物(包括人类)相似的生理系统(马陶武和王子健,2005),且毒物在细胞和分子水平上的作用机制在所有脊椎动物中高度保守(Gray and Foster,2003),因而在鱼类中许多由污染物导致的功能紊乱可能与人类相似.因此,研究典型环境污染物对鱼类的毒性效应不仅可以在较早阶段发现污染物的危害并评价环境质量的好坏,而且可以预测其对陆生动物甚至人类可能产生的类似后果,这对于制定环境保护的法律法规、保护水环境和水生资源、保障人类健康均具有一定的现实意义.
广盐性鱼类在淡水和海水中的生理状况并不完全相同,因此它们在不同盐度下对污染物的反应也有所不同.近年来,有关内分泌干扰物(Endocrine Disrupting Chemicals,EDs)测试和毒理实验在海水鱼或淡水鱼中都有研究,但毒性效应及其机制与鱼体所处环境盐度的关系如何尚鲜有报道.日本鳗鲡(Anguilla japonica)作为一种典型的广盐洄游性鱼类,主要生活在水体的中下层,与TBT、Phe的主要沉积场所——底泥直接接触,因此本研究选择鳗鲡为研究对象,探讨不同环境盐度下TBT和Phe对鱼类的毒性效应具有重要的现实意义.
为了减少试验毒物的使用量和对环境的影响,本研究采用在体注射实验方式暴露鳗鲡,从肝体指数、组织学病变、肝脏谷胱甘肽-S-转移酶(GST)活性、血浆类固醇激素水平变化等方面,研究了氯化三丁基锡(Tributyltin chloride,TBTCl)和Phe对生活在海水和淡水中的鳗鲡的毒性效应及其与水环境盐度的关系,以期为不同水环境盐度下污染物的毒性效应评价及其有效监控提供参考依据.
2 材料与方法(Materials and methods)
2.1 实验动物和药物
实验用鳗鲡(A.japonica)于2006年3月购于潮州市饶平县一养鳗场,体重300~500g.实验前将鱼暂养于汕头大学南澳临海实验站的两个底部铺有细沙的水泥养殖池中.将其中一个池的鳗鲡在1周内逐步驯化到自然海水中(盐度32‰左右)养殖,另一池则继续养于淡水中.驯养30d后,用于暴露实验.
受试药物TBTCl(纯度>96%)购自英国Lancaster公司,Phe(纯度>98%)购自Aldrich公司.取适量TBTCl和Phe溶于玉米油(Sigma公司)中,分别配成0.5mg·mL-1和5mg·mL-1的注射液盛于棕色玻璃瓶中,保存于4℃冰箱中,使用前恢复到室温.
2.2 实验设计和取样
淡水和海水鳗鲡各设3个组,即TBTCl和Phe处理组及对照组,每组2个平行,每个平行9~10条鱼.采用腹腔注射方式对鳗鲡进行药物暴露,TBTCl和Phe的注射剂量参考国外文献设定(Oshiam et al.,1998;Krone and Stein,1999;Nacci et al.,2002;Padrós et al.,2003),分别为每kg体重(BW)0.5mg和5mg,对照组注射相当体积(1mL·kg-1(BW))玉米油.每周注射1次,共注射5次.注射后的鳗鲡被装入有孔塑料框中,养于原来的水泥池中.在实验开始前和每次注射后第7d取样并进行下一次注射,隔周在每组的两个平行间交替进行取样:包括对该平行所有鳗鲡取血液,杀3条鳗鲡取肝脏、脾脏和性腺;最后一次注射后第7天对所有鱼取样.
每次取样或注射前,将鳗鲡用0.1%MS-222麻醉,然后称重、取血,解剖鳗鲡称肝脏重.血液取出后,转入冰浴的离心管中;在4℃静置1h后,于4℃、14000rpm离心10min,收集上清液血浆,加入1%硫柳汞1~2μL和Aprotin(6000KU·mL-1,每mL血浆加25μL),然后保存于-80℃冰箱中备测类固醇激素含量.取肝脏放入液氮中速冻后,再保存于-80℃冰箱中,用于测定其中的GST活性.取肝脏、脾脏和性腺组织于Bouin’s液中固定12~24h,然后用70%乙醇溶液保存于4℃冰箱中.组织经酒精梯度脱水后,进行石蜡包埋和切片,常规HE染色后在蔡氏显微镜下观察拍照.
2.3 肝脏GST活性测定
从-80℃冰箱中取出肝脏样品,称重后,按质量(g):体积(mL)为1:19的比例加入Tris-HCl匀浆液(pH 7.4,EDTA 0.0001mol·L-1,蔗糖0.01mol·L-1,NaCl 0.8%),冰浴中充分匀浆后,于4℃、1200g离心15min,收集上清液.上清液中蛋白浓度和GST活性的测定,采用南京建成生物工程公司生产的试剂盒进行.方法详见文献(杜永兵等,2007;Du et al.,2008).
2.4 血浆类固醇激素含量的测定
血浆中皮质醇(Cortisol)和雌二醇(estradiol,E2)含量采用北京北方生物技术研究所的放射免疫试剂盒进行测定.
2.5 数据分析处理
肝体指数(HSI)=100×WL/WB,式中WL、WB分别为肝脏和鱼体质量(g).HSI、GST活性以及类固醇激素含量均以平均值±标准误(Mean±SEM)表示.数据使用统计软件Kplot 3.0进行Tukey多重比较,检验不同处理组与相应对照组之间的差异性,当p<0.05时认为差异显著.
3 结果(Results)
3.1 鳗鲡受TBTCl和Phe暴露后的中毒症状
鳗鲡受TBTCl或Phe暴露后的中毒症状相似,主要表现为活力明显下降,且淡水鳗鲡较海水鳗鲡明显;暴露5w后,其肝脏出现发白、肿大现象,少部分鱼的胆囊肿大、甚至破裂,胆汁颜色变淡.整个实验期间无死鱼现象.
3.2 TBTCl和Phe对鳗鲡肝体指数(HSI)的影响
受TBTCl或Phe暴露1~5w后,淡水和海水鳗鲡的HSI均有所升高,但与对照组相比均无显著差异(p>0.05)(表1).
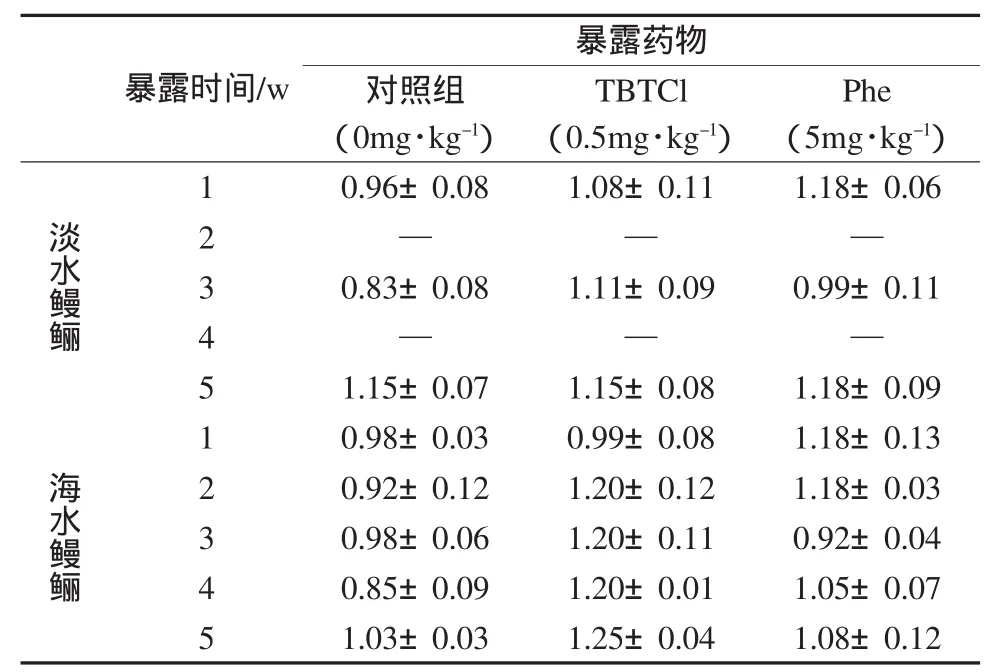
表1 受TBTCl和Phe暴露后鳗鲡的肝体指数(HSI)Table 1Hepatosomatic index(HSI)of eels exposed to TBTCl and Phe
3.3 TBTCl和Phe对鳗鲡肝脏及脾脏结构的影响
对照组鳗鲡的肝细胞较大,常呈团状或索状排列;细胞核一般为圆形或卵圆形,染色较深,位于细胞中央;细胞质丰富,嗜酸性(图1a、b).受到TBTCl或Phe暴露后,肝细胞出现肿胀、空泡化现象(如图1中箭头所指),细胞质中嗜酸性物质减少,细胞核被挤向边缘;随着暴露时间延长,病变有加剧的趋势;其中,TBTCl对海水鳗鲡肝脏组织的毒害作用(图1d)较淡水鳗鲡严重(图1c),而Phe的毒害作用正好相反(图1e、f).

图1 对照组和受TBTCl(0.05mg·kg-(1BW))或Phe(5mg·kg-(1BW))暴露5w后的鳗鲡肝脏的显微结构(a、b:淡水、海水鳗鲡对照组;c、d:淡水、海水鳗鲡TBTCl暴露组;e、f:淡水、海水鳗鲡Phe暴露组)Fig.1The microstructure of liver from control and TBTCl(0.05mg·kg-(1BW))or Phe(5mg·kg-(1BW))exposed(5 weeks)eels(a,b:freshwater and seawater eels in control;c,d:freshwater and seawater eels exposed to TBTCl;e,f:freshwater and seawater eels exposed to Phe)
对照组鳗鲡的脾脏组织没有明显的白髓和红髓之分,其中的淋巴细胞数量多,有的聚集成团,铁血黄素沉淀较少(图2a、b).当淡水鳗鲡和海水鳗鲡受到TBTCl或Phe暴露后,其脾脏组织的病变症状相似,主要表现铁血黄素沉淀(图2中三角符号所指)有所增加,有的组织发生坏死、溶解现象(图2c、d、e、f).

图2 对照组和受TBTC(l0.05mg·kg-(1BW))或Phe(5mg·kg-(1BW))暴露5w后的鳗鲡脾脏的显微结构(a、b:淡水、海水鳗鲡对照组;c、d:淡水、海水鳗鲡TBTCl暴露组;e、f:淡水、海水鳗鲡Phe暴露组)Fig.2The microstructure of spleen from control and TBTCl(0.05mg·kg-(1BW))or Phe(5mg·kg-(1BW))exposed(5 weeks)eels(a,b:freshwater and seawater eels in control;c,d:freshwater and seawater eels exposed to TBTCl;e,f:freshwater and seawater eels exposed to Phe)
TBTCl和Phe对淡水和海水鳗鲡的性腺组织结构均无明显影响(图略).
3.4 TBTCl和Phe对鳗鲡肝脏GST活性的影响
淡水鳗鲡受TBTCl或Phe暴露1至5w后,其肝脏GST活性与对照组无显著差异(图3a).海水鳗鲡受到TBTCl暴露1~3w或Phe暴露1~5w后,其肝脏GST活性也无明显变化;但4~5w的TBTCl暴露则显著提高其GST活性(图3b).说明TBTCl和Phe对鱼体肝脏GST活性的影响与暴露时间和鱼体所处环境盐度有关.

图3 TBTCl和Phe对淡水鳗鲡(a)及海水鳗鲡(b)肝脏GST活性的影响(*:与对照组比较,p<0.05)Fig.3Effects of TBTCl and Phe on hepatic GST activity in freshwater(a)and seawater(b)eels(*:compared with the control,p<0.05)
3.5 TBTCl和Phe对鳗鲡血浆皮质醇和E2水平的影响
淡水鳗鲡受到Phe暴露1w、3w或受到TBTCl暴露3w后,其血浆皮质醇水平显著高于对照组(图4a);暴露5w时,皮质醇水平均恢复到对照水平(图4a).海水鳗鲡受到TBTCl或Phe暴露1~5w后,其皮质醇水平不受影响(图4b).
淡水鳗鲡和海水鳗鲡在受到TBTCl或Phe暴露前的血浆E2水平分别为(3.14±0.22)ng·mL-1和(3.52±0.42)ng·mL-1;当受到TBTCl或Phe暴露1至5w后,淡水鳗鲡对照组及药物暴露组的血浆E2水平在(2.78±0.64)ng·mL-1和(3.74±0.73)ng·mL-1之间,而海水鳗鲡对照组及药物暴露组的血浆E2水平在(3.42±0.37)ng·mL-1和(4.53±0.44)ng·mL-1之间.统计分析显示,TBTCl和Phe对海水或淡水鳗鲡的血浆E2水平均无显著影响(图表略).

图4 TBTCl和Phe对淡水鳗鲡(a)及海水鳗鲡(b)血浆皮质醇水平的影响(*:与对照组比较,p<0.05)Fig.4Effects of TBTCl and Phe on plasma cortisol levels in freshwater(a)and seawater(b)eels(*:compared with the control,p<0.05)
4 讨论(Discussion)
肝脏是动物体内的主要解毒器官,也是污染物蓄积和产生毒害作用的主要靶器官之一.当鱼体受到有毒物质暴露后,氧化胁迫作用可使肝脏组织的抗氧化系统做出反应,肝脏代谢酶和多功能氧化酶(如GST、过氧化氢酶、肝脏Ⅰ相代谢酶等)活性被诱导或抑制(张景飞和王晓蓉,2003;Shim et al.,2003;马晓燕等,2007),也可能导致代谢物在肝细胞内积累;同时污染物对肝脏的毒害作用可能影响其糖原的代谢或减弱脂肪转化为磷脂的能力,导致脂肪在肝脏内积聚.这可能是TBTCl、Phe使肝细胞肿大、HSI升高,细胞质中嗜酸性物质减少、出现空泡化现象,细胞核边缘化的原因之一.据报道,虎利齿脂鲤、大头丽脂鲤、蓝子鱼和孔雀鱼受到TBT暴露后,其肝脏组织也出现与本试验相似的结果(Oliveira Ribeiro et al.,2002;Rabitto et al.,2005;谭燕等,2006;杜永兵等,2007).
脾脏是鱼体的主要造血器官,其中的巨噬细胞可以吞噬衰老的红细胞,分解血红蛋白后生成棕黄色的铁血黄素沉淀.正常鱼脾脏中的铁血黄素沉淀数量少且面积小,在异常情况下,如受到毒物暴露时,其数量和面积会增加(Couillard and Hodson,1996;Pacheco and Santos,2002;Schwaiger et al.,2004),这可能是脾脏组织中衰老血红细胞数量增加、代谢增强所致(Pacheco and Santos,2002).相似结果也在孔雀鱼、蓝子鱼中观察到(谭燕等,2006;杜永兵等,2007).
GST是生物体内一种重要的II相代谢酶,可催化谷胱甘肽(Glutathione,GSH)与亲电子的外源性化学物质结合,从而将体内有潜在毒性的物质降解排出体外.生物体在污染胁迫下,产生氧化应激,生成大量活性氧自由基,从而诱导GST活性升高.本试验中,当鳗鲡在海水中暴露于TBTCl 4~5w后,肝脏GST活性显著升高,可能是鱼体的氧化应激反应所致.这与TBT对文蛤(Meretrix meretrix)和蓝子鱼的毒性效应相同(Huang et al.,2005;杜永兵等,2007).TBTCl对淡水鳗鲡的GST活性无显著影响,说明其毒性效应与鱼体所处环境盐度有关,这可能与鱼体在不同盐度下的生理状态不同有关.
当鱼体受到毒物暴露或环境胁迫后,其“下丘脑-垂体-肾间组织”轴会做出应急反应,在促肾上腺皮质激素、cAMP调控下,血浆皮质醇水平可较快地升高(Aluru and Vijayan,2004).故该激素被称为基本的“应激激素”、且具有作为早期监测和评估环境污染物的辅助标志物的潜在功能.本实验中,淡水鳗鲡暴露于Phe 1w和3w或暴露于TBTCl 3w后,其血浆皮质醇水平显著升高,说明该应急反应系统正常;相反,暴露5周后则恢复到对照组水平,这可能与鱼体的自身适应性有关.与此相似,鳗鲡暴露于柴油污染水体3h后,其血浆皮质醇水平显著提高,而4h时恢复到对照水平(Pacheco and Santos,2002).与淡水鳗鲡不同,海水鳗鲡的血浆皮质醇水平不受影响,说明TBTCl和Phe的内分泌干扰效应与鱼体所处环境盐度有关.这种盐度差异可能与皮质醇在淡水鳗鲡和海水鳗鲡渗透压调节中的作用有关,其具体机制有待进一步探讨.
本研究中,TBTCl和Phe对鳗鲡的精巢或卵巢组织结构无明显影响.与此结果相一致,TBTCl和Phe对其血浆E2水平也无明显影响.同样,Rocha Monteiro等(2000)以含Phe的食物投喂比目鱼(Platichthys flesus)12w后,其卵巢组织结构也没有明显病理变化.
总之,本研究结果说明,在较低的暴露浓度下(TBTCl,0.5mg·kg-1(BW);Phe,5mg·kg-1(BW)),有机锡和菲对鳗鲡的肝脏、脾脏组织有明显毒性作用,对皮质醇分泌具有内分泌干扰作用,且该效应与暴露时间和鱼体所处环境盐度有关.说明鳗鲡的血浆皮质醇水平、肝脏GST活性,肝脏和脾脏组织的病变等可以用于评估不同盐度环境中有机锡和菲等环境污染物的毒性效应参考指标,鳗鲡具有开发为环境污染监测生物的潜力.
AluruN,VijayanMM.2004.β-naphthoflavonedisrupters cortisolproductionandliverglucocorticoidresponsivenessin rainboe trout[J].Aquatic Toxicology,67(3):273-285
Bryan G W,Gibbs P E.1991.Impact of low concentrations of tributyltin(TBT)on marine organisms:a review[A].//Newman MC,McIntoshAW.MetalEcotoxicology:Conceptsand Applications[C].Chelsea,Michigan:Lewis Publishers,323-362
CouillardCM,HodsonPV.1996.Pigmentedmacrophage aggregates:a toxic response in fish exposed to bleached-kraft mill effluent?[J].Environmental Toxicology and Chemistry,15(10):1844-1854
Du Y B,Li Y Y,Yu L X,Zheng Y J,Hu C B,Chen W Z,Sun Z W,Zhang Y L.2007.Influence of tributyltin on the plasma steroid levels,hepatic enzyme activity and microstructure oforgansinrabbitfishSiganusorami[J].ActaScientiae Circumstantiae,27(5):796-802(in Chinese)
Du Y B,Li Y Y,Zhen Y J,Hu C B,Liu W H,Chem W Z,Sun Z W.2008.Toxic effects in Siganus oramin by dietary exposure to 4-tert-octylphenol[J].Bulletin of Environmental Contamination and Toxicology,80(6):534-538
Gray L E,Foster P M D.2003.Significance of experimental studiesforassessingadverseeffectsofendocrine-disrupting chemicals[J].Pure and Applied Chemistry,75(11-12):2125-2141
Harvey R G.1991.Polycyclic Aromatic Hydrocarbons Chemistry and Carcinogenicit(1sted.)[M].Cambridge:Cambridge University Press
Hoch M.2001.Organotin compounds in the environment:An overview[J].Applied Geochemistry,16(7-8):719-743
Huang Z Y,Chen Y X,Zhao Y,Zuo Z H,Chen M,Wang C G.2005.Antioxidant responses in Meretrix meretrix exposed to environmentally relevant doses of tributyltin[J].Environmental Toxicology and Pharmacology,20(1):107-111
Krone C A,Stein J E.1999.Species dependent biotransformation and tissue distribution of tributyltin in two marine teleosts[J].Aquatic Toxicology,45(2-3):209-222
Ma T W,Wang Z J.2005.Fish experimental model in the screening and testing for the environmental endocrine disruptor[J].Acta Scientiae Circumstantiae,2(2):135-140(in Chinese)
Ma X Y,Fan L M,Gan J L,Hu G D,Qu J H,Chen J C.2007.Effects of TBT on the activities of superoxide dismutase and the content of glutathione in two tissues ofOreochromis aureus[J].Journal of Safety and Environment,7(4):9-11(in Chinese)
Nacci D E,Kohan M,Pelletier M,George E.2002.Effects of benzo[a]pyrene exposure on a fish population resistant to the toxic effects of dioxin-like compounds[J].Aquatic Toxicology,57(4):203-215
Oliveira Ribeiro C A,Schatzmann M,Silva Assis H C,Silva P H,Pelletier E,Akaishi FM.2002.Evaluationoftributyltin subchronic effects in tropical freshwater fish(Astyanax bimaculatus,Linnaeus,1758)[J].Ecotoxicology and Environmental Safety,51(3):161-167
Oshiam Y,Nirmala K,Yokota Y,Go J,Shimasaki Y,Nakao M,LeeRF,ImadaN,HonjoT,KobayashiK.1998.Accumulation of tributyltin(TBT)in the blood of flounder and dabintraperitoneallyadministeredwithTBT[J].Marineand Environmental Research,46(1-5):587-590
Pacheco M,Santos M A.2002.Biotransformation,genotoxic,andhistopathologicaleffectsofenvironmentalcontaminantsin Europeaneel(AnguillaanguillaL.)[J].Ecotoxicologyand Environmental Safety,53(3):331-347
Padrós J,Pelletier E,Ribeiro C O.2003.Metabolic interactions between low doses of benzo[a]pyrene and tributyltin in arctic charr(Salvelinusalpinus):along-terminvivostudy[J].Toxicology and Applied Pharmacology,192(1):45-55
Rabitto I S,Alves Costa J R,Silva de Assis H C,Pelletier E E,Akaishi F M,Anjos A,Randi M A,Oliveira Ribeiro C A.2005.Effects of dietary Pb(II)and tributyltin on neotropical fish,Hoplias malabaricus:histopathological and biochemicalfindings[J].Ecotoxicology and Environmental Safety,60(2):147-156
Rocha Monteiro P R R,Reis-Henriques M A,Coimbra J.2000.Polycyclicaromatichydrocarbonsinhibitinvitroovarian steroidogenesis in the flounder(Platichthys flesus L.)[J].Aquatic Toxicology,48(4):549-559
Schwaiger J,Ferling H,Mallow U,Wintermayr H,Negele R D.2004.Toxic effects of the non-steroidal anti-inflammatory drug diclofenac.Part I:histopathological alteration and bioaccumulation in rainbow trout[J].Aquatic Toxicology,68(2):141-150
Shim W J,Jeon J K,Hong S H,Kim N S,Yim U H,Oh J R,ShinYB.2003.Accumulationoftributyltininolive flounder,Paralichthys olivaceus:its effect on hepatic cytochrome P450[J].ArchivesofEnvironmentalContaminationand Toxicology,44(3):390-397
Tan Y,Li Y Y,Du Y B,Chen W Z,Sun Z W.2006.Acute and chronic toxic effect of tributyltin on the Guppies(Poeciliareticulates)[J].Environmental Chemistry,25(3):315-319(in Chinese)
Zhang J F,Wang X R.2003.Effects of long-term exposure of low-level 2,4-dichlorophenol on the antioxidant defense system in liver of Carassius auratus[J].Environmental Science,24(5):136-140(in Chinese)
中文参考文献
杜永兵,李远友,禹龙香,郑一军,胡长博,陈伟洲,孙泽伟,章跃陵.2007.三丁基锡对蓝子鱼的激素和酶指标及组织显微结构的影响[J].环境科学学报,27(5):796-802
马陶武,王子健.2005.环境内分泌干扰物筛选和测试研究中的鱼类实验动物[J].环境科学学报,25(2):135-140
马晓燕,范立民,甘居利,胡庚东,瞿建宏.2007.三丁基锡(TBT)对罗非鱼两组织SOD和GSH的影响[J].安全与环境学报,7(4):9-11
谭燕,李远友,杜永兵,陈伟州,孙泽伟.2006.三丁基锡对孔雀鱼的毒性效应研究[J].环境化学,25(3):315-319
张景飞和王晓蓉.2003.2,4-二氯苯酚低浓度长期暴露对鲫鱼肝脏抗氧化系统的影响[J].环境科学,24(5):136-140◆
Toxic Effects of Tributyltin and Phenanthrene on Eels
XU Wen-ju1,2,LI Yuan-you1,*,XIA Xiao-an1,WANG Shu-qi1,WU Qing-yang1,XU Shu-de1
1.Guangdong Provincial Key Laboratory of Marine Biology in Shantou University,Shantou 515063
2.Biology Department of Hanshan Normal University,Chaozhou 521041
In order to investigate the toxic effects of tributyltin chloride(TBTCl)and phenanthrene(Phe)on Japanese eel Anguilla japonica and their relationship with ambient salinities,TBTCl and Phe were administered via the intraperitoneal injection(once a week and five times in total)to the eels which were cultured in freshwater or seawater.After the eels were exposed to TBTCl or Phe for one week,obvious histopathological changes were observed in liver and spleen,and the symptoms in seawater eels were more serious than those in freshwater eels and were aggravated with exposure duration in five weeks;however,changes were not obvious either in hepatosomatic indexes(HSI)or in gonadal microstructure.Compared with that in the respective control groups,obvious increase of hepatic glutathione-S-transferase(GST)activity was observed in seawater eels but not in freshwater eels after 4~5 weeks’exposure to TBTCl,and that of plasma cortisol levels were detected in freshwater eels but not in seawater eels after 3 weeks’exposure to TBTCl or Phe.TBTCl or Phe had no obvious effect on plasma estradiol levels in either freshwater or seawater eels.The results demonstrate that both TBTCl and Phe have toxic effects on liver and spleen,and display endocrine disruption effects on cortisol secretion in eels,but the effects are related to exposure duration and water salinity.
organotin;phenanthrene;Anguilla japonica;toxic effects
4 May 2009accepted3 August 2009
1673-5897(2010)2-229-07
X171.5
A
2009-05-04录用日期:2009-08-03
国家自然科学基金项目(No.30570325)
徐文菊(1983—),女,硕士,教师;*通讯作者(Corresponding author),E-mail:yyli@stu.edu.cn
李远友(1964—),男,教授,留学回国博士后,博士生导师.汕头大学海洋生物研究所所长兼广东省海洋生物技术重点实验室主任,主要从事鱼类生理与分子生物学、生态毒理学等方面的研究工作.

