大鼠胚胎期PFOS暴露致出生早期死亡及神经系统发育影响的基因组学分析
王法琦,刘薇,金一和,*,于文广,刘晓晖,刘力
1.大连理工大学环境与生命学院,大连160024
2.中国医科大学公共卫生学院,沈阳110001
大鼠胚胎期PFOS暴露致出生早期死亡及神经系统发育影响的基因组学分析
王法琦1,刘薇1,金一和1,*,于文广1,刘晓晖1,刘力2
1.大连理工大学环境与生命学院,大连160024
2.中国医科大学公共卫生学院,沈阳110001
为了阐明PFOS导致新生儿死亡的可能原因和机制,探讨PFOS致死与神经系统发育的相互联系,利用基因芯片技术,观察了经PFOS饲料染毒后出生1和7d大鼠脑组织基因表达情况,通过基因组学(Gene Ontology)和生物路径(Pathway)对差异基因的功能和相互联系进行分析.结果显示,PFOS染毒后,出生1、7d的大鼠脑皮质组织分别有864、642条基因发生差异表达,差异基因涉及的与PFOS致死相关的生物过程包括中枢神经系统发育、血循环系统、刺激应答、骨骼发育、氧化应激、心脏功能以及pH值调节等.结果表明,PFOS导致的出生早期死亡与神经系统发育有关,PFOS可能通过改变脑组织血氧平衡,影响正常的中枢神经系统功能和发育过程而使新生儿的存活率下降.
全氟辛烷磺酸;出生早期死亡;基因芯片;发育神经毒性
1 引言(Introduction)
全氟辛烷磺酸(Perfluorooctanesulfonate,PFOS)是全氟有机化合物(Perfluorinated compounds,PFCs)家族中的代表性化合物之一,也是含氟系列产品经过化学或生物降解的最终产物(Calafat et al.,2006).近年的研究表明PFOS广泛存在于自然环境、动物和人体内.PFOS被动物摄入体内后,大部分与血浆蛋白结合存在于血液中,其余一部分蓄积在动物的肝脏组织和肌肉组织当中,并能通过胎盘屏障,直接作用于胎儿(Smithwick et al.,2005).由于PFOS化学性质稳定、挥发性弱,一直以来被认为是毒性较低的化学物质并沿用至今,但最近的毒理学研究表明它具有肝脏毒性、神经毒性、心血管毒性、胚胎发育与生殖毒性、遗传毒性与致癌性、免疫毒性等多重毒性效应(胡存丽和仲来福,2006),是一种全身毒性化合物.目前PFOS已被列入美国环保局持久性环境污染物黑名单(Calafat et al.,2006).
近来有关PFOS胚胎期暴露致使出生早期死亡率增高的研究越来越受到人们的关注(Lau et al.,2003;Johansson et al.,2008;Shi et al.,2008;Luebker et al.,2005b;Austin et al.,2003).Abbott等人(2009)通过比较研究孕期PFOS暴露后过氧化物酶增殖物激活受体α(Peroxisome proliferatoractivated receptor α,PPARα)缺陷型和野生型幼鼠的死亡率,发现PFOS致死与PPARα无关.同样地,PFOS诱导的新生儿死亡也与脂质代谢异常和体内甲状腺激素紊乱无关(Luebker et al.,2005b),而可能由颅内出血以及胚胎期呼吸系统和肺功能发育障碍导致的(Borg et al.,2009;Grasty et al.,2003;Yahia et al.,2008).PFOS能透过胎盘屏障和血脑屏障,损害发育期生物体的中枢神经系统(Fuentes et al.,2006;Butenhoff et al.,2009).许多研究表明PFOS能引起发育神经毒性(Lau et al.,2003;Johanssonetal.,2008;Shietal.,2008;Luebkeretal.,2005b;Austinetal.,2003;Butenhoff et al.,2009;刘利等,2009),并且PFOS已被认为是一种神经毒剂(Austin et al.,2003),可能通过改变神经发育及干扰神经内分泌系统而发挥毒性效应(Slotkin et al.,2008).研究显示,神经系统早期发育异常与婴幼儿的死亡密切相关(Luebker et al.,2005b).因此PFOS引起新生儿死亡可能与其导致的神经发育异常密切相关.
为了研究孕期PFOS暴露导致新生鼠死亡的原因,探讨PFOS致死与发育神经毒性的相互关系,本文利用基因芯片技术从分子水平研究了PFOS导致新生鼠死亡的可能原因与机制,以及神经系统发育在PFOS致死过程中的作用,力求找出潜在的引起PFOS致死的神经功能变化.由于PFOS胚胎期暴露更容易诱导新生儿死亡(Du et al.,2009),并且胚胎发育晚期是PFOS致死的关键时期(Luebker et al.,2005b),本文选取PFOS孕期染毒模式,研究出生后第1、7d大鼠的基因表达情况,通过对PFOS诱导的差异表达基因进行生物路径和分子功能分析,得出与PFOS致死相关的所有可能分子机制,从这些机制或路径中找出与神经发育相关的功能变化,从而阐明PFOS导致新生鼠死亡与神经系统发育之间的潜在联系.
2 材料与方法(Materials and methods)
2.1 试剂
全氟辛烷磺酸钾K+PFOS(C8F17KO3S;No.2795-39-3;纯度>98%)购自Fluka化学试剂公司.K+PFOS的溶剂为2%的吐温R20.将配制成的1.6mg·mL-1PFOS钾盐溶液充分混匀于粉末状饲料中,分别制成浓度为0、3.2mg·kg-1饲料的两种粉状饲料,对照组只加入2%吐温溶液.染毒前利用液相色谱-质谱(LC-MS/MS)检测染毒饲料中PFOS含量以确保每份饲料的均匀度和有效性.
2.2 试验动物及染毒
Wistar雄性大鼠(250~300g)及雌性大鼠(180~200g)购自大连医科大学实验动物中心.动物室温度18~23℃,相对湿度45%~55%.实验期间动物自由饮水、摄食.实验前驯养1周后,将大鼠按3:1的雌、雄比例合笼,次日早晨阴道涂片,以阴道镜检检出精子为母鼠妊娠第1天.将孕鼠随机分为对照组和PFOS(3.2mg·kg-1(饲料))染毒组.实验过程中剔除假孕母鼠.饲料放置于自制饲料盒中,大鼠以舔食方式摄取食物.各实验组母鼠通过自由摄食摄入至实验结束.
2.3 动物处理方式
分别取出生后第1、7d仔鼠,断头处死,冰上快速取脑,分离出大脑前额外层皮质,所有采集样品均保存于液氮中备用.
2.4 脑组织RNA提取
从液氮中取出脑皮质(100mg左右)在液氮中研磨,脑皮质RNA的提取过程按照试剂盒说明书操作(Takara).利用琼脂糖凝胶电泳,比较28S与18SRNA荧光度以确定RNA的完整性;利用紫外分光光度法测定RNA在A260、A280及A320的吸光度来确定RNA的纯度和估测浓度.从每个剂量组随机取出6个RNA样品(雌雄各半)平均混合后进行基因芯片分析.
2.5 基因表达测定
采用Illumina全基因组表达谱芯片(Illumina,San Diego,CA,USA)分别检测出生第1、7d大鼠脑皮质基因表达变化.本芯片包含来自NCBI数据库的共22228个转录本(Release 16;Illumina,San Diego,CA,USA),总RNA的纯化利用QIAGEN RNeasy Mini Kit(Illumina,San Diego,CA,USA).第一链和第二链cDNA合成以及Biotin标记cRNA的体外合成、纯化由IlluminaRTotalPrepTM RNA Amplification Kit(AMIL1781,Ambion Inc.)完成.探针杂交条件为58℃下18.5h,按Illumina杂交体系要求对芯片进行清洗和浸染.信号值由Cy3染料读出,使用双通道,0.8μm高分辨率的共聚焦激光扫描仪(Illumina)对磁珠芯片进行扫描测定.
2.6 差异表达基因分析
将输出的信号值输入BeadStudio-3(Illumina)分析软件进一步分析,利用Cubic Spline Algorithm对数据进行归一化处理,采用Algorithm of the Illumina Custom对染毒组和对照组数据进行成对比较以确定PFOS染毒后差异表达的基因.差异表达基因信息包括:信号平均值(AVG_Signal,每个基因所对应的平均荧光信号值),检出P值(Detection Pval,一般≤0.01认为该基因被检出),差异分数(DiffScore,一般≥13或≤-13判定为具有统计学显著性差异),差异P值(DIFF Pval,一般<0.05相当于DiffScore≥13或≤-13).
2.7 芯片数据的Gene Ontology(GO)和Pathway分析
利用网络分析工具(http://vortex.cs.wayne.edu/projects.htm)对基因芯片的原始数据进行生物功能(GO)和相关生物路径(Pathway)分析以便得到差异表达基因所涉及的生物学效应以及各个差异表达基因在执行相应生理功能时的相互联系.
根据新生儿早期死亡的相关生物因素或过程(http://en.wikipedia.org/wiki/Perinatalmortality),找出芯片分析结果中与PFOS致死相关的生物过程.
2.8 基因芯片数据验证
利用实时半定量RT-PCR技术随机选取出生后第1、7d均发生变化的7个差异表达基因进行反转录PCR试验,以验证芯片试验的有效性和可信性.
3 结果与分析(Results and analysis)
3.1 PFOS对出生1、7d大鼠脑皮质基因表达的影响
3.1.1 差异表达基因
染毒组仔鼠在出生后第1、7d分别有842和634个基因与对照组比较发生显著性变化(p<0.05),出生1、7d均发生变化的基因为122个.出生后1、7d上调表达的基因分别为464和359个;出生后1、7d下调表达的基因分别为378和275个;24个基因在出生后1、7d均表现为上调表达,11个基因在出生后1、7d均下调表达;62个基因在出生后1d上调表达,出生后7d下调表达,25个基因在出生后1d上调表达,出生后7d下调表达(图1).应用RT-PCR技术对芯片结果进行验证,结果表明约80%的基因在两种技术中显示一致的表达结果(表1、表2).

图1 孕期PFOS暴露对出生后1、7d大鼠脑皮质差异表达基因数的影响Fig.1Effect of gestational PFOS exposure on the numbers of differentially expressed genes at PNDs 1 and 7

表1 RT-PCR验证基因序列Table 1Information on prime sequences of genes for RT-PCR
3.1.2 差异表达基因相关生物功能和路径
通过GO分析,发现差异表达基因所涉及的生物过程(Bioprocess)包括电子离子转运、脂质代谢、激素调节和氧化应激等与以往报道的结果一致(Shi et al.,2008;Yeung et al.,2007;Krøvel et al.,2008);本研究发现的与神经发育相关的生物过程包括中枢神经系统发育、神经发生、记忆、神经递质传递和突触可塑性等(图2).这些差异表达基因在各自生命活动中的相互联系与作用可由它们所涉及的生物路径(Pathway)表示,出生1、7d显著性变化的生物路径主要有细胞分裂、细胞通信、钙离子信号转导、长时程增强或抑制以及PPAR信号转导路径等(表3).

表2 验证基因的RT-PCR结果和基因芯片结果比较Table 2Validation of differentially expressed genes(DEGs)determined by Beadchips with RT-PCR

图2 出生1、7d大鼠脑差异表达基因相关的神经系统生物过程(Bioprocess,BP)(PV指芯片结果中某一生物过程相关的差异基因数与此项生物过程所涉及的总基因数的百分比)Fig.2Neuro-bioprocesses(BP)associated with differentially expressed brain genes in rat at PNDs 1 and 7(PV means percentage value of input related genes from microarrays to total related genes for a category)
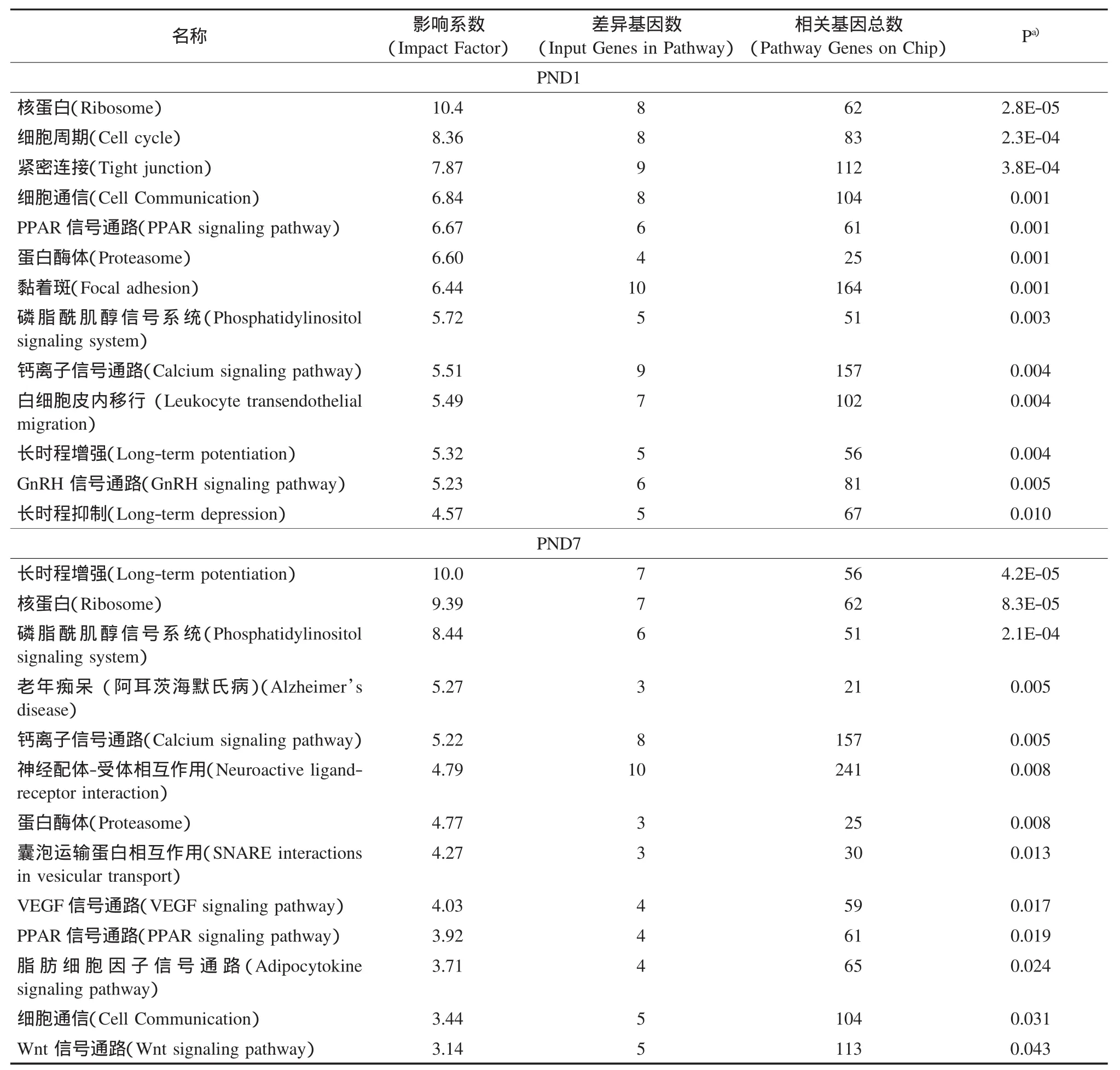
表3 孕期PFOS暴露引起出生1、7d大鼠脑差异表达基因的相关生物路径分析(Pathways)Table 3Analysis of pathways associated with genes differentially changed at PND1 and PND7 by gestational PFOS exposure
3.2 PFOS致死相关生物过程.
根据新生动物早期死亡相关的生物因素(http://en.wikipedia.org/wiki/Perinatal mortality),找出芯片数据中的PFOS显著影响的致死相关生物过程包括直接致死过程(death)、中枢神经系统发育、刺激反应、呼吸系统、血液循环体系、骨骼发育、体内活性氧反应、心肺功能以及体内pH值调节等(表4).
4 讨论(Discussion)
本文首次利用高通量的基因芯片技术,从分子水平阐释PFOS引起新生儿死亡的可能原因,尤其是神经系统发育在PFOS致死过程中的作用.PFOS具有发育神经毒性已被证实,并且对发育过程中神经系统的影响大多伴随着神经行为和存活率的改变.孕鼠暴露于PFOS可导致受试动物出生致死率升高,并具有剂量依赖性,而存活的幼鼠出现生长迟缓、低甲状腺素血症和甘油三脂水平下降等现象(Lau et al.,2003;Yu et al.,2009).Johansson等(2008)研究了PFOS对新生小鼠神经行为的影响,发现PFOS能使小鼠的存活率降低,自发行为紊乱,胆碱能系统异常.Shi等(2008)对斑马鱼卵进行PFOS染毒,发现鱼仔孵化率和幼鱼存活率显著降低,存活幼鱼表现出不同程度的发育畸形;某些与细胞调亡和甲状腺发育的相关基因表达显著变化,并推测胚胎期的基因表达模式是影响PFOS致死毒性的潜在机制.Luebker等(2005a)对SD母鼠孕期染毒,发现出生后5d仔鼠的存活力降低,相应母鼠的孕期减少.Luebker等(2005b)研究了PFOS对大鼠两代仔鼠各种行为指标的影响,结果显示3.2mg·kg-1·d-1染毒组F1代仔鼠在出生后1~4d内全部死亡,1.6mg·kg-1·d-1剂量组在F1代仔鼠断乳期时出现存活率降低的现象,而其它较低剂量组PFOS引起了包括睁眼(eye opening)、顺毛(air rigting)、张耳(pinna unfolding)等发育行为的迟缓,提示PFOS对大鼠胚胎期暴露直接影响新生仔鼠的存活率.此外,PFOS可以通过血脑屏障直接作用于中枢神经系统(Austin et al.,2003).神经系统发育障碍与脑相关疾病能够导致婴幼儿死亡.Dutra等(2007)研究了
出生6d内的羔羊的存活率与神经系统损伤的关系,将死亡羔羊解剖后发现,尸体出现不同程度的脑充血和水肿、神经元缺血性坏死以及多处脑区溢血等症状,提出神经系统损伤可能会解释大多数新生或出生6d内的死亡现象.另外,流行病学资料显示多种神经系统疾病也参与了机体的死亡过程(Dutra et al.,2007),如神经系统综合症能导致死亡率增高(Wilson et al.,1978);老年痴呆(阿耳茨海默氏病,Alzheimer’s disease)症能加剧死亡的发生(White et al.,1998),而本研究结果还表明这种病显著受孕期PFOS暴露的影响(表3),因此,在研究PFOS致死原因与机制时,不能忽视发育期神经系统的毒性反应对PFOS致死的影响.本研究中,出生1、7d染毒组大鼠脑皮质的差异表达基因数从864降为643,说明出生早期大鼠的神经系统更容易受到PFOS影响,而PFOS胚胎期暴露对出生早期动物的存活率影响更大(Luebker et al.,2005b;Du et al.,2009;Yahia et al.,2008),说明出生存活率和神经系统发育在同一时期更易受到PFOS影响,提示PFOS对神经系统发育的影响可能与PFOS致死相关.有报道显示,PFOS导致新生儿死亡可能是由颅内血液循环不良造成(Yahia et al.,2008),而脑损伤所导致的死亡与神经系统的血液循环异常有关(Haughey,1973).本研究也得到了类似的结果(表4),出生1、7d大鼠中与中枢神经系统发育相关的差异基因数分别为17、20;与血液循环、血管发育、血管张力调节、血管形态发生等血循环系统相关的基因数均为29;与缺氧反应相关基因数分别为10、8,而且所用试验样本为支撑脑组织脉络丛的大脑外层皮质,提示PFOS可能通过影响心血管系统的发生发育和成熟,改变脑组织血氧平衡,影响中枢神经系统正常功能和发育过程从而导致新生儿死亡率增高.

表4 孕期PFOS暴露引起出生1、7d大鼠脑差异表达基因的相关致死生物过程Table 4The differentially expressed brain genes related bioprocesses associated with gestational PFOS-induced mortality at PNDs 1 and 7
此外,研究结果还显示(表4),出生1d与呼吸系统相关的PFOS可能致死因素为肺发育与呼吸管发育,每项各有5个差异基因参与;出生7d与呼吸系统相关的可能致死因素为呼吸系统过程和呼吸气流交换,每项各有2个差异基因参与.这与以往研究的PFOS引起的肺功能障碍(Luebker et al.,2005b;Yahia et al.,2008),以及肺发育紊乱(Grasty et al.,2005)可能是PFOS致死原因的报道一致.而且,PFOS对呼吸系统的影响在不同的发育期表现不同,数据显示PFOS刚出生时更容易影响发育过程,这可能是由于肺发育主要发生在胚胎晚期(Grasty et al.,2003),而出生7d后则倾向于影响呼吸功能.除此之外,PFOS涉及的一些可能致死因素还包括刺激应答、骨骼发育、氧化应激、心脏功能、pH值调节等生理生化过程.这些功能系统改变也可能单独地或者相互地参与了PFOS的致死过程.
总之,本文利用分子学手段研究了PFOS致死敏感期的差异基因表达情况,为进一步研究PFOS致死原因和机制提供了大量的参考信息,并特别提出了神经系统发育可能在PFOS致死过程中发挥关键作用.下一步的研究将从与PFOS致死相关的差异表达基因着手,研究它们编码蛋白的表达差异以及相应的生理生化反应变化,从而进一步补充PFOS引起新生儿死亡的生物机制.
Abbott B D,Wolf C J,Das K P,Zehr R D,Schmid J E,LindstromAB,StrynarMJ,LauC.2009.Developmental toxicity of perfluorooctane sulfonate(PFOS)is not dependent on expressionofperoxisomeproliferatorsactivatedreceptor-alpha(PPARγ)in the mouse[J].Reproductive Toxicology 27(3-4):258-265
Austin M E,Kasturi B S,Barber M,Kannan K,MohanKumar P S,MohanKumarSM.2003.Neuroendocrineeffectsof perfluorooctanesulfonateinrats[J].EnvironmentalHealth Perspectives,111(12):1485-1489
Borg D,Bogdanska J,Sundström M,Nobel S,Häkansson H,Bergman A,DePierre J,Halldin K,Bergstrom U.2009.Perinatal tissue distribution of perfluorooctane sulphonate(PFOS)in mice[J].Toxicology Letters,189(1):147
Butenhoff J L,Ehresman D J,Chang S C,Parker G A,Stump D G.2009.Gestational and lactational exposure to potassium perfluorooctanesulfonate(K+PFOS)in rats:developmental neurotoxicity[J].Reproductive Toxicology,27(3-4):319-330
Calafat A M,Needham L L,Kuklenyik Z,Reidy J A,Tully J S,Aguilar-VillalobosM,NaeherLP.2006.Perfluorinated chemicals in selected residents of the American continent[J].Chemosphere,25(3):490-496
Du Y,Shi X,Liu C,Yu K,Zhou B.2009.Chronic effects of water-borne PFOS exposure on growth,survival and hepatotoxicity in zebrafish:a partial life-cycle test[J].Chemosphere,74(5):723-729
Dutra F,Quintans G,Banchero G.2007.Lesions in the central nervoussystemassociatedwithperinatallambmortality[J].Australian Veterinary Journal,85(10):405-413
Fuentes S,Colomina M T,Rodriguez J,Vicens P,Domingo J L.2006.Interactionsindevelopmentaltoxicology:concurrent exposure to perfluorooctane sulfonate(PFOS)and stress in pregnant mice[J].Toxicology Letters.164(1):81-89
Grasty R C,Bjork J A,Wallace K B,Wolf D C,Lau C S,Rogers J M.2005.Effects of prenatal perfluorooctane sulfonate(PFOS)exposureonlungmaturationintheperinatalrat[J].BirthDefectsResearch.PartB,DevelopmentalReproductive Toxicology,74(5):405-416
Grasty R C,Wolf D C,Grey E,Lau C S,Rogers J M.2003.Prenatalwindowofsusceptibilitytoperfluorooctanesulfonateinduced neonatal mortality in the Sprague-Dawley rat[J].Birth Defects Research.Part B,Developmental Reproductive Toxicology,68(6):465-471
Haughey K G.1973.Vascular abnormalities in the central nervous system associated with perinatal lamb mortality.2.Association of the abnormalities with recognised lesions[J].Australian Veterinary Journal,49(1):9-15
Hu C L,Zhong L F.2006.Progress of toxicological study on PFOS and PFOA[J].Chinese Journal of Industrial Medicine,19(6):1244-1247(in Chinese)
Johansson N,Fredriksson A,Eriksson P.2008.Neonatal exposure toperfluorooctanesulfonate(PFOS)andperfluorooctanoicacid(PFOA)causesneurobehaviouraldefectsinadultmice[J].NeuroToxicology,29(1):160-169
Krøvel A V,Søfteland L,TorstensenB,Olsvik P A.2008.TranscriptionaleffectsofPFOSinisolatedhepatocytesfrom Atlantic salmon Salmo salar L.[J].Comparative Biochemistry and Physiology.Part C,Toxicology&Pharmacology,148(1):14-22
Lau C,Thibodeaux J R,Hanson R G,Rogers J M,Grey B E,Stanton M E,Butenhoff J L,Stevenson L A.2003.Exposure to perfluorooctane sulfonate during pregnancy in Ratand mouse.II:Postnatal evaluation[J].Toxicological Sciences,74(2):382-392
Liu L,Jin Y H,Wang L,Yu H Y,Liu W,Yu Q L,Wang K,LiuB,WangJ.2009.Effectsofprenatalandpostnatal perfluorooctane sulfonate exposure on IGF-I,IGF-IR and IGFBP-2 mRNA levels in frontal cortex of rat pups[J].Asian Journal of Ecotoxicology,4(2):190-196(in Chinese)
Luebker D J,Case M,York R G,Moore J A,HansenK J,Butenhoff J L.2005a.Two-generation reproduction and crossfosterstudiesofperfluorooctanesulfonate(PFOS)inrats[J].Toxicology,215(1-2):126-148
Luebker D J,York R G,Hansen K J,Moore J A,Butenhoff J L.2005b.Neonatalmortalityfrominuteroexposureto perfluorooctanesulfonate(PFOS)in Sprague-Dawley rats:doseresponse,and biochemical and pharamacokinetic parameters[J].Toxicology,215(1-2):149-169
Shi X,Du Y,Lam P K,Wu R S,Zhou B.2008.Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS[J].Toxicology and Applied Pharmacology,230(1):23-32
SlotkinTA,MacKillopEA,MelnickRL,ThayerKA,Seidler F J.2008.Developmental neurotoxicity of perfluorinated chemicals modeled in vitro[J].Environmental Health Perspectives,116(6):716-722
Smithwick M,Muir D C,Mabury S A,Solomon K R,Martin J W,SonneC,BornEW,LetcherRJ,DietzR.2005.Perflouroalkyl contaminants in liver tissue from East Greenland polar bears(Ursus maritimus)[J].Environmental Toxicolgy&Chemistry,24(4):981-986
WhiteH,PieperC,SchmaderK.1998.Theassociationof weight change in Alzheimer’s disease with severity of disease andmortality:Alongitudinalanalysis[J].Journalofthe American Geriatrics Society,46(10):1223-1227
Wilson W R,Geraci J E,DanielsonG K,Thompson R L,Spittell J A,Washington J R,Giuliani E R.1978.Anticoagulant therapy and central nervous system complications in patients with prosthetic valve endocarditis[J].Circulation,57(5):1004-1007
YahiaD,TsukubaC,YoshidaM,SatoI,TsudaS.2008.Neonatal death of mice treated with perfluorooctane sulfonate[J].Journal of Toxicological Sciences,33(2):219-226
Yeung L W Y,Guruge K S,Yamanaka N,Miyazaki S,Lam P KS.2007.Differentialexpressionofchickenhepaticgenes responsive to PFOA and PFOS[J].Toxicology,237(1-3):111-125
Yu W G,Liu W,Jin Y H,Liu X H,Wang F Q,Liu L,NakayamaSF.2009.Prenatalandpostnatalimpactof perfluorooctane sulfonate(PFOS)on rat development:A crossfoster study on chemical burden and thyroid hormone system[J].Environmental Science&Technology,43(21):8416-8422
中文参考文献
胡存丽,仲来福.2006.全氟辛烷磺酸和全氟辛酸毒理学研究进展[J].中国工业医学杂志,19(6):1244-1247
刘利,金一和,王烈,于红瑶,刘薇,于棋麟,王柯,刘冰,王静.2009.出生前后全氟辛烷璜酸(PFOS)暴露额叶皮质中IGF-I、IGF-IR和IGFBP-2 mRNA水平的影响[J].生态毒理学报,4(2):190-196◆
Genomic Analysis of Effects of Gestational PFOS Exposure on Neonatal Death and the Nervous System Development in Rat
WANG Fa-qi1,LIU Wei1,JIN Yi-he1,*,YU Wen-guang1,LIU Xiao-hui1,LIU Li2
1.School of Environmental and Biological Science and Technology,Dalian University of Technology,Dalian 116024
2.School of Public Health,China Medical University,Shenyang 110001
To investigate the potential mechanism of PFOS-induced neonatal mortality at the molecular level and to find out the interaction between PFOS-induced mortality and developmental neurotoxicity,the RatRef-12 Expression BeadChip was used to identify changes in gene expression at postnatal days(PNDs)1 and 7.The Gene Ontology for translation genes into relative functions and the pathway for graphical representations of gene interactions were both employed for further analysis of the expression data.There are 864 and 642 genes significantly affected by PFOS at PNDs1 and 7,respectively(p<0.05).Some of bioprocesses related to differentially expressed genes have been involved in the PFOS-induced mortality including:death,the central nervous system development,blood circulation,response to stimulus,bone development,response to hypoxia,heart process and regulation of pH.Results of this study indicate that the disruption of nervous system may lead to PFOS-induced neonatal mortality through the disruption of the brain blood and oxygen system and interference with the normal functional process of brain.
perfluorooctane sulfonate;neonatal mortality;genechip;developmental neurotoxicity
10 March 2010accepted25 March 2010
1673-5897(2010)2-176-08
X171.5
A
2010-03-10录用日期:2010-03-25
国家自然科学基金项目(No.30771772)
王法琦(1982—),女,博士研究生;*通讯作者(Corresponding author),E-mail:jinyihe@dlut.edu.cn
金一和(1959—),男,教授,博士生导师.从事环境毒理学研究.1990年7月日本秋田大学医学部毕业,现任日本毒理学会海外评议员、中国气象学会大气成分委员会委员,兼任《中华预防医学杂志》、《卫生研究》和《国外医学》(卫生学分册)等期刊编委.

