以芳樟醇为手性源的β-羟基酸的不对称合成
葛军英,陈慧宗
(1.宜春学院江西省高校应用化学与化学生物学重点实验室,江西宜春336000;2.江西师范大学化学学院,江西南昌330022)
以芳樟醇为手性源的β-羟基酸的不对称合成
葛军英1,陈慧宗2
(1.宜春学院江西省高校应用化学与化学生物学重点实验室,江西宜春336000;2.江西师范大学化学学院,江西南昌330022)
以芳樟醇与乙酰乙酸乙酯进行酯交换反应,合成了具有手性的乙酰乙酸芳樟酯(β-酮酯),再用其与不同的格氏试剂反应,得到不对称β-羟基酸;产物分别经手性柱分析.结果表明,手性乙酰乙酸芳樟酯与格氏试剂的反应具有不同程度的立体选择性,产物为 R-或S-构型过量的β-羟基酸,ee值最高达50%.
芳樟醇;手性源;β-羟基酸;不对称合成
芳樟醇(linalool)异名芫荽醇,沉香醇,里哪醇,学名3,7-二甲基-1,6-辛二烯-3-醇或2,6-二甲基2,7-辛二烯-6-醇.它是无色或浅绿色液体,在全世界每年排出的最常用和用量最大的香料中,芳樟醇几乎年年排在首位,可以说没有一瓶香水里面不含芳樟醇,没有一块香皂不用芳樟醇的.这并不奇怪,因为差不多所有的天然植物香料里面都有芳樟醇的“影子”,从99%到痕迹量的存在[1].
利用芳樟醇具有一个手性碳原子来进行不对称合成的研究还很罕见,芳樟醇既是高碳醇又是烯丙位叔醇,酯化空间位阻大,而且极易发生双键重排生成副产物,所以采用酸作催化剂时,酯化反应的转化率和选择性都不高[2-5].由于酸难以与其反应,因此绝大多数芳樟醇的酯采用酯交换法来合成.酯交换法反应条件相对比较温和,对设备的要求不高,所用的催化剂也易得到.
本文利用芳樟醇的手性碳原子使芳樟醇与乙酰乙酸乙酯在I2催化下反应生成不对称酯[6],所得到的酯与格氏试剂反应生成一种构型过量的具有旋光性的β-羟基酸,其反应见图1.
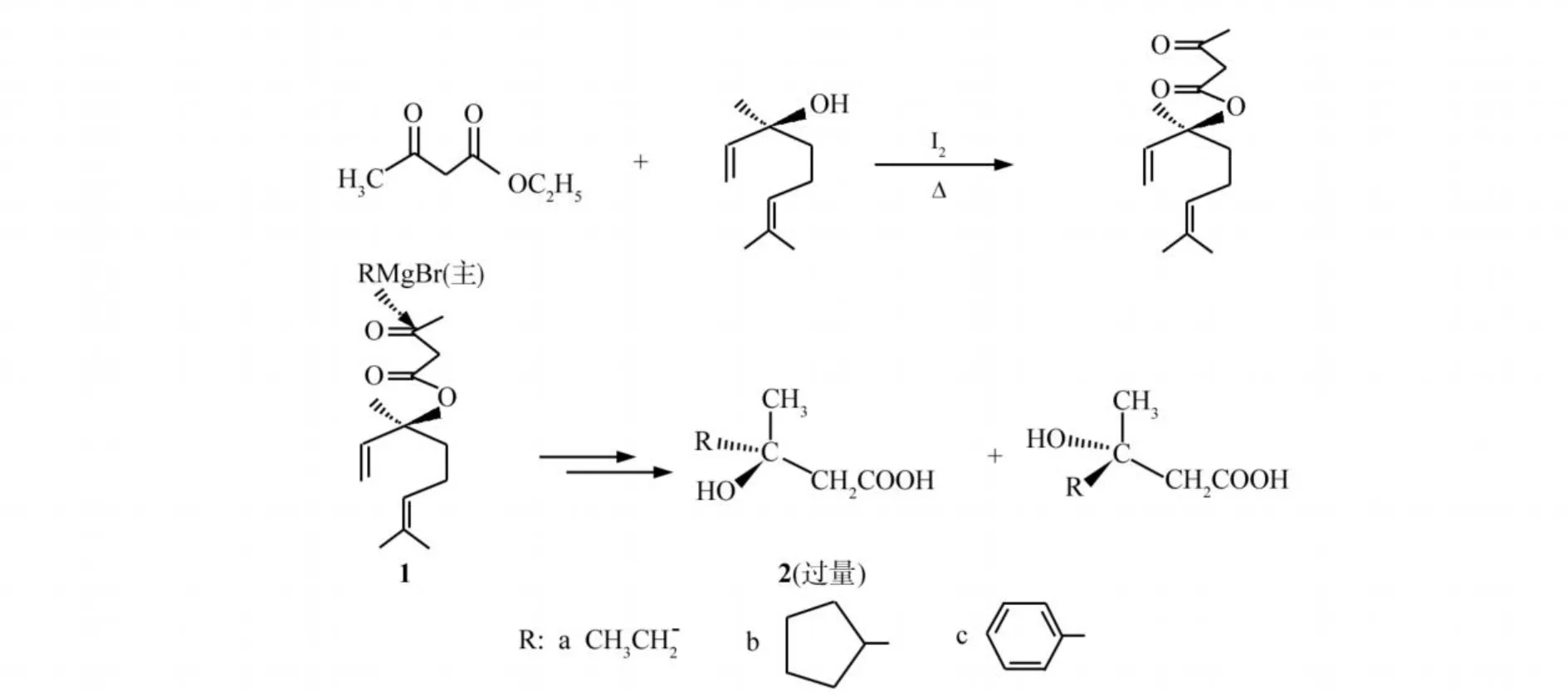
图1 β-羟基酸的不对称合成反应Fig.1 Asymmetric synthesis forβ-hydroxyl acids
1 实验部分
1.1 试剂及仪器
右旋芳樟醇、乙酰乙酸乙酯、无水乙醚、无水乙醇、单质碘、溴乙烷、环戊基溴、溴苯、镁屑、氢氧化钠、碳酸钠、氯化钠、无水硫酸镁、无水氯化钙、浓硫酸(均为分析纯).
日本岛津 GC-17A型气相色谱仪,校正峰面积归一化法计算各组分含量,分析条件为:手性色谱柱.WCOT Fused Silica 30 m×0.25 mm×0.25μm film thickness,氢焰检测器 ,柱温120 ℃(保温2 min),再以5 ℃/min速度升温至200℃(保温10 min),气化室温度200℃,检测器温度220℃,分流比为50∶1,进样量为0.1μL;红外光谱:德国Perkin-Elmer SP One FT-IR光谱仪,KBr压片;瑞士Bruker Vance400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);旋光仪:美国POL-341型;熔点仪:北京X-4数字显示显微熔点测定仪.
1.2 酯交换反应
在100 mL三颈瓶中加入乙酰乙酸乙酯和芳樟醇各10 mL,I20.20 g后,加回流冷凝管、恒压滴液漏斗,回流3 h[4],开始蒸馏,同时补入芳樟醇,待完全反应后,冷却,粗品经碱洗(Na2SO3)、盐洗(NaCl),干燥后减压蒸馏,即得产品乙酰乙酸芳樟酯.
1.3 格氏反应
在100 mL三颈瓶中加入0.24 g镁屑、无水乙醚后,加装回流冷凝管、恒压滴液漏斗及氮气保护装置.冰盐浴下,由滴液漏斗中缓慢滴入0.01 mol卤代烃的无水乙醚溶液,滴完后回流2 h,直至镁几乎全部作用完.冷却后,滴加2.38 g乙酰乙酸芳樟酯,反应1 h后,加入少量碎冰和20 mL 20%的稀硫酸进行水解,分出有机层,蒸去乙醚后,加入一定量20%的NaOH溶液,使溶液p H=8.00.在磁力搅拌下升温至80℃皂化6 h.冷却至室温用20%稀硫酸调至p H=6.00,分出有机层,用饱和NaCl溶液冲洗,无水MgSO4干燥,去乙醚后,即得粗品β-取代-β-羟基丁酸,经柱层析纯化.
1.4 产物的测试
1.4.1 3-甲基-3-羟基戊酸(2a)
浅绿色液体 ,b p19143~146 ℃(文献值 b p19142~145 ℃),[α]20D:+0.53°(c,1 in H2O)(文献值[α]20D:+1.07°c,2.25 in H2O),1H NMR(400 MHz,D2O)δ:0.942~0.961(t,3H),1.278(s,3H),1.58~1.678(q,J=7.2 Hz,2H),2.527(s,2H),13C NMR(100 MHz,D2O)δ:177.34,71.70,44.18,34.52,26.01,8.23,IR(液膜法):2 954,2 924,2 852,2 662,1 713,1 462,1 377,1 164,803 cm-1.
1.4.2 3-环戊基-3-羟基丁酸(2b)
浅绿色固体 ,m p 68~69 ℃,[α]20D:-0.5°(c,0.5 in EtOH),1H NMR(400 MHz,D2O)δ:1.253(s,3H),1.572~1.576(m,4H),1.767~1.775(m,4H),1.89~2.02(m,1H),2.105(s,2H),13C NMR(100 MHz,D2O)δ:175.90,73.20,48.14,38.39,30.71,28.68,20.10,IR(KBr):2 923,2 852,1 715,1 463,1 377,1 261,1 030,804 cm-1.1.4.3 3-苯基-3-羟基丁酸(2c)
浅绿色固体 ,m p 50~52 ℃(文献值 m p 50~53 ℃),[α]20D:+5.33°(c,0.5 in EtOH)(文献值[α]20D:+11°c,0.5 in EtOH),1H NMR(400 MHz,D2O)δ:7.575~7.596(d,J=7.2 Hz,2H),7.406~7.443(t,J=7.2 Hz,2H),7.311~7.350(t,J=6.8 Hz,1H),1.257(s,3H),2.144(s,2H),13C NMR(100 MHz,D2O)δ:174.90,130.03,129.62,126.87,125.39,71.50,41.00,22.76,IR(KBr):3 058,3 033,2 857,1 747,1 660,1 597,1 480,1 464,1 429,1 377,1 075,902 cm-1.
2 结果与讨论
乙酰乙酸芳樟酯与格氏试剂反应时,在芳樟醇基团的手性诱导下导致了格氏试剂的进攻具有立体选择性,即主要从空间阻碍较小的甲基一方进攻羰基,得到以R或S构型过量的产物,当R为乙基时,是主链的一部分,而当R为环戊基或苯基时,为取代基,因此得到的构型过量产物不一样.所得结果见表1.
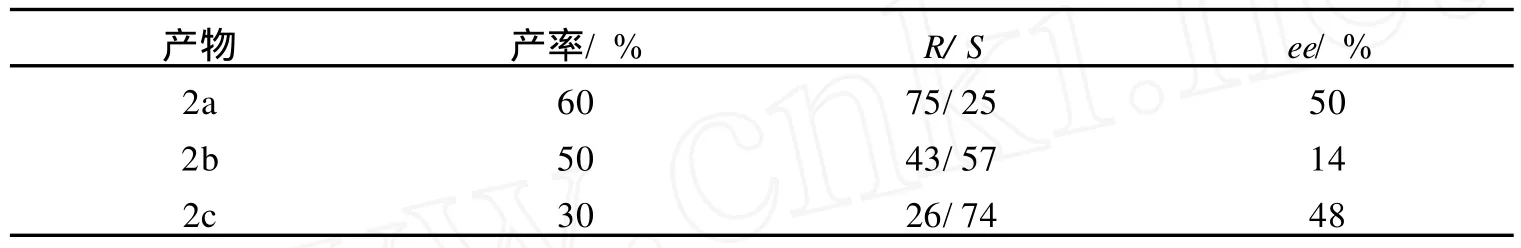
表1 乙酰乙酸芳樟酯与不同格氏试剂反应的结果Table 1 The reaction result of linalyl actoacetate with different Grignard reagent
3 结论
(1)用I2做催化剂合成乙酰乙酸芳樟酯具有较好的立体选择性.(2)格氏试剂与乙酰乙酸芳樟酯的反应具有立体选择性,得到某种构型过量的产物,经过水解、纯化后ee值最高的达50%.
[1]林翔云.天然芳樟醇与合成芳樟醇[J].化学工程与设备,2008,7:21-26.
[2]朱志庆,吕自红,刘亚涛,等.对甲苯磺酸催化合成乙酸芳樟酯[J].精细化工,2004,21(10):410-411.
[3]郭谊,周 新,方 玲,等.乙酸芳樟酯的合成研究[J].精细化工,2002,19(6):334-335.
[4]魏荣宝,梁娅,卢世荣.DMAP催化合成乙酸芳樟酯的研究[J].天津理工学院学报,1998,14(1):23-26.
[5]魏荣宝,梁娅,吴锦国,等.聚苯乙烯支载N-苄基-N-甲基氨基吡啶催化合成乙酸芳樟酯的研究[J].高分子学报,1999(1):42-47.
[6]Chavan S P,Kale R R,Shivasamkar K,et al.A simple and efficient method for ransesterification ofβ-ketoesters catalysed by iodine[J].S ynthesis,2003:2695-2697.
Asymmetric Synthesis of β-Hydroxyl Acid with Linalool as Chiral Source
Chiralβ-keto ester was synthesizedviathe ester exchange reaction of chiral source linalool with acetoacetate.The resultant chiralβ-keto ester was then allowed to react with different Grignard reagents,generating asymmetricβ-hydroxyl acids.The products were analyzed using a chiral column.Results indicate that the reactions of chiralβ-keto ester with various Grignard reagents have different degrees of stereoselectivity.The products areβ-hydroxyl acids with excess ofR-orS-configuration,whose maximumeevalue is as much as 50%.
linalool;chiral source;β-hydroxyl acids;asymmetric synthesis
O 623.65
A
1008-1011(2010)05-0030-03
2010-05-12.
国家自然科学基金资助项目(20662005);江西省教育厅科学技术研究项目(GJJ-08529).
葛军英 (1980-),女,助教,硕士,主要从事有机合成研究.E-mail:gjy0401433@163.com.

