SKF83959调节大鼠的自发活动和焦虑行为
杜 丹, 张 双, 董素珍
(华东师范大学脑功能基因组学教育部、上海市重点实验室,上海 200062)
SKF83959调节大鼠的自发活动和焦虑行为
杜 丹, 张 双, 董素珍
(华东师范大学脑功能基因组学教育部、上海市重点实验室,上海 200062)
为了探讨多巴胺D1类受体激动剂SKF83959在动物自发活动、焦虑情绪和学习记忆方面的作用,将3月龄雄性大鼠随机分为给药组和空白对照组,分别腹腔注射1.0 mg/kg SKF83959或等体积PBS缓冲液后,进行行为学测试.实验结果显示,与对照组相比,SKF83959注射后的大鼠在开放场测试中水平方向活动次数和总活动时间显著增加;在高架十字迷宫中给药组大鼠在闭臂区的停留时间更长,总穿臂次数和开臂、闭臂进臂次数也都减少.在恐惧性条件学习中,SKF83959处理组大鼠的记忆能力与对照组大鼠之间没有明显差异.结果提示,SKF83959能够提高大鼠的活动量,增加大鼠的焦虑情绪行为,而对大鼠恐惧记忆没有明显影响.
焦虑情绪; 多巴胺受体; 自发活动; SKF83959
Abstract:To investigate the effects of the selective agonist of dopamine D1-like recep to rs SKF83959 in locomotion activity,anxiety,and learning and memo ry,3-month-old male ratswere random ly divided into two groups:drug-administrated group in w hich SKF83959 was injected(i.p.1.0 mg/kg),and control group in w hich PBS buffer with equivalent volume was emp loyed instead of SKF83959.Behavio ral tests were then conducted.SKF83959 administration induced a significant increase in both totalmove times and totalmove time,as revealed by open field test.In elevated p lusmaze test,rats in drug-administrated group exhibited much longer time staying in the close arm s,w ith significant decreases in entries to total arm s,the open arm s and the close arms.However,fear conditioning test showed no difference in fear memory between drug-administrated group and control group.The results indicate that SKF83959 can enhance the locomo tion and anxiety.However,it does not affect the fear memo ry in rats.
Key words:anxiety; dopamine recep tor; locomotion activity; SKF83959
0 引言
多巴胺系统作为哺乳动物神经系统中重要的神经递质,参与调控多种生理过程和神经活动.根据分子结构和药理学特征,多巴胺受体可分为两类,D1类受体和D2类受体,它们都是 G蛋白偶联受体.D1类受体包括D1和D5(又称D1B),D2类受体包括D2,D3和D4.D1类受体能与两种 G蛋白耦联,分别介导 Gs通路(腺苷酸环化酶(AC)/cAM P通路)[1-3]和 Gq通路(β磷脂酶 C(PLCβ)/磷酸肌醇(PI)通路)[4-6].在 Gq通路中,D1类受体激活PLCβ,后者催化磷酸肌醇水解产生甘油二酯(DA G)和三磷酸肌醇(IP3).DA G激活蛋白激酶C(PKC),进而活化下游多种信号转导分子,引起下游基因表达的改变,参与调控细胞的生长、分化及凋亡等生理过程.而IP3作为重要的第二信使,能够释放细胞内贮存的钙离子,钙离子可以与钙调素结合,激活下游钙/钙调素调依赖性蛋白激酶(CaM K),与突触可塑性和学习记忆等过程密切相关[7-9].
多巴胺可参与多种生理活动.如控制运动,帕金森氏症病人就是由于中脑黑质区多巴胺缺乏而导致运动功能障碍[1].此外,多巴胺受体在调节大脑高级活动如认知功能的不同方面也起到非常重要的作用[10].D1类受体主要调节包括空间学习记忆、逆转学习、消退学习以及激励学习等生理过程[11].除参与调节学习记忆过程外,多巴胺受体也参与情感的调节.多巴胺受体在前额叶皮层和海马等区域有大量分布,而腹正中前额叶皮层(Vm PFC)被研究证实参与了对动物认知行为和焦虑情绪的调控[12].已有研究表明D2和D3受体可能在焦虑行为中起作用[12,13],而D4受体作用不明显[14].D1类受体也可能参与调节焦虑行为[15].然而,对于多巴胺受体通过哪条通路参与调节学习记忆和焦虑行为,目前尚不清楚.有研究显示,细胞内钙/钙调素调依赖性蛋白激酶IV(CaM K IV)敲除小鼠表现出焦虑情绪降低的行为[16],而CaM K IV下游的cAMP效应元件结合蛋白(CREB)敲除小鼠则表现出升高的焦虑情绪行为[17].因此,这些细胞内分子除了参与学习记忆外,可能也参与了在焦虑情绪方面的调节.
SKF83959是一种benzazepine类化合物,能够特异地激活多巴胺D1类受体介导的 Gq通路中的磷脂酶 C(PLC),升高细胞内钙离子水平[18],其作用可被D1类受体抑制剂SCH23390所阻断[19,20].但SKF83959却不能激活腺苷酸环化酶使cAM P水平升高[5,20,21],相反,在细胞水平的研究表明,它能抑制cAM P水平的升高[20].因此SKF83959既是多巴胺D1类受体 Gq通路上的激动剂,又是 Gs通路的拮抗剂.在培养的大鼠皮层细胞中,SKF83959能激活PLC/IP3,升高细胞内钙离子浓度[22].动物体内注射SKF83959可以诱导出多巴胺D1类受体调控的行为,如啮齿类动物的刷毛和空嚼动作[23].在帕金森氏症动物模型中应用SKF83959可以降低动物运动障碍的发生[24,25].作为治疗帕金森氏症的潜在药物,SKF83959有较大的研究价值.本文将对SKF83959在大鼠自发活动、焦虑情绪、探索行为和学习记忆等方面的影响进行检测,初步探讨多巴胺D1类受体对这些行为的调控作用.
1 材料与方法
1.1 动物和药物处理
野生型Sp rague-Daw ley大鼠,购自中国科学院上海实验动物中心,由华东师范大学脑功能基因组学实验动物中心饲养繁殖.每笼2~3只,自由进食,饮水,12 L/12 D昼夜交替,每日7:00~19:00开灯,19:00~次日7:00熄灯.室温(22±2)℃,相对湿度50%~60%.所有实验均在8:00~18:00间进行.选取3月龄体重相近的雄性大鼠用于行为学实验.每次实验前配制新鲜药物溶液.SKF83959(购自Sigma公司)溶于10%乙醇,用 PBS溶液稀释至0.5 mg/mL.实验前15 min进行腹腔注射,药物注射的有效浓度参考Dow nes和 Zhen,为1 mg/kg体重[24,26],实验对照组注射等体积 PBS缓冲液.
1.2 实验器材设备
开放场测试系统(truescan)、水迷宫记录系统和恐惧性条件学习实验系统均购自美国Coulbourn公司;高架十字迷宫DigBehv动物行为视频跟踪分析系统购买自上海吉量软件科技有限公司(DigBehv-LR1).
1.3 行为学方法
1.3.1 大鼠开场实验
开场实验是分析大鼠的自发活动和探索能力的行为学检测.在实验开始前3天,每天在实验环境中抚摸大鼠5 min.实验时,分别将每只大鼠放入开场箱中心,应用truescan动物行为视频跟踪分析系统跟踪记录5 min.然后取出大鼠,将箱底及四壁清理干净,并用75%的酒精除去其残留的气味.实验完成后,分析大鼠的总活动次数和总活动时间.大鼠原地上下或左右移动头部、四肢和身体,或离开原来位置进行探索等动作均视为活动行为.排除自发活动能力差异较大的个体,随机选取自发活动水平相似的两组大鼠,作为给药组和对照组,分别注射SKF83959或PBS,在注射后15 min,再次放入开放场中检测自发活动情况.
1.3.2 高架十字迷宫
高架十字迷宫用于测试情绪性焦虑相关行为.大鼠高架十字迷宫规格:内径长×宽×高分别为开臂50 cm×10 cm×1 cm,闭臂50 cm×10 cm×40 cm,中心区域10 cm×10 cm,迷宫离地高度50 cm.实验前3天,每天抚摸大鼠,每只5 min;高架十字迷宫实验前15 min进行药物腹腔注射.实验开始时将大鼠头朝开臂方向放在两壁交汇处,暗光下录像记录大鼠在开壁和闭壁中分别停留时间及穿越次数,每只5 min.实验完成后将大鼠取出,将两臂清理干净,喷洒酒精除去气味.用高架十字迷宫行为学软件进行数据分析.实验结果以记录时间与总时间的比值(%)作为衡量标准.分析大鼠在开臂、闭臂分别停留时间和穿臂次数.
1.3.3 恐惧性条件学习
为了检测SKF83959在学习记忆中的作用,应用恐惧性条件学习测试.装置包括恐惧性条件反射箱(20 cm×20 cm×40 cm)、刺激生成器和摄像机连接的分析软件.实验前3天每天抚摸大鼠每只5 min,并在实验的房间适应1 h.
适应后进入训练阶段,此阶段不给予药物注射.将大鼠放入电击箱中,适应3 min后给予30 s 85 dB声音刺激,在30 s声音的最后2 s给予大鼠1 m A的电流刺激.电击结束后使大鼠在电击箱中停留30 s.24 h后进行记忆测试,测试前15 m in给予药物注射.测试时,将大鼠放入电击箱中3 min,记录其活动状况(contextual freezing),之后放入另一不同新环境适应3 min后,给予3 min同样85 dB的声音刺激,记录活动状况(cued freezing).如果大鼠除呼吸外整个身体完全不动,则认为呈僵直状态(freezing).用僵直百分比(即记录时间内僵直时间占总时间的百分比)作为指标,以评价大鼠的恐惧记忆表现.
1.3.4 数据处理
用SigmaPlo t软件进行行为学数据的分析,数据以平均值±标准误差的形式显示.各组之间的数据进行双尾t检验,P值小于0.05时认为有显著性差异,小于0.01时认为有极显著性差异.
2 结果
2.1 开场实验
未给药的野生型大鼠随机分成两组,它们的总活动次数分别为:组1(n=8)36.250±1.278,组2(n=8)35.250±1.634(见图1 A,P>0.05).总活动时间分别为:组1(91.779±1.587)s,组2(90.481±1.435)s(见图1 B,P>0.05),两组数据均无明显差异.它们的自身自发活动水平无明显差别,可以设定为给药组和对照组.
给药组大鼠与对照组相比,显示出了显著性升高的自发活动量 (见图1 C和D).其中,总活动次数在给药组中明显升高,分别为对照组(n=8)31.833±3.839,SKF83959处理组(n=8)44.917±3.489(见图1 C,*P<0.05);给药组的总活动时间也相对于对照组显著延长,分别为 SKF83959处理组 (138.500±11.166)s,对照组(88.375±11.369)s(见图1D,**P<0.01).
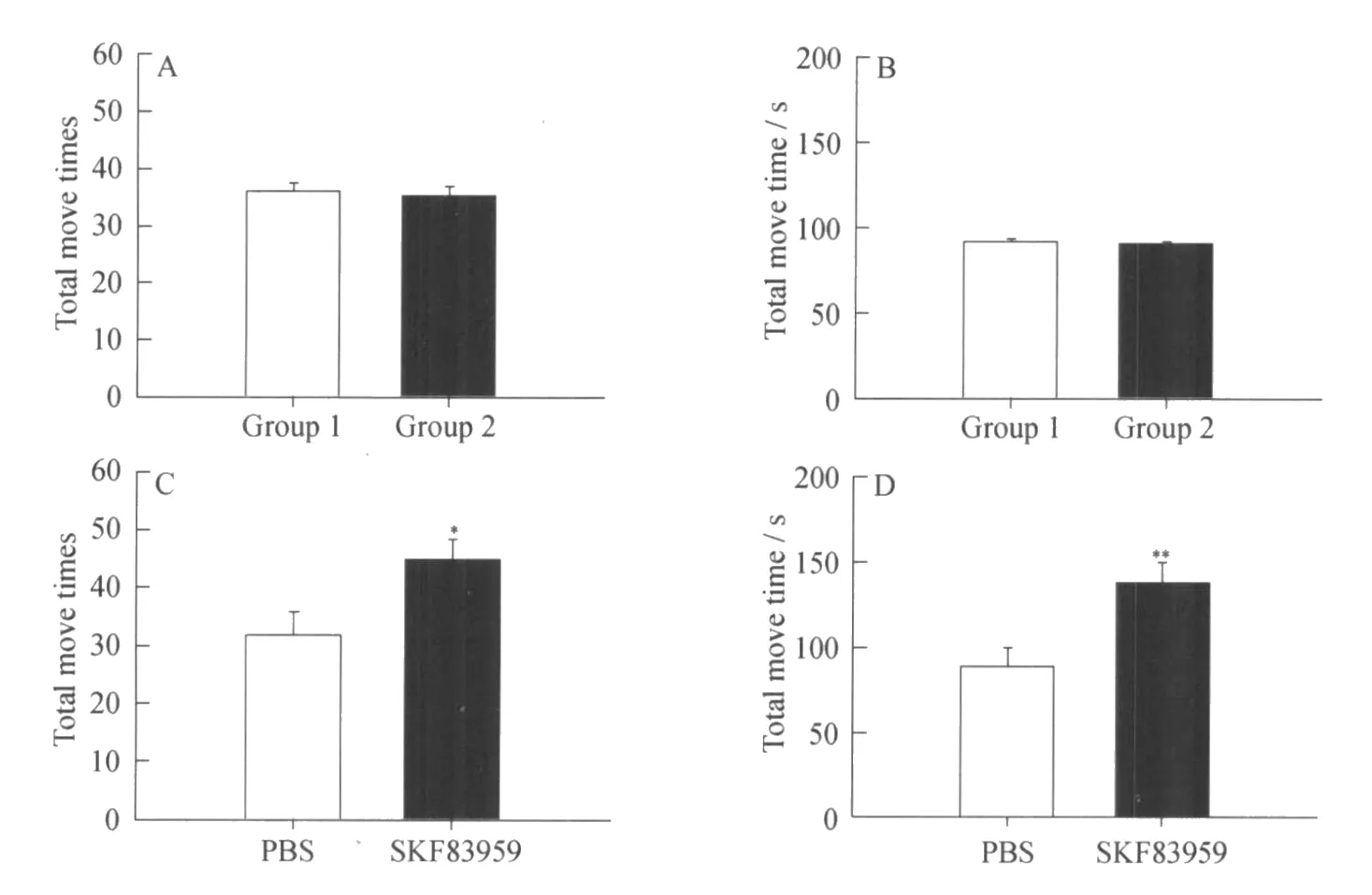
图1 给药前和SKF83959给药后两组的大鼠的自发活动Fig.1 Locomotion activity of the rats befo re and after SKF83959 administration
2.2 高架十字迷宫实验
实验结果以在不同臂中的停留时间与总记录时间的比值(%)作为衡量标准.两组大鼠在开臂和闭臂总停留时间与总时间的百分比分别为:对照组(n=12)(69.427±2.536)%,SKF83959给药组(n=12)(76.356±3.236)%,二组之间没有差异(见图2 A,P>0.05).SKF83959给药组大鼠在开臂中停留时间与总时间的百分比((15.982±4.191)%)显著低于对照组大鼠((30.409±5.152)%)(见图2 B,*P<0.05).SKF83959给药组大鼠的总穿臂次数、开臂进入次数和闭臂进入次数明显低于对照组(见图2 C,对照组 vs给药组分别为(13.167±0.716)vs(6.583±1.118),**P<0.01;(4.083±0.753)vs(2.091±0.547),*P<0.05;(9.083±0.848)vs(4.250±0.897),**P<0.01).给药组大鼠表现出逃避开放空间而更倾向于停留在闭臂区域的行为.同时,给药组大鼠的总穿臂次数和开臂进臂次数、闭臂进臂次数都明显减少.实验结果提示SKF83959有增加焦虑情绪的作用.
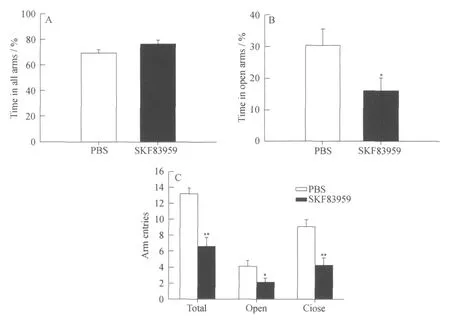
图2 SKF83959处理后大鼠在焦虑情绪测试中显现出较高的焦虑情绪Fig.2 Enhanced anxiety responses in rats after SKF83959 administration
2.3 恐惧性条件学习
电击后24 h两组大鼠在海马相关条件性记忆测试中僵直反应分别:对照组(n=13)(39.330±6.885)%,给药组(n=13)(38.032±6.009)%,两组之间没有明显差异 (见图3 Contextual freezing,P>0.05).在杏仁核相关的非条件性记忆测试中两组大鼠的僵直反应分别为:对照组(36.439±5.852)%,给药组(31.383±6.381)%,两组之间也没有显著差异(见图3 Cued freezing,P>0.05).实验结果显示给予SKF83959注射的大鼠在恐惧记忆提取过程中与空白对照组大鼠没有显著性差异.
3 讨论
尽管多巴胺受体的调节功能正在被逐渐发现和研究,但其具体调节机制目前仍不清楚.大脑中多巴胺在细胞水平的作用之所以难以研究,其原因在于多巴胺在解剖学、药理学和生物化学上具有多重功能.本实验利用行为学方法检测了能调控多巴胺受体活性的化合物SKF83959对大鼠自发活动、焦虑行为及恐惧性学习等方面的影响,初步探讨了多巴胺D1类受体的调控功能.
开场实验是将实验动物放入开阔环境后,用于观察分析动物的自发活动和探索能力的行为学检测任务.在未经药物处理测试中,随机分组的两组大鼠自发活动能力保持一致,说明实验所选大鼠自身活动能力相同,不会干扰后续的实验结果.在药物处理测试中,给药组大鼠与PBS对照组大鼠相比,总活动时间和总活动次数有明显升高,自发活动量显著增强,此结果与已经报道的SKF83959在啮齿类动物自发活动能力上的经典药效作用相似[23],证明其自发活动能力的改变是由于注射了SKF83959.而纹状体是调控动物的自发活动的重要脑区,实验结果说明纹状体中多巴胺受体可能参与了动物的活动行为控制.
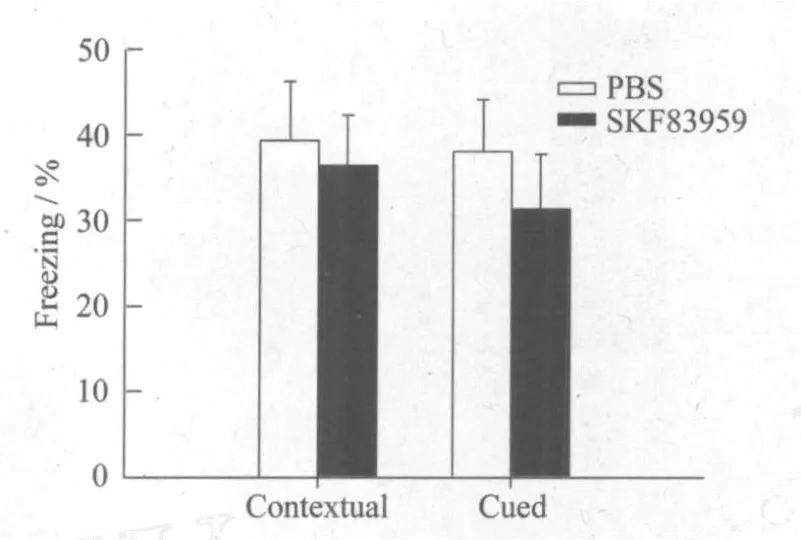
图3 SKF83959在恐惧性条件学习测试中无明显作用Fig.3 No significant effect of SKF83959 in learning and memo ry tests
高架十字迷宫是情绪性和非条件性的焦虑相关行为测试,啮齿类动物对于新环境有强烈的好奇和探索的欲望,但高度、陌生环境和明亮的光线又是导致焦虑产生的因素[27].通常以动物在开臂停留时间和穿臂次数作为衡量动物焦虑情绪程度的标准.在高架十字迷宫测试中观察到,SKF83959注射后动物在开臂停留时间显著缩短,而在闭臂停留的时间则显著延长;值得注意的是,动物的穿臂次数并没有增加反而减少,但是动物在同一闭臂中却表现出重复性的身体折回,表现出对陌生环境探索欲望的降低.与对照组相比,给药组大鼠表现出不愿离开停留区域进入新环境进行探索活动,提示SKF83959干扰了动物情绪反应,加剧了动物的焦虑情绪.由于腹腔注射的SKF83959作用范围分布全脑,各个脑区分别或联合支配着动物的神经系统活动,多巴胺受体在其中发挥的作用也十分复杂.探索欲望的降低说明多巴胺可能在脑功能调节中发挥着许多未知的作用,例如在大鼠惊跳反射(acoustic startle reflex)中,SKF83959所表现的效应与经典的D1类受体激动剂不同,SKF83959提高了惊跳反射动作幅度(startle amp litude),却降低了脉冲抑制(p repulse inhibition,PPI).在105 dB声音刺激时,SKF83959显示出了剂量依赖性的惊跳反射动作发生前的脉冲抑制潜伏期的延长效应,但是在95 dB声音刺激时却没有干扰惊跳反射动作幅度,也没有影响惊跳反射动作发生前的潜伏期[28].
在恐惧性条件学习测试中,记忆提取过程(即测试阶段)给予药物处理后,大鼠在海马和杏仁核相关的恐惧记忆提取过程中表现出与对照组大鼠相似的记忆提取能力.当受到强烈的电击刺激后再回到此环境,大鼠会表现出明显的活动抑制行为,即僵直反应.此种反应是对先前强烈刺激的记忆唤醒表现.这种记忆包含了海马的环境空间记忆和杏仁核参与的声音恐惧情绪[29].本实验显示,SKF83959没有影响大鼠的僵直反应百分比,表明激活多巴胺受体不影响动物对已经形成了的恐惧记忆再提取过程.
有研究表明,SKF83959的作用具有双重性,它既是多巴胺D1类受体 Gq通路的选择性激动剂,也是 Gs通路的拮抗剂[18,20,21,23].其对于 Gs通路的体内抑制作用主要由Andringa等进行研究[18,30],而多数研究者仍然认为 SKF83959激活的 Gq通路可能有着更重要的作用[5,22,28].曾有不同研究者检测了多巴胺D1类受体抑制剂 SCH23390和部分激动剂SKF38393对动物自发活动和焦虑行为的影响,结果显示,SCH23390降低了小鼠的焦虑行为[31],但对自发活动没有明显影响[33];而能通过 Gs通路激活腺苷酸环化酶,升高cAMP水平的D1类受体选择性激动剂SKF38393[34]也能降低大鼠自发活动能力[35],却对动物在高架十字迷宫中的表现没有明显作用[32].基于以上研究及本实验结果,推测SKF83959可能是通过 Gq通路起到激活作用,但是究竟是否通过Gq通路起作用,还需要进一步的实验深入研究.
[1]M ISSALE C,NASH S R,ROBINSON SW,et al.Dopamine receptors:from structure to function[J].Physiol Rev,1998,78(1):189-225.
[2]MONSMA F J JR,MA HAN L C,MCV ITTIE L D,et al.Molecular cloning and exp ression of a D1 dopamine receptor linked to adenylyl cyclase activation[J].Proc Natl Acad Sci USA,1990,87(17):6723-6727.
[3]SIBLEY D R,MONSMA F J JR,SHEN Y.Molecular neurobiology of dopaminergic receptors[J].Int Rev Neurobiol,1993,35:391-415.
[4]UNDIE A S,FRIEDMAN E.Stimulation of a dopamine D1 receptor enhances inositol phosphates formation in rat brain[J].J Pharmacol Exp Ther,1990,253(3):987-992.
[5]PANCHAL INGAM S,UND IE A S.SKF83959 exhibits biochemical agonism by stimulating[(35)S]GTP gamma S binding and phosphoinositide hydrolysis in rat andmonkey brain[J].Neuropharmacology,2001,40(6):826-837.
[6]PACHECO M A,JOPE R S.Comparison of[3H]phosphatidylinositol and[3H]phosphatidylinositol 4,5-bisphosphate hydrolysis in postmortem human brainmembranesand characterization of stimulation by dopamine D1 recepto rs[J].J Neurochem,1997,69(2):639-644.
[7]BITO H,DEISSEROTH K,TSIEN RW.CREB phosphorylation and dephosphorylation:a Ca(2+)-and stimulus duration-dependent switch for hippocampal gene exp ression[J].Cell,1996,87(7):1203-1214.
[8]SODERL ING T R.CaM-kinases:modulators of synaptic plasticity[J].Curr Opin Neurobiol,2000,10(3):375-380.
[9]ZHEN X,GOSWAM IS,ABDAL ISA,et al.Regulation of cyclin-dependent kinase 5 and calcium/calmodulin-dependent p rotein kinase IIby phosphatidylinositol-linked dopamine recep to r in rat brain[J].Mol Pharmacol,2004,66(6):1500-1507.
[10]N IEOULLON A.Dopamine and the regulation of cognition and attention[J].Prog Neurobiol,2002,67(1):53-83.
[11]RASH ID A J,SO C H,KONGM M,et al.D1-D2 dopam ine recep to r heterooligomersw ith unique pharmacology are coup led to rapid activation of Gq/11 in the striatum[J].Proc Natl Acad Sci USA,2007,104(2):654-659.
[12]WALL PM,BLANCHARD R J,YANGM,et al.Infralimbic D2 recep to r influences on anxiety-like behavio r and activememory/attention in CD-1 mice[J].Prog Neuropsychopharmacol Biol Psychiatry,2003,27(3):395-410.
[13]STEINER H,FUCHS S,ACCIL ID.D3 dopamine receptor-deficient mouse:evidence for reduced anxiety[J].Physiol Behav,1997,63(1):137-141.
[14]NAVARRO J F,LUNA G,GARCIA F,et al.Effectsof L-741,741,a selective dopamine receptor antagonist,on anxiety tested in the elevated plus-maze in mice[J].Methods Find Exp Clin Pharmacol,2003,25(1):45-47.
[15]INOUE T,IZUM IT,L IX B,et al.Effect of a dopamine D1/5 recep tor antagonist on haloperidol-induced inhibition of the acquisition of conditioned fear[J].Eur J Pharmacol,2005,519(3):253-258.
[16]SHUM F W,KO SW,LEE Y S,et al.Genetic alteration of anxiety and stress-like behavio r in mice lacking CaM KIV[J].Mol Pain,2005(1):22.
[17]VALVERDEO,MANTAMADIOTIS T,TORRECILLA M,et al.Modulation of anxiety-like behavior and morphine dependence in CREB-deficientmice[J].Neuropsychopharmacology,2004,29(6):1122-1133.
[18]COOLS A R,LUBBERSL,VAN OOSTEN R V,et al.SKF 83959 is an antagonist of dopamine D1-like recep to rsin the p refrontal cortex and nucleus accumbens:a key to its antiparkinsonian effect in animals?[J].Neuropharmacology,2002,42(2):237-245.
[19]KURO IWA M,BA TEUP H S,SHU TO T,et al.Regulation of DARPP-32 phosphorylation by three distinct dopam ine D1-like recep to r signaling pathways in the neostriatum[J].J Neurochem,2008,107(4):1014-1026.
[20]JIN L Q,GOSWAM IS,CA I G,et al.SKF83959 selectively regulates phosphatidylinositol-linked D1 dopamine receptors in rat brain[J].J Neurochem,2003,85(2):378-386.
[21]ANDRINGA G,DRUKARCH B,LEYSEN J E,et al.The alleged dopamine D1 receptor agonist SKF 83959 is a dopamine D1 recep to r antagonist in p rimate cells and interacts w ith other recep tors[J].Eur J Pharmacol,1999,364(1):33-41.
[22]YU Y,WANGJ R,SUN P H,et al.Neurop rotective effectsof atypical D1 recep to r agonist SKF83959 aremediated via D1 recep to r-dependent inhibition of glycogen synthase kinase-3 beta and a recep tor-independent anti-oxidative action[J].J Neurochem,2008,104(4):946-956.
[23]CL IFFORD J J,TIGHE O,CROKE D T,et al.Conservation of behavioural topography to dopamine D1-like recep tor agonists in mutantmice lacking the D1A recep to r imp licates a D1-like recep to r not coup led to adenylyl cyclase[J].Neuroscience,1999,93(4):1483-1489.
[24]ZHEN X,GOSWAM IS,FRIEDMAN E.The role of the phosphatidyinositol-linked D1 dopamine recep to r in the pharmacology of SKF83959[J].Pharmacol Biochem Behav,2005,80(4):597-601.
[25]ZHANG H,MA L,WANG F,et al.Chronic SKF83959 induced less severe dyskinesia and attenuated L-DOPA-induced dyskinesia in 6-OHDA-lesioned rat model of Parkinson’s disease[J].Neuropharmacology,2007,53(1):125-133.
[26]DOWNES R P,WADD INGTON J L.Grooming and vacuous chew ing induced by SK&F 83959,an agonist of dopamine’D1-like’receptors that inhibits dopamine-sensitive adenylyl cyclase[J].Eur J Pharmacol,1993,234(1):135-136.
[27]L ISTER R G.The use of a p lus-maze to measure anxiety in themouse[J].Psychopharmacology(Berl),1987,92(2):180-185.
[28]ZHANG Z J,JIANG X L,ZHANG S E,et al.The paradoxical effects of SKF83959,a novel dopamine D1-like receptor agonist,in the rat acoustic startle reflex paradigm[J].Neurosci Lett,2005,382(1-2):134-138.
[29]PH ILL IPS R G,LEDOUX J E.Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning[J].Behav Neurosci,1992,106(2):274-285.
[30]ANDRINGA G,STOOF J C,COOLS A R.Sub-chronic administration of the dopamine D(1)antagonist SKF 83959 in bilaterally M PTP-treated rhesusmonkeys:stable therapeutic effects and w earing-off dyskinesia[J].Psychopharmacology(Berl),1999,146(3):328-334.
[31]DE LA MORA M P,CARDENAS-CACHON L,VAZQUEZ-GARCIA M,et al.Anxiolytic effects of intra-amygdaloid injection of the D1 antagonist SCH23390 in the rat[J].Neurosci Lett,2005,377(2):101-105.
[32]RODGERS R J,N IKUL INA EM,COLE J C.Dopamine D1 and D2 receptor ligandsmodulate the behaviour of mice in the elevated plus-maze[J].Pharmacol Biochem Behav,1994,49(4):985-995.
[33]TIMOTHY C,COSTALL B,SM YTHEJW.Effectsof SCH23390 and raclop ride on anxiety-like behavior in rats tested in the black-w hite box[J].Pharmacol Biochem Behav,1999,62(2):323-327.
[34]CORONASV,KRAN TIC S,JOURDAN F,et al.Dopamine recep tor coupling to adenylyl cyclase in rat olfactory pathway:a combined pharmacological-radioautographic app roach[J].Neuroscience,1999,90(1):69-78.
[35]MA TTINGLY B A,ROWLETT J K,LOVELL G.Effectsof daily SKF 38393,quinpirole,and SCH 23390 treatments on locomotor activity and subsequent sensitivity to apomorphine[J].Psychopharmacology(Berl),1993,110(3):320-326.
SKF83959 regulates locomotion activity and anxiety in rats
DU Dan, ZHANG Shuang, DONG Su-zhen
(Key Laboratories of MOE and STCSM,Shanghai Institute of Brain Functional Genom ics,East China N ormal University,Shanghai 200062,China)
Q426
A
1000-5641(2010)04-0103-08
2009-04
国家科学与技术部863合作项目(2007AA02Z163)
杜丹,女,硕士研究生.E-mail:beckyummy@yahoo.com.cn.
董素珍,女,助理研究员,研究方向为分子神经生物学.E-mail:szdong@brain.ecnu.edu.cn.

