植酸酶phyA基因在解脂耶氏酵母po1h中的表达
陈云,邹由,王一丁,马立新
1 四川师范大学生命科学学院,成都 610101
2 湖北大学生命科学学院,武汉 430062
工业生物技术
植酸酶phyA基因在解脂耶氏酵母po1h中的表达
陈云1,邹由2,王一丁1,马立新2
1 四川师范大学生命科学学院,成都 610101
2 湖北大学生命科学学院,武汉 430062
本实验通过 PCR方法从毕赤酵母 GS115-phyA中扩增出不含有信号肽及内含子的黑曲霉 NRRL3135植酸酶phyA基因,并将其克隆到表达载体pINA1297中,得到表达载体pINA1297-phyA,利用醋酸锂转化法将线性化载体转化到解脂耶氏酵母po1h中,通过YNBcasa和PPB平板筛选出阳性表达菌株,阳性菌株在YM培养基中28℃培养6 d后酶活达到最大为636.23 U/mL。表达上清经SDS-PAGE分析得到表达植酸酶分子量约为130 kDa,但通过去糖基化处理后其分子量变为51 kDa,与理论值相符。经过酶学性质分析表明重组植酸酶最适pH为5.5,最适温度为55℃,该酶在pH 2.0~8.0处理1 h后仍有较高酶活,并且90℃处理10 min后还有86.08%的残留酶活,其抵抗胃蛋白酶和胰蛋白酶能力也较强。
黑曲霉,植酸酶,phyA基因,解脂耶氏酵母po1h
Abstract:Using the polymmerse chain reaction (PCR), we amplified the phytase genephyAfromPichia pastorisGS115-phyAinAspergillus nigerNRRL3135 without the signal peptide sequence and intron sequence,. Then, it was cloned into pINA1297 vector to generate a recombinant vector of pINA1297-phyA. pINA1297-phyAwas linearized and transformed intoYarrowia lipolyticapo1h by the lithium acetate method. The positive transformants were obtained by YNBcasaand PPB plates, after induced in YM medium at 28°C for 6 day. The activity of the expressed phytasephyAreached 636.23 U/mL. The molecular weight of the enzyme was 130 kDa measured with SDS-PAGE analysis, whereas its molecular size reduced to 51 kDa after deglycosylation which is correspond with theoretical value. The enzymatic analysis of the recombinant phytasephyArevealed its optimal pH and temperature was 5.5 and 55°C, which had high activity after incubated in pH ranged from 2.0 to 8.0 for 1 h. Moreover, its activity remained 86.08% after exposure to 90°C for 10 min. It also was resistant to pepsin or trypsin treatment.
Keywords:Aspergillus niger, phytase,phyAgene,Yarrowia lipolyticapo1h
植酸酶是一种新型的环保型“绿色”饲料添加剂,它能分解饲料中的植酸和植酸盐形成禽畜可利用的磷酸和肌醇,提高了饲料中有机磷的利用率,减少了添加无机磷的量,降低饲料成本,减轻磷污染,并可抑制植酸对矿物质和蛋白质的亲和力,解除植酸的抗营养作用[1]。而商品化植酸酶大多为来源于曲霉的植酸酶,其中由黑曲霉Aspergillus nigerNRRL3135菌株phyA基因编码的植酸酶应用最早最广泛[2]。
目前黑曲霉Aspergillus nigerNRRL3135菌株phyA基因已经在酿酒酵母、毕赤酵母GS115、KM71和X-33中得到表达,但还未见其在非常规酵母解脂耶氏酵母中进行表达研究,而解脂耶氏酵母被认为是安全的 (Generally regarded as safe),因此,能用于食品和药物生产上。在上世纪90年代解脂耶氏酵母被成功地开发为一种新的优良酵母表达系统,它能大量分泌多种代谢产物,能利用很多普通的碳水化合物和脂肪作为碳源,这也使得它更适合于不同的工业应用[3]。
1 实验材料
1.1 菌种和质粒
重组毕赤酵母 GS115-phyA、大肠杆菌 DH10β为本实验室保存。pINA1297载体和解脂耶氏酵母polh (CLIB882:Ura−,△AEP,△AXP,Suc+) 由法国国家科学研究中心微生物学和分子遗传学实验室的Catherine Madzak教授赠送。
1.2 试剂与培养基
脱糖基化酶(Endoglycosidase H)、DNA限制性内切酶购自Promega公司。T4 DNA连接酶、LATaq酶均购自宝生物工程 (大连) 有限公司。PEG4000、醋酸锂购自Sigma公司,植酸钙为实验室自制,质粒 DNA抽提试剂盒、DNA凝胶回收试剂盒购自TaKaRa公司。其他常规试剂采用进口分装或国产分析纯。引物合成和测序由上海英骏生物工程有限公司完成。
YEPD培养基:1.0%酵母提取物,2.0%蛋白胨,2.0%葡萄糖;筛选重组解脂耶氏酵母 po1h转化子的YNBcasa培养基:0.17%YNB,2%葡萄糖,0.2%酪蛋白水解物;PPB[4]培养基:0.132%酵母提取物,2.0%葡萄糖,0.132% NH4Cl,0.032%KH2PO4,0.024% MgSO4·7H2O,0.033%Vitamin B1;用于重组解脂耶氏酵母po1h表达的YM[5]培养基:0.5%酵母提取物,2%麦芽膏,1%蛋白胨,1.5%葡萄糖。
2 方法
2.1 植酸酶phyA基因片段的克隆
将重组毕赤酵母菌种GS115-phyA接种于YEPD液体培养基中,28℃培养 48 h后挑单菌落转接到YEPD液体培养基中,摇床培养至大量菌体产生。收集菌体,利用CTAB法[6]提取其基因组DNA,并检测其抽提效果。根据植酸酶phyA基因序列[7]设计引物如下:
1297phyAF:5′-TACGGCCGTTCTGGCC ATGCT GGCAGTCCCCGCCTC-3′ (下划线为SfiⅠ酶切位点);1297phyAR:5′-CGGGGTACC CTAAGCAAAAC ACTCCGCCCAATCA-3′ (下划线为KpnⅠ酶切位点);扩增的植酸酶phyA基因的模板为GS115-phyA酵母的总DNA。PCR扩增条件:94℃5 min ;94℃30s,47℃35 s,72℃1.5min ,30个循环;72℃10 min。扩增产物用DNA回收试剂盒回收。
2.2 重组表达载体pINA1297-phyA的构建
通过PCR方法获得带有SfiⅠ和KpnⅠ酶切位点的植酸酶phyA基因片段,对载体pINA1297和扩增出的植酸酶phyA基因片段进行SfiⅠ和KpnⅠ双酶切,凝胶回收后做连接,然后将连接液转化入大肠杆菌 DH10β感受态细胞,涂布到卡那霉素抗性的LB固体平板上,放入37℃恒温培养箱中培养14 h,分别挑取长出的单菌落接种到含有卡那霉素的 LB液体培养基中,于 220 r/min恒温摇床中 37℃培养20 h,用碱抽提法抽提其质粒,然后进行电泳检验及PCR鉴定,所用引物为:F:5′-GCTACCGCCTTT ACTATTCTCACGGC-3′,R:5′-CAACGTGAGGGGA CGCCATGG-3′。最后将上述筛选出的重组子进行酶切验证及测序分析,最终找到阳性克隆即为所要构建的解脂耶氏酵母表达载体pINA1297-phyA。
2.3 解脂耶氏酵母的转化
从–80℃冰箱取出 50%甘油保存的解脂耶氏酵母po1h,在YEPD平板上划线,30℃培养约18 h,将生长出的菌体悬浮到装有1 mL 1 mol/L TE (pH 7.0)的EP管中,10 000 r/min离心1 min弃去上清,然后悬浮菌体到600 μL 0.1 mol/L醋酸锂 (pH 6.0) 中,28℃水浴孵化1 h不振荡。3 000 r/min离心2 min后弃去上清,轻悬菌体到80~120 μL 0.1 mol/L醋酸锂(pH 6.0) 中便是用于转化的感受态细胞。取 40 μL的解脂耶氏酵母po1h感受态细胞加入2 μL ssDNA和 3 μLNotⅠ线性化的重组质粒,28℃水浴孵化15 min 后加入 350 μL 1 mol/L PEG4000 (如需要可加入16 μL 1 mol/L DTT可提高转化效率),28℃水浴孵化1 h不振荡,39℃热击 10 min,加入600 μL 0.1 mol/L的醋酸锂 (pH 6.0) 中,迅速涂到筛选平板YNBcasa上,28℃培养 7~14 d[8]。
由于解脂耶氏酵母po1h是尿嘧啶营养缺陷型的菌株,而将含有尿嘧啶筛选标记的 pINA1297-phyA重组表达载体转化到解脂耶氏酵母中后,重组解脂酵母便能生长在尿嘧啶营养缺陷的YNBcasa平板上,挑取长出的菌落,提取其酵母总 DNA。采用 PCR鉴定其是否为重组子[9],所用引物为:F:5′-GCTACC GCCTTTACTATTCTCACGGC-3′,R:5′-CAACGTGG GGACAGGCCATGG-3′。反应程序:94℃ 10 min ;94℃30s,57℃45 s,72 ℃ 1.5 min,30个循环。PCR产物经0.7%琼脂糖凝胶电泳分析。
2.4 高活性重组酵母菌株的筛选
将鉴定出的重组酵母菌株点接到YEPD固体平板上28℃培养2 d,然后将其点到含有0.5%植酸钙的PPB平板上28℃培养4~7 d,挑选出水解圈大的菌株即可能为植酸酶活性较高菌株。
2.5 重组酵母菌株的表达
从PPB平板上挑取水解圈较大的重组酵母菌株接种到YM平板上28℃培养3~4 d,然后将其转接到装有100 mL的YM (pH 5.5) 液体培养基中,于28℃、220 r/min摇床中培养,离心培养液取上清即为重组酵母菌株分泌表达的胞外植酸酶phyA粗酶液,用12% SDS-PAGE电泳观察结果。
2.6 重组植酸酶酶学性质测定
取上述植酸酶粗酶液在不同pH和温度条件下,测定植酸酶酶活性。植酸酶的活性测定方法参照GB/T18634-2009进行,酶的活性单位定义为:在37℃、pH 5.5条件下每分钟水解植酸释放1 μmoL的无机磷所需要的酶量为1个酶活力单位,以U表示[10]。
2.7 胃蛋白酶和胰蛋白酶对酶活性的影响
分别加入500 μL浓度为0.5 mg/mL的胃蛋白酶(用pH 2.5的缓冲液配制) 和胰蛋白酶 (用pH 7.0的缓冲液配制) 到稀释好的500 μL粗酶溶液中,然后放于37℃水浴锅中分别处理30、60和120 min,再在常规条件下测定酶活,以未处理的酶活为100%,在其他条件下测得的酶活占最高酶活的百分数即为该酶在此条件的相对酶活[11]。
3 结果与分析
3.1 植酸酶phyA基因片段的克隆
在此PCR反应条件下,获得了一条长约1.4 kb的特异性PCR扩增条带 (图 1),符合phyA基因去掉信号肽和内含子后的理论长度1347 bp,可初步判断PCR扩增phyA基因成功。
3.2 重组表达载体的构建
构建含有植酸酶phyA基因表达片段的重组表达载体pINA1297-phyA(图2)。重组表达载体经SfiⅠ和KpnⅠ双酶切鉴定后得到一条约 1.4 kb的产物(图 3),与预期的植酸酶phyA基因序列大小一致。重组表达载体经测序后表明重组质粒中的基因片段即为植酸酶phyA基因。由此表明 pINA1297-phyA构建成功。
3.3 酵母的转化与筛选
将重组表达载体 pINA1297-phyA经NotⅠ线性化处理后转化解脂耶氏酵母 po1h。经过 YNBcasa平板筛选得到重组解脂耶氏酵母的转化子。提取酵母基因组总DNA并作为模板,用目的片段所连接的部分载体基因序列作为引物进行 PCR扩增,得到约1.4 kb的电泳带 (图 4),证明重组表达载体已经成功整合入酵母基因组DNA中。
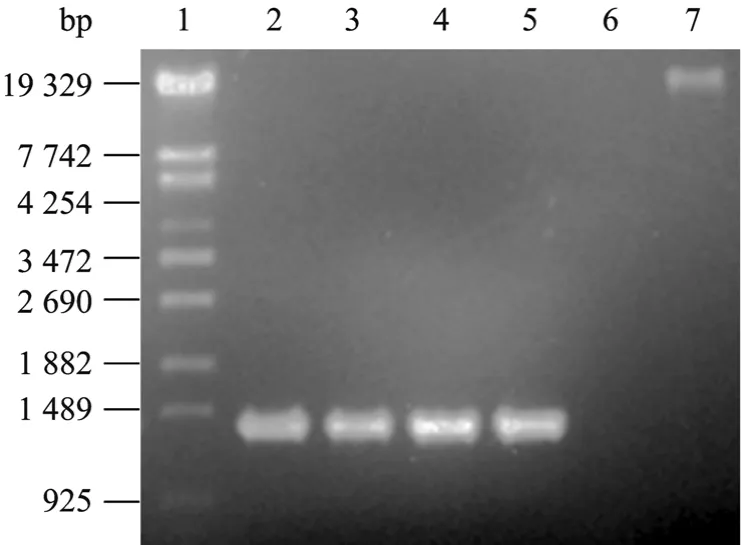
图1 PCR扩增植酸酶phyA基因产物Fig.1 PCR products of the phytasephyAgene. 1: λ-EcoT14 marker; 2−5: PCR products; 6: control; 7: DNA of the GS115-phyA.
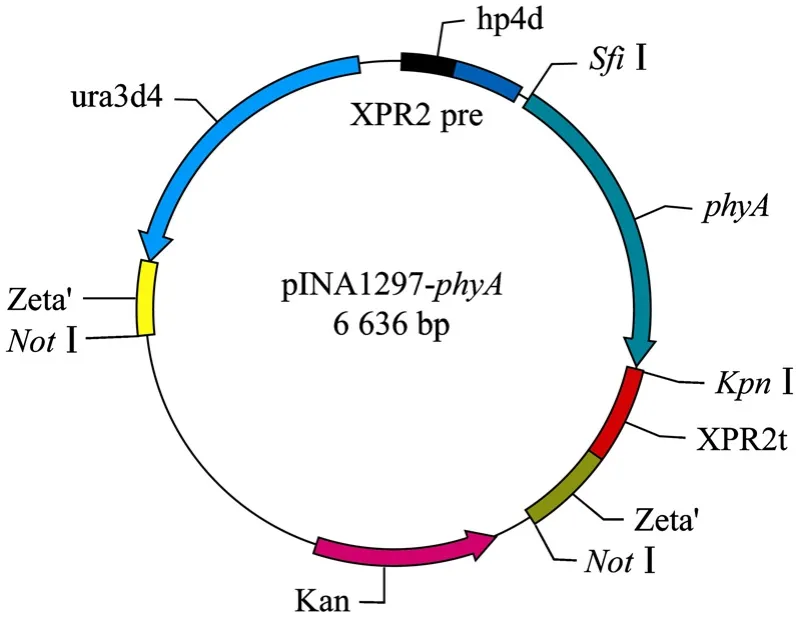
图2 重组表达载体pINA1297-phyA的物理图谱Fig.2 Physical map of recombinant plasmid pINA1297-phyA.

图3 重组质粒pINA1297-phyA的酶切鉴定Fig.3 Identification of recombinant plasmid pINA1297-phyAby enzyme digestion. 1: λ-EcoT14 marker; 2: pINA1297; 3:pINA1297 digested withSfiⅠ; 4: pINA1297 digested withSfiⅠ andKpnⅠ; 5: pINA1297-phyA; 6: pINA1297-phyAdigested withSfiⅠ; 7: pINA 1297-phyAdigested withSfiⅠandKpnⅠ; 8: PCR product of pINA1297-phyA.

图4 重组解脂耶氏酵母 po1h植酸酶phyA基因片段的PCR扩增Fig.4 PCR amplification ofphyAgene in recombinantYarrowia lipolyticapo1h. 1: λ-EcoT14 marker; 2−5: PCR products.
3.4 高活性重组菌株的筛选
酵母转化子点接到含有 0.5%植酸钙的 PPB平板上,由于重组解脂耶氏酵母表达的植酸酶能分解培养基中的植酸钙而形成水解圈,则挑取其中水解圈较大的酵母菌落,即可能为植酸酶活性较高的菌株 (图 5)。
3.5 植酸酶phyA基因的表达
分别收集培养重组酵母的YM培养液,离心取上清测其酶活,便筛选到了一株产酶活性较高的解脂耶氏酵母,其在培养第 6天的时候表达的植酸酶酶活达到最大为636.23 U/mL。经12% SDS-PAGE对表达产物进行鉴定,结果表明重组解脂耶氏酵母po1h分泌了约130 kDa的蛋白,其比理论的植酸酶分子量大,可能是由于植酸酶phyA基因潜在的糖基化位点所造成,所以又用脱糖基化酶endoglycosidase H处理重组解脂耶氏酵母的表达产物,形成了一条约51 kDa的蛋白带,与植酸酶phyA基因产物的理论值相符 (图 6)。

图5 重组解脂耶氏酵母生长在PPB平板上Fig.5 RecombinantYarrowia lipolyticagrows on PPB plate.

图6 SDS-PAGE分析重组解脂耶氏酵母po1h中植酸酶的表达Fig.6 SDS-PAGE analysis of the recombinant protein expressed in the recombinantYarrowia lipolyticapo1h. 1:protein marker; 2: thephyAphytse expressed by the recombinantYarrowia lipolyticapo1h; 3: the recombinant phytase protein was treated with Endo H.
3.6 表达产物的酶学性质
按照文献[12]的方法配置测反应体系的缓冲液(0.2 mol/L甘氨酸缓冲液 (pH 1.0、1.5、2.0、2.5、3.0);0.2 mol/L乙酸-乙酸钠缓冲液 (pH 3.5、4.0、4.5、5.0、5.5、6.0);0.2 mol/L Tris缓冲液 (pH 6.5、7.0、7.5、8.0)),研究pH对表达的植酸酶phyA酶活性的影响,以最高酶活性为 100%,其他条件下的酶活占最高酶活的百分数即为该酶在此 pH条件的相对酶活。实验结果表明重组解脂耶氏酵母po1h-phyA表达蛋白在pH 2.0~2.5酶活较高,然后下降,而 pH到 5.5时则有一个高点,其与黑曲霉NRRL3135中产生的植酸酶性质相似,此酶的最适反应pH值为5.5 (图7)。
用不同 pH的缓冲液在 37℃下处理粗酶液60 min,然后调回最适pH 5.5,在常规条件下测定酶活,考察该酶在37℃下的pH稳定性。以剩余最高酶活为 100%,其他条件下的酶活占最高酶活的百分数即为该酶在此 pH条件的相对酶活。从图 8可见,pH 2.0~8.0时,该酶可保持超过80%的酶活力,可见此酶在酸性、中性及弱碱性条件中都有较强的耐受性。

图7 重组植酸酶的最适pHFig.7 Optimal pH of the recombinant phytase activity.

图8 重组植酸酶pH耐受性Fig.8 pH tolerance of the recombinant phytase activity.
在不同酶反应温度下 (20℃、25℃、37℃、45℃、50℃、55℃、60℃、70℃) 测此酶的酶活力。从图9可见,重组植酸酶随着温度的增加,酶活一直呈上升趋势,约到55℃时酶活达到最高,当温度超过55℃后酶活开始下降,可见该酶活的最适反应温度为55℃。
将重组植酸酶分别在70℃、80℃和90℃下保温10 min后再在37℃、最适pH下测定酶活性,以不进行热处理的重组植酸酶的酶活性为 100%,其他条件下的酶活占最高酶活的百分数即为该酶在此pH条件下的相对酶活。从图10可以看出,重组植酸酶有好的耐热性,在90℃处理10 min后酶活保留在86.08%。
3.7 酶的胃蛋白酶和胰蛋白酶抗性
随着处理时间的延长,植酸酶活力逐渐下降。其用胃蛋白酶处理2 h后残留酶活为97.08%,用胰蛋白酶处理2 h后残留酶活为88.85%。该酶抵抗胃蛋白酶和胰蛋白酶的能力强。

图9 重组植酸酶最适温度Fig.9 Optimal temperature of the recombinant phytase activity.
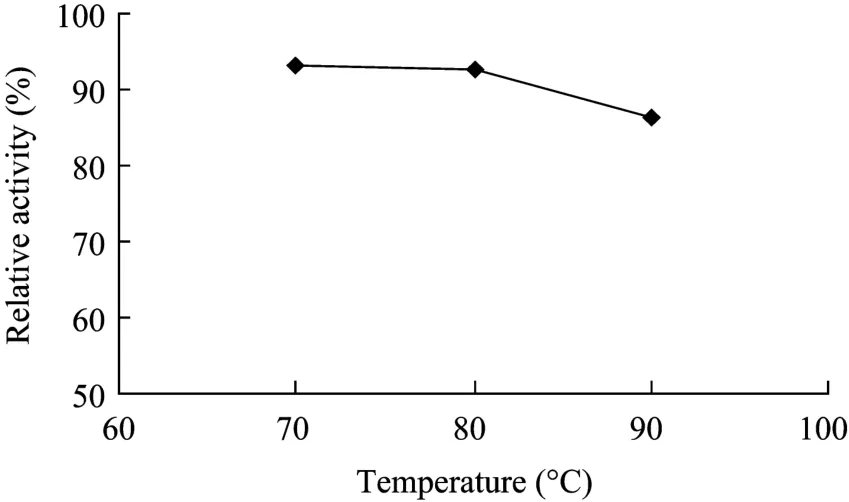
图10 重组植酸酶的热稳定性Fig.10 The thermo stabilities of the recombinant phytase activity.
4 讨论
到目前为止还未见到以解脂耶氏酵母 po1h作为黑曲霉NRRL3135植酸酶phyA的表达菌株报道。本实验将黑曲霉NRRL3135菌株植酸酶基因整合到解脂耶氏酵母po1h染色体上进行表达,并对产物进行鉴定,发现表达的植酸酶性质与理论值基本一致,但其耐热性有所提高,该酶经90℃处理10 min,残留酶活性为 37℃时的 86.08%。比野生型的黑曲霉NRRL 3135植酸酶phyA及在毕赤酵母X33、KM71和GS115中表达的重组黑曲霉NRRL3135的植酸酶提高很多,野生型的黑曲霉NRRL3135植酸酶phyA在68℃加热10 min后只剩余40%的活性,毕赤酵母 X33、KM71和 GS115中表达的重组黑曲霉NRRL3135的植酸酶在85℃加热10 min的条件下,也只有50%左右的活性保留[13-14]。其更高的热稳定性,使其在饲料制粒或膨化过程中引起的酶活损失少,基本能满足饲料加工、贮藏、使用的要求,也就不会因为热不稳定性而限制此植酸酶在饲料中的推广和应用。
另外由于动物的胃液环境大多为酸性,小肠为近中性,本研究的植酸酶在酸性及中性都保持了大部分的酶活力,且对胃蛋白酶和胰蛋白酶抗性较强,所以这种酶是比较适合作为饲料用酶。
REFERENCES
[1] Wang JH, Mu YL, Huang ZX. Purification and characterization of phytase (phytA) from genetic engineering Barm.J Yunnan Normal Univ Sci, 2003,23(1): 43−47.
王金华, 穆跃林, 黄遵锡. 基因工程菌产植酸酶 (phytA)的纯化及性质初步研究. 云南师范大学学报, 2003,23(1): 43−47.
[2] Chen Z, Fu J, Bei JL,et al. Purification and comparison of enzymatic properties of two recombinant fungal phytase.J SichuanUnivSci, 2007, 44(5): 1141−1146.
陈庄, 付捷, 贝锦龙, 等. 两种重组真菌植酸酶的纯化及其酶学性质比较. 四川大学学报, 2007, 44(5):1141−1146.
[3] Zhao HY, Huang Y, Yang JK,et al.Review ofYarrowia lipolyticaexpression system.ChinJ Biopro Eng, 2008,6(3): 10−16.
赵鹤云, 黄瑛, 杨江科, 等. 解脂耶氏酵母表达系统研究进展. 生物加工过程, 2008, 6(3): 10−16.
[4] Madzak C, Tréton B, Blanchin-Roland S. Strong hybrid promoters and integrative expression/secretion vectors for quasi-constitutive expression of heterologous proteins in the yeastYarrowia lipolytica.JMolMicrobiol Biotechnol,2000, 2(2): 207−216.
[5] Roth R, Moodley V, van Zyl P. Heterologous expression and optimized production of anAspergillus aculeatusEndo-1,4-b-mannanase inYarrowia lipolytica.Mol Biotechnol, 2009, 43: 112−120.
[6] Graham GC, Mayers P, Hen RT. A simplified method for the preparation of fungal genomic DNA for PCR and RAPD analysis.Biotechniques, 1994, 16(1): 48−50.
[7] van Hartingsveldt W, van Zeijl CM, Harteveld GM,et al.Cloning, characterization and overexpression of the phytase-encoding gene (phyA) ofAspergillus niger.Gene,1993, 127: 87−94.
[8] Le Dall MT, Nicaud JM, Gaillardin C. Multiple-copy integration in the yeastYarrowia lipolytica.Curr Genet,1994, 26: 38−44.
[9] Madzak C, Gaillardin C, Beckerich JM. Heterologous protein expression and secretion in the non-conventional yeastYarrowia lipolytica: a review.J Biotechnol, 2004,109: 63−81.
[10] Zou LK, Wang HN, Pan X. Expression, purification and characterization of aphyAm-phyCsfusion phytase.J ZhejiangUnivSciB, 2008, 9(7): 536−545.
[11] Rodriguez E, Porres JM, Han Y,et al. Different sensitivity of recombinantAspergillus nigerphytase (r-phyA) andEscherichia colipH 2.5 acid phosphatase (r-AppA) to trypsin and pepsinin vitro.ArchBiochemBiophy, 1999,365(2): 262−267.
[12] Wyss M, Brugger R, Kronenberger A,et al. Biochemical characterization of fungal phytases (myo-inositol hexakisphosphate phosphor-hydrolases): catalytic properties.Appl Environ Microbiol, 1999, 65: 367−373.
[13] Han YM, Lei XG. Role of glycosylation in the functional expression of anAspergillus nigerphytase(phyA) inPichia pastoris.Arch Biochem Biophy, 1999, 364(1):83−90.
[14] Kang W, Wang Z, Zhan DL,et al.Overexpression of phytase (phyA) gene fromAspergillus nigerNRRL3135 inPichia pastorisGS115.J Jilin Agric Univ, 2006, 28(6):623−627.
康维, 王智, 詹冬玲, 等. 黑曲霉 NRRL3135菌株植酸酶基因在毕赤酵母 GS115系统中的表达.吉林农业大学学报, 2006, 28(6): 623−627.
Expression of phytase genephyAinYarrowia lipolyticapo1h
Yun Chen1, You Zou2, Yiding Wang1, and Lixin Ma2
1College of Life Science,Sichuan Normal University,Chengdu610101,China
2College of Life Science,Hubei University,Wuhan430062,China
Received:December 10, 2009;Accepted:March 24, 2010
Corresponding author:Lixin Ma. Tel: +86-27-88661237; Fax: +86-27-88666349; E-mail: lixin_ma@hotmail.com

