传染性法氏囊病病毒AH1株vp2基因在昆虫细胞中的表达与应用
欧阳伟,王永山,周宇,张海彬,唐雨德
1 江苏省农业科学院兽医研究所 农业部动物疫病诊断与免疫重点开放实验室 国家兽用生物制品工程技术研究中心,南京 210014
2 南京农业大学动物医学院,南京 210095
3 南京军区军事医学研究所,南京 210002
动物及兽医生物技术
传染性法氏囊病病毒AH1株vp2基因在昆虫细胞中的表达与应用
欧阳伟1,2,王永山1,周宇1,2,张海彬2,唐雨德3
1 江苏省农业科学院兽医研究所 农业部动物疫病诊断与免疫重点开放实验室 国家兽用生物制品工程技术研究中心,南京 210014
2 南京农业大学动物医学院,南京 210095
3 南京军区军事医学研究所,南京 210002
将近期引起传染性法氏囊病 (IBD) 免疫预防失败的传染性法氏囊病病毒 (IBDV)vp2基因,定向克隆入杆状病毒表达系统的供体质粒pFastBacHTA中,构建重组供体质粒pFastBacHTA-VP2,转化Escherichia coliDH10Bac感受态,筛选重组杆状病毒表达质粒pBac-VP2。用pBac-VP2转染Sf9昆虫细胞,获得重组杆状病毒vBac-VP2。对重组杆状病毒vBac-VP2感染的Sf9细胞,用间接免疫荧光试验 (IFA) 检测,具有特异性荧光;用IBDV抗体夹心ELISA检测,呈阳性反应,抗原效价达到1.6×103;用Western blotting分析,在53 kDa处出现一条特异蛋白条带;电镜观察,重组Vp2蛋白能够自组装成病毒样颗粒,在感染细胞中发现了“包涵体样”结构。用HisTrap HP亲和层析柱纯化的重组Vp2蛋白作为包被抗原,建立的IBDV抗体间接ELISA检测方法具有良好的特异性。用重组杆状病毒感染的Sf9昆虫细胞裂解物,免疫2周龄SPF鸡,一次免疫14 d后,ELISA检测抗体效价为8×102,中和抗体效价为1106,攻毒实验的存活率为30%;二次免疫14 d后,ELISA抗体效价为3.2×103,中和抗体效价为2536,存活率为100%。在实验观察7 d内,重组Vp2蛋白免疫保护鸡未显任何临床症状和病理变化,法氏囊/体重比高于对照组 (P<0.05)。本实验制备的病毒样颗粒重组Vp2蛋白在研制新型IBD基因工程疫苗和检测试剂方面显示出了应用前景。
传染性法氏囊病病毒,vp2基因,病毒样颗粒,包涵体样结构,间接ELISA,免疫实验
Abstract:Protective immune response of the available IBD vaccine is insufficient to fully protect against the prevailing strain of the infectious bursal disease virus (IBDV). Such a vaccination escape IBDV field isolate idenfied from Anhui province of China inDecember 2007, where IBD broke out at 2 weeks post vaccination. The IBDVvp2gene was cloned into pFastBacHTA donor plasmid, followed by generation of the recombinant bacmid DNA pBac-VP2. The latter was used to transfect insect cell Sf9 with Lipofectamine to produce recombinant baculovirus vBac-VP2. The Sf9 cells infected with vBac-VP2 were stained positive against IBDV antibody using the indirect immunofluorescence assay (IFA), which was also confirmed by the detection of IBDV Vp2 protein in the infected Sf9 cells by IBDV sandwich ELISA. Western blotting revealed that the calculated protein of approximately 53 kDa was in the expressed in the insect cells. Moreover, virus-like particles (VLPs) and “inclusion body-like”structure in the infected Sf9 cells were observed under electron microscopy. We further developed an indirect ELISA for the detection of the IBDV antibodies,which was specific and sensitive. In addition, the lysates of vBac-VP2 infected cells was used to immunize 2-week-old SPF chickens,followed by challenging with the virulent IBDV, the survival rate was 30% at 14 days post primary immunization, however, the survival rate was 100% at 14 d after the booster vaccination. The ELISA antibody titers was up to 3.2×103and neutralization antibody titer was 2536, significantly higher than those of one-shot vaccination, 8×102and 1106, respectively. The immunized chickens did not show any clinical signs and histopathological changes of infection in 7-days trial time. The bursa/body-weight ratios were higher than those of the unimmunized control (P< 0.05). The virus-like-particle recombinant Vp2 protein expressed in insect cells promises to be a novel subunit vaccine and diagnostic reagent candidate for IBDV.
Keywords:infectious bursal disease virus,vp2gene, virus-like particles (VLPs), inclusion body-like structure, indirect ELISA,protection test
传染性法氏囊病 (Infectious bursal disease,IBD) 是引起我国及世界养禽业经济损失严重的主要传染病之一。接种疫苗是预防该病最有效的方法,在上世纪80年代的中后期,在世界范围内爆发了在抗原性和致病性等方面与经典毒株有很大差异的IBDV变异毒株,使养鸡业遭受重创[1-5]。变异株和超强毒株 (vvIBDV) 的出现使该病的防控难度加大,IBD免疫预防失败已成为禽病防控中的重要问题[4,6-8]。目前,使用的常规弱毒疫苗和灭活疫苗,其安全性和制造工艺仍存在不足:为预防变异毒株而采用中强毒力活疫苗存在着较大的生物安全问题,因为在不同 IBDV毒株之间潜在着基因重配的可能,给该病的防控带来隐患;灭活疫苗存在着抗原制备的困难;因此,在当前IBD防控实际工作中,亟需免疫效力强、生物安全性高、并且针对当前流行毒株的新型 IBD基因工程疫苗的问世。IBDV属双RNA 病毒科双RNA病毒属,基因组包括大 (A)小 (B) 2个片段,有5种病毒蛋白:Vp1、Vp2、Vp3、Vp4和Vp5。Vp2占病毒蛋白的51%,既是IBDV的主要结构蛋白,又是病毒的主要保护性抗原,与病毒中和抗体的诱导、抗原和毒力的变异以及细胞凋亡的诱导等有关[1-2,9-10]。Vp2的高变区是病毒中和性单抗的结合必需区,该区的点突变是 IBDV抗原漂移、毒力变异进而造成经典疫苗株免疫失败的主要原因。迄今,IBD基因工程疫苗研究均以vp2为靶基因,采用的表达系统包括:大肠杆菌[11]、酵母[12]、鸡痘病毒载体[13]、杆状病毒表达载体[14]、核酸疫苗[15]以及近期报道的多表位疫苗[16]等。目前IBD基因工程疫苗研究中的主要问题:或者是重组IBDV蛋白的表达量不够高,或者是重组IBDV蛋白复性难度大,或者是源于一种毒株的重组蛋白不适用于其他变异毒株。因此,在vp2基因选择、表达系统以及表达策略方面进一步探索新的技术路线是十分必要的。近期,笔者对安徽省在2007年12月发生的两起免疫失败的IBDV野外毒株的vp2基因的分子特征进行了分析,其vp2基因与当时预防使用的疫苗毒株 (B87株) 的vp2基因序列有较大差异[17],再次佐证了IBDV变异株的危害。鉴于此,本实验针对 IBD基因工程疫苗研究中的主要问题,选用该vp2基因,运用杆状病毒表达系统将其在昆虫细胞中表达,制备病毒样颗粒重组 Vp2蛋白,研制新型高效IBD病毒样颗粒基因工程疫苗和检测试剂。
1 材料与方法
1.1 质粒、菌种与细胞
含有vp2基因的克隆质粒pUC-VP2 (AH1) 系本实验室用RT-PCR方法从2007年12月在安徽境内发生的IBD免疫预防失败的病鸡法氏囊组织中扩增的vp2基因构建[17]。含有 6×His标签的供体质粒pFastBacHTA、含有Bacmid和Helper plasmid的E.coliDH10Bac、Sf9昆虫细胞、E. coliTOP10均购自Invitrogen公司。IBDV 疫苗毒株B87鸡胚成纤维细胞 (CEF) 适应毒和9~10日龄SPF鸡胚均由南京天邦生物科技有限公司提供。
1.2 主要试剂
鸡抗IBDV高免血清系用IBD弱毒疫苗 (B87)多次免疫SPF鸡获得,用DEAE纤维素 (DE32) 纯化;兔抗鸡IgG抗体和HRP标记的兔抗鸡IgG抗体由本实验室制备。MiniBEST质粒纯化试剂盒、DNA凝胶回收试剂盒、X-gal、IPTG均购自TaKaRa公司;BAC/PAC DNA Isolation Kit购自 Omega公司;Lipofectamine2000转染试剂购自 Invitrogen公司;胎牛血清、Grace’s昆虫细胞培养基购自Gibco公司。FITC标记的羊抗兔IgG抗体、DAB显色液购自武汉博士德生物工程有限公司。
1.3 引物的设计与合成
根据vp2基因序列和供体质粒pFastBacHTA表达阅读框设计vp2基因扩增引物:
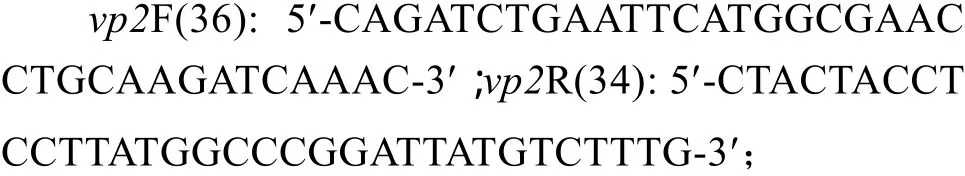
重组杆状病毒表达质粒鉴定引物:

以上引物由Invitrogen公司合成。
1.4Vp2基因重组供体质粒的构建
将克隆质粒 pUC-VP2 (AH1) 和供体质粒pFastBacHTA分别用EcoRⅠ和Hind Ⅲ双酶切,经1%琼脂糖凝胶电泳,分别回收vp2和载体DNA片段,DNA胶回收试剂盒纯化,T4 DNA 连接酶连接,转化E. coliTOP10感受态细菌,涂布在用LB配制的1.5%琼脂平皿上 (含氨苄青霉素100 mg/L),37℃培养 14 h。挑单菌落接种入 LB (含氨苄青霉素100 mg/L),振摇培养12 h,用MiniBEST 质粒纯化试剂盒提取质粒,EcoRⅠ和Hind Ⅲ双酶切鉴定,获得含vp2基因的重组供体质粒pFastBacHTA-VP2。
1.5Vp2基因重组杆状病毒表达质粒的构建
用重组供体质粒pFastBacHTA-VP2转化E. coliDH10Bac感受态细胞 (含 Bacmid DNA和 Helper plasmid),在LB培养基中37℃,220 r/min,4 h,用LB 做一系列稀释 (10−1、10−2、10−3),涂布于 LB 配制的1.5%琼脂平皿上 (含有50 mg/L卡那霉素、7 mg/L庆大霉素、10 mg/L四环素以及 100 mg/L X-gal和40 mg/L IPTG),37℃培养16 h,挑白色单菌落,接种于含有3种抗生素 (50 mg/L卡那霉素、7 mg/L庆大霉素、10 mg/L四环素) 的LB中,37℃振摇培养16 h,用BAC/PAC DNA Isolation Kit提取重组Bacmid DNA,用vp2基因正向引物vp2F(36) 和M13/pUC通用下游引物 PCR鉴定重组 Bacmid DNA,获得含vp2基因的重组杆状病毒表达质粒pBac-VP2。
1.6Vp2基因重组杆状病毒的获得
在转染前1天,用对数生长期的Sf9昆虫细胞在 6孔细胞培养板中制备单层细胞。转染时,弃去旧培养基,并用无血清无抗生素的Grace’s液洗涤细胞,然后用孵育好的 pBac-VP2-Lipofectamine2000混合物平铺Sf9细胞单层,27℃培养5 h,弃去pBac-VP2-Lipofectamine2000混合物,每孔加入含10%血清及抗生素的 Grace’s完全培养液,置 27℃继续培养;实验同步设立用未插入外源基因片段的Bacmid质粒和单用转染试剂转染 Sf9细胞为对照;每日观察,直到细胞病变达90%时,收集细胞及上清液,在Sf9昆虫细胞上继续传代2次,获得第3代重组杆状病毒 (P3代),进行鉴定。
1.7Vp2基因重组杆状病毒的鉴定
1.7.1IFA检测
实验在24孔细胞培养板中进行。将重组杆状病毒 (P3代) 接种到Sf9细胞,培养72 h后,吸弃细胞培养液,用无血清的培养液洗 2次,然后向细胞培养孔中加入−20℃预冷的无水乙醇1 mL/孔,4℃固定30 min,用PBS洗3次,拍干;加入40倍稀释的鸡抗IBDV高免血清,200 µL/孔,37℃孵育2 h,PBS洗涤5次,拍干;加入100倍稀释的兔抗鸡IgG抗体,200 µL/孔,37℃孵育1 h,PBS洗涤5次,拍干;加入50倍稀释的FITC标记的羊抗兔IgG抗体工作液,200 µL/孔,37℃孵育 1 h,PBS洗涤 5次,置于荧光显微镜下观察。同步设立无vp2基因的杆状病毒 (Baculovirus) 感染 Sf9细胞和正常细胞为对照。
1.7.2夹心ELISA检测
用包被液稀释鸡抗IBDV IgG至5 mg/L,然后包被酶标板,100 µL/孔,4℃过夜,PBST洗涤3次,每次5 min,拍干;用封闭液 (含10% FBS的PBST)满孔封闭,37℃,2 h,PBST洗涤3次,每次5 min,拍干;加入超声破碎好的P4代细胞,100 µL/孔,37℃,2 h,PBST洗涤3次,每次5 min,拍干;加入1∶1 000稀释的 HRP标记的鸡抗 IBDV IgG,100 µL/孔,37℃,1 h,PBST洗涤3次,每次5 min,拍干;显色。实验同步设立阴性和空白对照。
1.7.3Western blotting分析
将P3代vBac-VP2感染的Sf9细胞、Bacmid转染产生的野生杆状病毒感染的Sf9细胞和正常的Sf9细胞用0.01 mol/L PBS (pH 7.2) 离心洗涤2次后,按原体积1%加入PBS重悬,3次冻融后,加入5×SDSLoading Buffer,按常规方法进行12%分离胶和5%浓缩胶的SDS-PAGE电泳分析,转印到硝酸纤维素膜上,转印完毕后,将硝酸纤维素膜用 5%脱脂奶粉 4℃封闭过夜,然后用一抗 (鸡的 IBDV高免血清)、二抗 (HRP标记的兔抗鸡IgG抗体) 分别与之作用,DAB底物显色,观察特异蛋白条带。
1.7.4电镜观察
用P3代vBac-VP2感染Sf9昆虫细胞,待细胞完全病变之后,收集细胞,冻融3次,3 000 r/min离心30 min,取上清使用电镜负染技术制片观察。用同样方法收集病变细胞,不冻融,3 000 r/min离心30 min沉淀细胞,2%戊二醛固定液固定,超薄切片,电镜观察,同时设立正常Sf9昆虫细胞作空白对照。
1.8 重组Vp2蛋白的纯化
取300 mL vBac-VP2感染的细胞培养物,离心收集细胞,用12 mL结合缓冲液重悬,并加入20 µL 100 mmol/L PMSF,冰浴条件下超声破碎至细胞悬液清亮,4℃、10 000 r/min离心30 min去除细胞碎片,取上清用0.45 µm孔径滤膜过滤,然后按照HisTrap HP说明书纯化重组Vp2蛋白。
1.9 重组Vp2蛋白的应用
1.9.1IBDV抗体间接ELISA检测方法的建立
用pH 9.6的碳酸盐缓冲液将纯化的重组Vp2蛋白稀释至5 mg/L,包被ELISA板,100 µL/孔,4℃过夜;用PBST洗涤3次,每次2 min,拍干;每孔加入封闭液 (含 10% FBS 的 PBST) 300 µL,37℃,2 h;用PBST洗涤3次,每次2 min,拍干;加入待检血清样品,37℃,1 h;用PBST洗涤3次,每次2 min,拍干;加入HRP-标记的兔抗鸡IgG (1∶2 000)100 µL,37℃,1 h;用 PBST洗涤 3次,每次 2 min,拍干;加入显色剂A液 (四甲基联苯胺溶液)、B液(过氧化氢脲溶液) 液各 1滴,暗盒显色;2 mol/L H2SO4终止,测A450值,判定结果。
1.9.2重组Vp2蛋白的免疫攻毒试验
将100只2周龄SPF鸡 (购自南京天邦生物科技有限公司) 随机分成 3组,隔离饲养:重组 Vp2蛋白加免疫佐剂组 60只,将重组杆状病毒感染的Sf9昆虫细胞培养物 (ELISA效价为1 600) 与等体积的免疫佐剂 (法国 SEPPIC公司 Montainde ISA 206 VG) 混合乳化,经胸部肌肉注射,0.4 mL/只/次,第1次免疫14 d后进行第2次免疫;单用免疫佐剂组20只,免疫程序与前者相同,只注射免疫佐剂,0.4 mL/只/次;空白对照组20只,不注射,只是与其他 2个实验组在同样条件下饲养。全部的实验鸡均在免疫实验时经翅静脉采血,并在免疫后每间隔7 d采血1次,分别测定抗体效价。
将采集的实验鸡血清从1∶100开始进行2倍比连续稀释,用IBDV抗体间接ELISA检测方法 (见1.9.1) 测定抗体效价。
将实验鸡血清从1∶100开始进行10倍比连续稀释,各取100 µL,分别与等体积的IBDV B87细胞适应毒稀释物 (病毒含量200 TCID50/0.1 mL) 混合,置37℃反应1 h,接种于含有CEF单层的96孔培养板中,100 µL/孔 (病毒含量 100 TCID50/孔),每份待检血清设4个重复;同时设立病毒对照、阳性血清对照、阴性血清对照、细胞对照。置37℃、5%CO2培养,每天观察病变,记录结果,按Reed-Muench法计算出每个血清样品的病毒中和抗体效价,计算几何均数 (GMT),为该血清的病毒中和抗体效价。
第1次免疫14 d后,从3个实验组中各取半数鸡 (重组Vp2蛋白加免疫佐剂组30只、单用免疫佐剂组10只、空白对照组10只),同时采用点眼、滴鼻、擦肛3种途径人工感染IBDV强毒[16],0.2 mL/只(病毒含量100 LD50),攻毒后每日观察试验鸡的生长和发病情况,连续观察7 d,记录死亡数,及时解剖检查病死鸡法氏囊组织病变并取少许置于10%中性甲醛溶液中固定,石蜡包埋,切片,HE染色,观察组织学变化。第7天捕杀存活鸡,称体重,检查法氏囊病理变化并称重;按以下公式分别计算各组试验鸡的法氏囊/体重比 (BB比值),并进行统计学分析 (F检验)。对3个实验组的另半数鸡进行第2次免疫,14 d后同法攻毒。
法氏囊/体重比(BB比值) = 法氏囊重(g) ×1 000/试验鸡体重(g)
2 结果与分析
2.1Vp2基因重组供体质粒的鉴定
将构建的供体质粒 pFastBacHTA-VP2用EcoRⅠ和Hind Ⅲ双酶切鉴定,1%琼脂糖凝胶电泳可见两条带,分别约为1.4 kb与5.0 kb,与预期大小相符 (图1)。
2.2Vp2基因重组杆状病毒表达质粒的鉴定
用重组供体质粒pFastBacHTA-VP2转化E. coliDH10Bac感受态细胞,蓝白斑与三抗筛选,挑白色菌落克隆,用BAC/PAC DNA Isolation Kit提取重组Bacmind DNA,重组Bacmid DNA经PCR鉴定 (引物为vp2基因正向引物vp2F(36) 和M13/pUC通用下游引物),1%琼脂糖凝胶电泳可见一条大小约为2 100 bp的条带,与理论值2 092 bp相符,说明vp2基因已成功转座入Bacmid DNA中 (图2)。
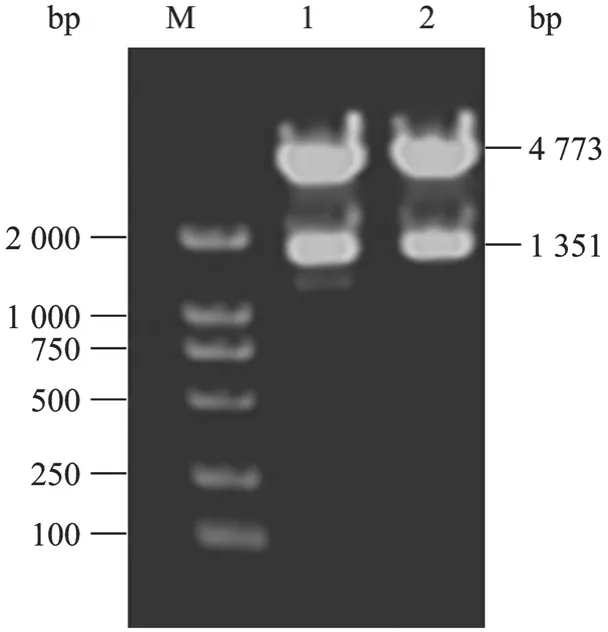
图1 pFastBacHTA-VP2的酶切图谱Fig.1 Digestion map of pFastBacHTA-VP2. M: DNA marker;1, 2: pFastBacHTA-VP2 digested byEcoRⅠ andHind Ⅲ.

图2 pBac-VP2的PCR分析图谱Fig.2 PCR analysis of pBac-VP2. M: DNA marker; 1, 2:plasmid pBac-VP2.
2.3Vp2基因重组杆状病毒的获得
将鉴定好的pBac-VP2按Lipofectamine2000使用说明书转染Sf9细胞,每天观察病变,5 d后,转染孔可见部分细胞变圆变大,第 6天细胞病变达90%以上,收集病变细胞及上清,1 500 r/min离心10 min,上清液即为含vp2基因的重组杆状病毒vBac-VP2原液 (P1代),继续传代2次,获得高效价的重组杆状病毒vBac-VP2 (P3代)。
2.4Vp2基因重组杆状病毒的鉴定
2.4.1IFA检测
在荧光显微镜下,可以看见感染P3代vBac-VP2病毒的 Sf9昆虫细胞呈现较强的荧光,而感染野生型杆状病毒的细胞与正常的细胞则无荧光 (图 3)。表明vp2基因在昆虫细胞中表达。
2.4.2夹心ELISA检测
用夹心ELISA检测P4代vBac-VP2病毒细胞超声裂解物,加入P4代样品的孔,显示阳性,抗原效价达到 1.6×103,表明vp2基因在昆虫细胞中得到了高效表达。正常昆虫细胞和PBST对照孔则均为阴性。
2.4.3Western blotting分析
对 P3代 vBac-VP2病毒细胞培养物进行 SDSPAGE,用Western blotting分析,在53 kDa附近可见一条特异蛋白带,表明重组 Vp2蛋白具有 IBDV抗原反应性 (图4)。
2.4.4电镜观察
用电镜负染技术观察,在P3代vBac-VP2病毒感染的昆虫细胞中可发现病毒样颗粒,直径约60 nm(图 5A);用 vBac-VP2病毒感染的病变细胞制备超薄切片,可发现由病毒样颗粒在细胞中形成的“包涵体样”结构 (图5B)。

图3 感染vBac-VP2的Sf9昆虫细胞IFA检测结果 (100×)Fig.3 Detection of Sf9 cells infected with vBac-VP2 by IFA (100×). (A) Normal Sf9 cells. (B) Sf9 cells infected with Baculovirus.(C) Sf9 cells infected with vBac-VP2.

图4 感染vBac-VP2的Sf9细胞SDS-PAGE和Western blotting分析结果Fig.4 Analysis of vBac-VP2 infected Sf9 cells by SDS-PAGE and Western blotting. M: protein marker; 1: normal Sf9 cells (in SDS-PAGE); 2: Sf9 cells infected with vBac-VP2(in SDS-PAGE); 3: Sf9 cells infected with vBac-VP2 after ultrasonication (in SDS-PAGE); 4: purified Vp2 protein expressed in Sf9 cells(in SDS-PAGE); 5: normal Sf9 cells(in Western blotting); 6: Sf9 cells infected with vBac-VP2(in Western blotting).

图5 感染vBac-VP2的Sf9细胞电镜检查结果Fig.5 Observation of Sf9 cells infected with vBac-VP2 by electron microscopy. (A) Virus-like particles (VLPs) were observed in the Sf9 cells infected with vBac-VP2 by negative staining of electron microscopy. (B) “Inclusion body-like”structure were observed in the Sf9 cells infected with vBac-VP2 by ultra-section of electron microscopy.
2.5 重组Vp2蛋白的纯化
Sf9细胞表达的Vp2蛋白经HisTrap HP亲和层析柱纯化后,进行 SDS-PAGE,用凝胶图像分析软件BandScan5.0分析,重组Vp2蛋白的纯度达80%(图 4)。
2.6 重组Vp2蛋白的应用
2.6.1IBDV抗体间接ELISA检测方法的建立
用纯化的重组 Vp2蛋白做包被抗原建立的IBDV抗体间接ELISA检测,IBD疫苗 (B87株) 免疫 20 d后的鸡血清 (阳性血清) 检测孔A450值≥0.90,而 SPF鸡血清、牛血清以及 PBST对照孔的A450值均为0.00,表明该ELISA抗体检测方法具有良好的特异性 (表1)。
2.6.2重组Vp2蛋白的免疫攻毒试验
重组 Vp2蛋白加免疫佐剂组,随着免疫时间和免疫次数的增加,免疫鸡血清中IBDV的ELISA抗体与病毒中和抗体不断上升 (图 6)。第 1次免疫14 d后,重组Vp2蛋白加免疫佐剂组的ELISA抗体效价为800,病毒中和抗体效价为1 106,此时用IBDV强毒攻击,在攻毒后的第2天开始有死亡,第3天死亡较多,至第7天攻毒鸡的存活率为30%(9/30);而单用免疫佐剂组与空白对照组 ELISA抗体效价和中和效价均小于100,用IBDV强毒攻击,在攻毒后的第4天全部死亡。解剖检查死亡鸡的法氏囊肿大、出血、表面有胶冻样分泌物 (图 7);病理组织学检查可见法氏囊淋巴滤泡呈不同程度的萎缩、坏死,滤泡内细胞数量明显减少,细胞破碎相多见,滤泡间质增宽,有较明显的间质水肿 (图8A)。同期正常饲养的对照鸡生长正常,法氏囊组织也未见病理变化 (图8 B)。第7天捕杀存活鸡,各试验组的法氏囊/体重比 (BB值) 平均值分别为:重组Vp2免疫组3.68、单用免疫佐剂组2.51、空白对照组2.35。经F检验,重组Vp2免疫组与两个对照组间均有显著差异 (P<0.05),而两个对照组之间差异不显著 (P>0.05)。

表1 IBDV抗体间接ELISA检测结果Table 1 Detection of anti-IBDV antibodies by indirect ELISA

图6 重组Vp2蛋白免疫鸡IBDV抗体动态Fig.6 Pattern of IBDV-antibody in chickens immunized with recombinant Vp2.

图7 攻毒死亡鸡法氏囊解剖检查结果Fig.7 Bursa of dead chickens challenged with vIBDV.

图8 实验鸡法氏囊病理组织学检查结果 (HE,200×)Fig.8 Tissue slices of bursas (HE, 200×). (A) Dead chicken.(B) Normal control.
第2次免疫14 d后 (从第1次免疫起28 d),重组Vp2蛋白加免疫佐剂组ELISA抗体效价上升到3 200,病毒中和抗体效价为2 536,此时用IBDV强毒攻击,存活率为100% (30/30);单用免疫佐剂组与空白对照组ELISA抗体和中和抗体效价始终小于100,攻毒鸡全部死亡。死亡鸡的法氏囊均呈现以上病理变化。重组Vp2免疫组的法氏囊/体重比 (4.25) 与单用免疫佐剂组 (2.24) 和空白对照组 (2.29) 均差异显著(P<0.05),而单用免疫佐剂组和空白对照组之间差异不显著 (P>0.05) (表2)。表明重组病毒样颗粒Vp2蛋白免疫鸡可以抵抗IBDV强毒攻击。
3 讨论
长期以来,对IBD采取了以疫苗免疫接种为主的综合性防控措施,该病的大规模流行或爆发已得到了有效控制,但难以消除,其主要原因是 IBDV具有抵抗力强、抗原与毒力容易变异以及非鸡禽鸟类可成为病毒携带者或贮存宿主等特点,使该病极易呈地方性流行,已成为禽病防控中的重要问题,由此造成的经济损失巨大、无法准确统计[17-20]。
病毒样颗粒疫苗作为预防性疫苗具有以下几个方面的优势:不含病毒DNA,无感染性[21];免疫原性强,可刺激机体产生特异性体液免疫和细胞免疫;稳定性好,不易失活。颗粒疫苗作为一种新型的疫苗,不仅克服了传统的弱毒疫苗和灭活疫苗的不足,也弥补了基因疫苗的不足,在许多传染病的防控上显示出了良好应用前景。Antonis等[22]用在昆虫细胞中表达的猪细小病毒vp2基因产物制备的病毒样颗粒疫苗,在免疫佐剂的作用下,能在猪体内产生高滴度的血清抗体。
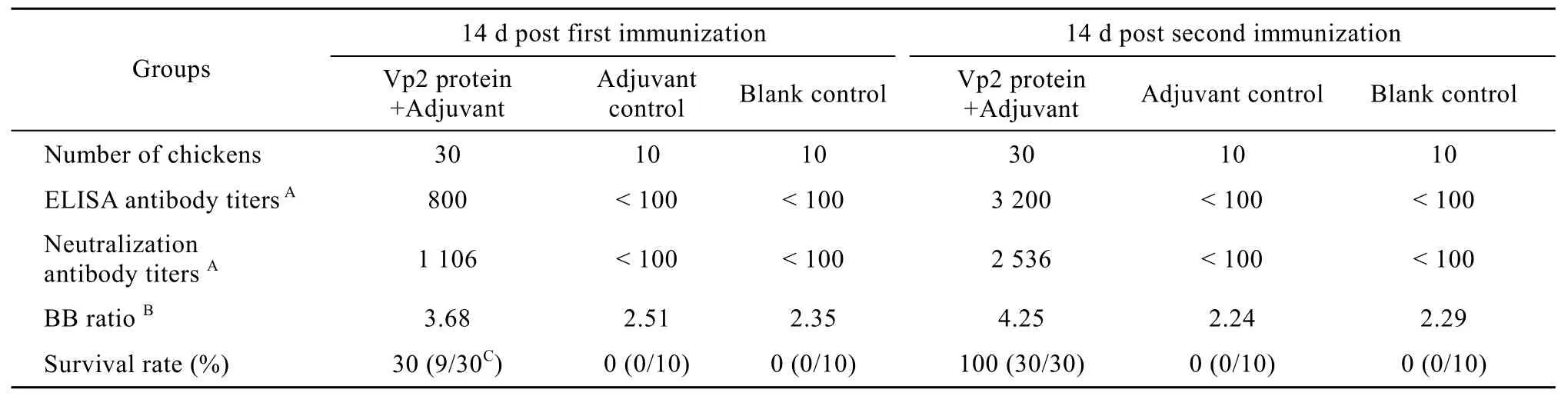
表2 重组Vp2蛋白的免疫攻毒试验Table 2 The protection test of chickens immunized with recombinant Vp2
本研究针对目前IBD基因工程疫苗研究中存在的主要问题,在目的基因选择上,采用近期引起免疫失败并具有完全的IBDV强毒分子特征的vp2基因,在表达系统上,利用杆状病毒表达系统具有与高等细胞类似的翻译后修饰系统,可使外源基因表达产物具有天然的活性形式、表达产物可自组装成病毒样颗粒 (VLPs)、以及表达量高等优点,将IBDV近期流行毒株的vp2基因在昆虫细胞中进行了表达。检测证明,重组Vp2蛋白能够自组装成病毒样颗粒,在感染细胞中形成“包涵体样”结构,细胞培养物的ELISA效价达到1.6×103,得到了高效表达。
为了评估该病毒样颗粒重组Vp2蛋白的应用前景,用重组Vp2蛋白作为IBDV抗体检测抗原,建立了IBDV抗体间接ELISA检测方法,检测结果表明,该方法具有良好的特异性。由于鸡体内不可能存在抗昆虫细胞抗体,因此使用在昆虫细胞中表达的病毒样颗粒重组Vp2蛋白作为IBDV抗体检测抗原研制IBD抗体检测试剂盒可以有效地保证检测方法的特异性。已有的研究表明,免疫效果和生产成本是影响兽用基因工程疫苗推广应用的主要因素,鉴于此,本实验简化疫苗制备工艺,用重组杆状病毒感染的Sf9昆虫细胞裂解物免疫SPF鸡,可诱导机体产生高效价的抗IBDV的ELISA抗体与中和抗体,抵抗 IBDV强毒攻击,免疫保护鸡未显任何临床症状和病理变化,法氏囊/体重比高于对照组,具有成为新型IBD病毒样颗粒基因工程疫苗的潜力。由于目前缺乏IBDV病毒样颗粒重组Vp2蛋白免疫攻毒试验参考资料,本试验的免疫剂量和免疫途径、IBDV攻毒时机和剂量都是根据作者自己的工作经验初步确定的,因此,在免疫攻毒试验结果中,两次免疫比一次免疫注射的保护率高,这表明对IBDV病毒样颗粒重组Vp2蛋白的免疫剂量和免疫佐剂进行优化是必不可少的,该项工作正在进行中。以上结果表明,本实验制备的病毒样颗粒重组Vp2蛋白在研制新型IBD基因工程疫苗和检测试剂方面显示出了应用前景。
REFERENCES
[1] Calnek BW. Gao F, Su JL, translation. Diseases of Poultry.10th ed. Beijing: China Agriculture Press, 1999: 914−937.
卡尔尼克 BW 主编. 高福, 苏敬良, 主译. 禽病学. 10版. 北京: 中国农业出版社, 1999: 914−937.
[2] Muller H, Islam MR, Raue R. Research on infectious bursal disease—the past, the present and the future.Vet Microbiol, 2003, 97(1/2): 153−165.
[3] Cao YC, Yeung WS, Law M,et al.Molecular characterization of seven Chinese isolates of infectious bursal disease virus: classical, very virulent and variant strains.Avian Dis, 1998, 42(2): 340–351.
[4] Brown MD, Green P, Skinner MA.Vp2sequences of recent European “very virulent” isolates of infectious bursal disease virus are closely related to each other but are distinct from those of “classical” strains.J Gen Virol,1994, 75(Pt3): 675−680.
[5] Yamaguchi T, Ogawa M, Miyoshi M,et al. Sequence andphylogenetic analyses of highly virulent infectious bursal disease virus.Arch Virol, 1997, 142(7): 1441−1458.
[6] Mardassi H, Khabouchi N, Ghram A,et al.A very virulent genotype of infectious bursal disease virus predominantly associated with recurrent infectious bursal disease outbreaks in Tunisian vaccinated flocks.Avian Dis, 2004,48(4): 829−840.
[7] Yamaguchi T, Kasanga CJ, Terasaki K,et al.Nucleotide sequence analysis of Vp2 hypervariable domain of infectious bursal disease virus detected in Japan from 1993 to 2004.J Vet Med Sci, 2007, 69(7): 733−738.
[8] Dolz R, Majo N, Ordonez G,et al.Viral genotyping of infectious bursal disease virus isolated from the 2002 acute outbreak in Spain and comparison with previous isolates.Avian Dis, 2005, 49(3): 332−339.
[9] Qi XL, Wang XM, Gao YL,et al.Progress in research about Vp2 protein of infectious bursal disease virus.Chin J Pre Vet Med,2008, 30(8): 656−660.
祁小乐, 王笑梅, 高玉龙, 等. 鸡传染性法氏囊病病毒Vp2蛋白研究进展. 中国预防兽医学报, 2008, 30(8):656−660.
[10] Liu HM, Qin AJ, Xu XQ,et al.Construction ofvp2eukaryotic expression vector of infectious bursal disease virus and its application.Chin J Pre Vet Med, 2006, 28(4):461−465.
刘红梅, 秦爱建, 许小琴, 等. 传染性法氏囊病病毒 JS株vp2基因真核表达载体的构建及其应用. 中国预防兽医学报, 2006, 28(4): 461−465.
[11] Azad AA, Fahey KJ, Barrett SA,et al.Expression inEscherichia coliof cDNA fragments encoding the gene for the host-protective antigen of infectious bursal disease virus.Virology, 1986, 149(2): 190−198.
[12] Macreadie IG, Vaughan PR, Chapman AJ,et al.Passive protection against infectious bursal disease virus by viral Vp2 expressed in yeast.Vaccine, 1990, 8(6): 549−552.
[13] Shaw I, Davison TF. Protection from IBDV-induced bursal damage by a recombinant fowlpox vaccine, fpIBD1, is dependent on the titre of challenge virus and chicken genotype.Vaccine, 2000, 18(28): 3230−3241.
[14] Snyder DB, Vakharia VN, Mengel-Whereat SA,et al.Active cross-protection induced by a recombinant baculovirus expressing chimeric infectious bursal disease virus structural proteins.Avian Dis, 1994, 38(4): 701−707.
[15] Fodor I, Horvath E, Fodor N,et al.Induction of protective immunity in chickens immunised with plasmid DNA encoding infectious bursal disease virus antigens.Acta Vet Hung, 1999, 47(4): 481−492.
[16] Wang YS, Fan HJ, Li Y,et al.Development of a multi-mimotope peptide as a vaccine immunogen for infectious bursal disease virus.Vaccine, 2007, 25(22):4447−4455.
[17] Wang YS, Ouyang W, Pan QX,et al.Molecular characteristics ofvp2gene of infectious bursal disease virus from immunoprophylaxis defeat's chickens in 2007.Chin Vet Sci, 2008, 38(12): 919−925.
王永山, 欧阳伟, 潘群兴, 等, 近期引起免疫失败的传染性法氏囊病病毒vp2基因的分子特征. 中国兽医科学,2008, 38(12): 919−925.
[18] Zhou ZA, Wang YS, Deng XZ,et al.Survey on the ecology and epidemiology of infectious bursal disease virus. Chin J Vet Sci, 1998, 18(5): 430−433.周宗安, 王永山, 邓小昭, 等. 传染性法氏囊病病毒的生态学与流行病学研究. 中国兽医学报, 1998, 18(5):430−433.
[19] Wang ZC, Wang YS, Tang YD,et al.Development of the detection system for infectious bursal disease virus.Chin J Vet Sci, 2008, 28(9): 1015−1019.
王忠灿, 王永山, 唐雨德, 等. 传染性法氏囊病病毒检测系统的建立. 中国兽医学报, 2008, 28(9): 1015−1019.
[20] Wang YS, Wang ZC, Tang YD,et al. Comparison of four infectious bursal disease virus isolated from different bird species.Arch Virol, 2007, 152(10): 1787−1797.
[21] Karpenko LI, Ilyichev AA, Eroshkin AM,et al.Combined virus-like particle-based polyepitope DNA/protein HIV21 vaccine design immunogenicity and toxicity studies.Vaccine, 2007, 25(21): 4312−4323.
[22] Antonis AF, Bruschke CJ, Rueda P,et al.A novel recombinant virus-like particle vaccine for prevention of porcine parvovirus-induced reproductive failure.Vaccine,2006, 24(26): 5481−5490.
Recombinant Vp2 protein of infectious bursal disease virus AH1 strain expressed in insect cells: a vaccine candidate
Wei Ouyang1,2, Yongshan Wang1, Yu Zhou1,2, Haibin Zhang2, and Yude Tang3
1Key Laboratory of Animal Diseases and Immunology,Ministry of Agriculture National Center for Engineering Research of Veterinary Bio-products,Institute of Veterinary Medicine,Jiangsu Academy of Sciences,Nanjing210014,China
2College of Veterinary Medicine,Nanjing Agricultural University,Nanjing210095,China
3Huadong Research Institute of Medical Biotechnics,Nanjing210002,China
Received:December 4, 2009;Accepted:March 26, 2010
Supported by:National Natural Science Foundation of China (No. 30571371), Natural Science Foundation of Jiangsu Province (Nos. BK2008352,BK2009041), Agriculture Science and Technology Innovation Foundation of Jiangsu Province (No. CX(08)106).
Corresponding author:Yongshan Wang. Tel: +86-25-84390339; E-mail: wangyongshan2001@yahoo.com.cn; wangys63@126.com
国家自然科学基金 (No. 30571371),江苏省自然科学基金 (Nos. BK2008352, BK2009041),江苏省农业科技创新基金 (No. CX(08)106) 资助。

