新型重组AAV5/5载体及包装系统
董小岩,田文洪,袁振华,谭淑萍,吴小兵
1 中国疾病预防控制中心病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052
2 复旦大学 生命科学学院 遗传学研究所 遗传工程国家重点实验室,上海 200433
3 北京五加和分子医学研究所有限公司,北京 100176
生物技术与方法
新型重组AAV5/5载体及包装系统
董小岩1,2,3*,田文洪1*,袁振华1,谭淑萍1,吴小兵1
1 中国疾病预防控制中心病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052
2 复旦大学 生命科学学院 遗传学研究所 遗传工程国家重点实验室,上海 200433
3 北京五加和分子医学研究所有限公司,北京 100176
本研究组建了一种可用于规模化生产的以重组单纯疱疹病毒为辅助病毒的AAV5/5载体包装系统。首先,将5型腺相关病毒 (AAV5) 的rep和cap基因插入I型单纯疱疹病毒 (HSV-1) 基因组非必需基因UL2中,获得重组病毒rHSV1-rep5cap5。其次,构建一种携带AAV5 ITR的通用型载体质粒pAAV5neo,将报告基因EGFP插入pAAV5neo中,得到pAAV5neo-EGFP质粒。将pAAV5neo-EGFP质粒导入BHK-21细胞,用G418选择培养,挑选出表达EGFP并在重组病毒rHSV1-rep5cap5感染下能高效产生rAAV5/5-EGFP的单克隆载体细胞株C020。用rHSV1-rep5cap5感染C020细胞制备rAAV5/5-EGFP,用“氯仿处理-聚乙二醇/氯化钠-氯仿抽提”方法粗纯化rAAV5/5-EGFP。用100 kDa分子量截流超滤方法进一步纯化和浓缩,获得高纯度的rAAV5-EGFP。SDS-PAGE电泳分析可见3条特征性外壳蛋白带。电镜分析显示病毒颗粒以实心颗粒为主。用rAAV5/5-EGFP病毒按1×105vg/cell感染体外培养的HEK293细胞,可见30%细胞呈现绿色荧光。本研究提出了一种高效AAV5/5载体生产系统和纯化方法,为重组AAV5载体的进一步应用提供了基础。
5型腺相关病毒 (AAV5),I型单纯疱疹病毒 (HSV1),病毒载体,包装系统
Abstract:We developed a scalable AAV5/5 vector packaging system by using replication competent recombinant herpes simplex type 1 virus as helper virus. The fragment containingrepandcapgenes of AAV5 was inserted into the non-necessary gene (UL2) of HSV1 genome, resulting in the helper virus rHSV1-rep5cap5. An AAV5/5 vector pAAV5neo carrying two AAV5 ITRs was constructed by inserting aneogene expression cassette into the plasmid backbone of pAV5CMV-GFP. pAAV5neo-EGFP was constructed by insertingEGFPgene into pAAV5neo. BHK21 cell was transfected with pAAV5neo-EGFP and cultured in the presence of G418. EGFP expression positive monoclonal cells were picked up, and one that produced rAAV5/5-EGFP with thehighest efficiency under the help of rHSV1-rep5cap5 was chosen as the production cell line named as C020. rAAV5/5-EGFP was produced by infecting C020 cells with rHSV1-rep5cap5, and crudely purified by our previous method of ‘chloroform treatment-PEG8000/NaCl precipitation- chloroform extract’. rAAV5/5-EGFP preparation with high purity was obtained by ultrafiltration with molecular weight cut-off value of 100 kDa. SDS-PAGE stained with Coomassie brilliant blue R250showed clearly specific pattern of three bands of AAV capsid proteins. rAAV5/5-EGFP was also assayed using negative stain transmission electron microscopy and the majority of the virus particles were found solid. About 30% green fluorescent cells could be seen after infecting HEK293 cells with rAAV5/5-EGFP 24 h at 1×105vg/cell. In conclusion, we have established an efficient AAV5/5 vector production system and could produce recombinant AAV5/5 virus in large amounts for gene therapy research.
Keywords:Adeno-associated virus type 5 (AAV5), herpes simplex virus I, virus vector, production system
腺相关病毒 (Adeno-associated virus,AAV) 载体在基因治疗研究中受到广泛的关注。自然界中存在多种血清型的AAV病毒,目前得到公认的有8个型 (AAV 1至5型,以及7至9型)[1]。不同血清型AAV病毒的细胞亲嗜性存在明显的差异,感染细胞时所利用的细胞受体也不一样。AAV2的主要受体是硫酸肝素糖蛋白 (HSPG),ανβ5整合素和 bFGF受体1是其辅助受体。通常认为AAV5的主要受体是含有2,3-交联唾液酸 (2,3-linked sialic acid) 的糖蛋白[2],血小板来源的生长因子受体 (PDGFR) 可能是AAV5的一种辅助受体[3]。
AAV载体的大量制备是开展其应用研究的前提。研究发现将 AAV2的rep基因和AAV5的cap基因杂合成rep2cap5用于包装含有 AAV2 ITR(Inverted repeat terminal) 的基因组效率低[4],可能是因为AAV2的rep蛋白不能有效地将带有AAV2 ITR的单链基因组DNA包装到AAV5的外壳中去。为了避免AAV5与AAV2 ITR之间可能存在的“不匹配”问题,本研究拟构建一种用携带 AAV5自身 ITR(ITR5) 的通用型载体 pAAV5neo,以及携带 AAV5repcap基因的重组单纯疱疹病毒 HSV1-rep5cap5,组建成rAAV5/5载体的包装系统,为AAV5/5载体研究和应用提供基础。
1 材料与方法
1.1 材料
1.1.1质粒、菌种和细胞株
pAV5-Trans质粒和pAV5CMV-GFP质粒由中国疾病预防控制中心病毒病预防控制所舒跃龙博士惠赠。pAV5-Trans中携带了AAV5的rep和cap基因编码区,长度约4.3 kb,用XbaI可将其从质粒上完整切出。pAV5CMV-GFP含有 AAV5的两个反转末端重复序列 (ITR5),两个 ITR5之间为 CMV-GFPSV40 poly A表达盒。pAAV2neo为病毒基因工程国家重点实验室构建及保存。pSV2neo为病毒基因工程国家重点实验室保存。携带重组 HSV1病毒基因组的5个粘粒Cos6、Cos28、Cos14、Cos56和Cos48由英国Glascow大学的A.J. Davison[5]惠赠。这些粘粒的骨架是Supercos MW,分别携带了HSV1(17株)病毒的基因组的长约40 kb的HSV1基因组片段,这些片段的末端序列相互重叠,覆盖了全长的HSV1基因组 (152 kb)。Max Efficiency DH5α感受态菌购自Invitrogen公司。BHK21及HEK293细胞为病毒基因工程国家重点实验室保存。
1.1.2试剂
转染试剂Lipofectamine 2000TM为Invitrogen公司产品。磷酸钙转染试剂为北京五加和分子医学研究所有限公司产品。T载体试剂盒购自 Promega公司。PacI酶为NEB公司产品,其他内切酶、修饰酶以及高保真Taq酶 (PyroBestTaq) 均为 TaKaRa公司产品。地高辛标记检测试剂盒为 Boehringer Mannheim公司的产品。胎牛血清购自Hyclone公司。细胞培养用低熔点琼脂糖 SeaPlaque Agarose购自Lonza公司。BM2000 DNA Marker购自Biomed公司。λ/Hind III DNA marker购自TaKaRa公司。
1.2 方法
1.2.1质粒构建
重组粘粒Cos6-rep5cap5的构建步骤:用XbaI酶切pAV5-Trans,回收约4.3 kb的rep5cap5基因片段,将该片段插入到粘粒Cos6的XbaI位点中,得到重组粘粒Cos6-rep5cap5。
pAAV5neo的构建步骤:通过酶切补平再连接的方法消除掉 pSV2neo中的Hind III位点,成为pSV2neo-1。用PCR方法扩增质粒pSV2neo-1中的neo基因表达盒:上游引物序列为:5′-CTGCAAG CTT TGGGCGAAGAACTCCAGCAT-3′,下游引物序列为 5′-GCCAAAGCTT ACGTGACTGGGTCATGGC TG-3′,两条引物均在5′端引入了Hind III酶切位点,用下划线标出。PCR扩增获得长约1.8 kb的产物,经Hind III酶切后插入到质粒pAV5CMV-GFP的骨架上Hind III位点中,得到载体质粒 pAV5CMVGFPneo。合成引物 5′-TTAGGATCC ATAGAGCCC ACCGCATCC-3′及 5′-GTTGGATCC CTCGAGGA GCTTGCCATT-3′,下划线标记处为BamH I酶切位点。用 PCR方法扩增 pAAV2neo质粒中的CMV-MCS-bGH polyA片段,经BamH I酶切后插入pAV5CMV-GFPneo中的BamH I位点中 (替代原来的 CMV-GFP-SV40 polyA),得到 pAAV5neo。用 PCR方法将EGFP基因插入pAAV5neo的KpnI和SalI位点之间,构建成pAAV5neo-EGFP。
1.2.2重组辅助病毒rHSV1-rep5cap5的产生和鉴定
为获得携带AAV5rep和cap基因的重组HSV1病毒rHSV1- AAVrep5cap5,将Cos6-AAVrep5cap5、Cos28、Cos14、Cos56和Cos48各取2 μg混合,分别用1 μLPacI酶切过夜。酶切反应液分别2.5倍体积的无水乙醇,−70℃放置 30 min后,于 4℃12 000 r/min离心10 min,弃上清,得到的DNA沉淀用10 μL无菌TE溶液溶解,以备转染用。
在60 mm培养皿中接种2×106个HEK 293细胞,培养过夜。转染前 4~6 h换新鲜培养液 (含 10%FBS的DMEM)。在无菌的1.5 mL的Eppendorf管加入上述酶切处理后回收的DNA各 10 μL,加入无菌超纯水 125 μL,混匀。后加入2.5 mol/L CaCl215 μL,用涡旋器充分混匀;再沿管壁加入 2×HBS 150 μL,轻轻混匀,室温下静置5 min,加入60 mm平皿的HEK293细胞培养液中,小心混匀。置37℃、5% CO2培养箱中培养过夜,次日换成新鲜的含10%FBS的DMEM培养液。之后每2~3 d换液1次,直到出现CPE (细胞变大变圆现象) 。收取病变细胞及上清在−70℃和37℃反复冻融3次,4 000 r/min、4℃离心 15 min,取上清作为重组辅助病毒 rHSV1-rep5cap5的原始毒种。
将原始毒种进行系列稀释后感染 6孔板中的BHK21细胞,用含有 0.5%的低溶点琼脂糖(SeaPlaque Agarose,Lonza公司)的完全培养液覆盖,在37℃、5% CO2的条件下培养。3 d后随机挑取彼此分离良好的单噬斑病毒分别扩增备用。
设计针对 AAV5cap基因的特异引物对用于rHSV1-rep5cap5的筛选鉴定。上游引物cap5F序列为 5′-ACGTACAACCTCCAGGAAAT-3′,下游引物cap5R 序列为 5′-TCTCTGGGTTCCA CCTCTTG-3′,扩增片段长310 bp。为了鉴定rHSV1-rep5cap5病毒基因组中rep5cap5片段的插入方向,在插入位点(UL2基因的XbaI位点) 附近设计一对引物:HSV1 UL2 up 5′-ACCCTGACCGTCAAGCGCGG-3′;HSV1 UL2 down 5′-CGGATAACTCCGCCCACGAA-3′。将cap5F引物分别与HSV1 UL2 up和HSV1 UL2 down引物配对进行PCR扩增。取50 μL rHSV1-rep5cap5病毒液煮沸10 min作为PCR反应的样品DNA模板。
1.2.3AAV5/5-EGFP载体细胞株的建立和筛选
取纯化的pAAV5neo-EGFP质粒DNA按脂质体Lipofectamine 2000说明书中的操作方法转染BHK21细胞,转染后4~6 h换成含10%胎牛血清的DMEM完全培养液;24 h后换成含800 μg/mL G418的完全培养液培养,之后每2 d换液1次,抗性细胞克隆生长至融合时消化传代,至15 d后撤去培养液中的 G418继续培养并冻存,命名为 BHK21/pAAV5neo-EGFP细胞。
将BHK21/pAAV5neo-EGFP细胞消化后接种约1×104于6孔板的1孔中,按10倍比连续稀释至其余5孔,培养2~3 d后换成含0.5%低熔点琼脂糖的DMEM/2% FBS液铺板培养1~2 d,在荧光显微镜下标记发绿色荧光的细胞克隆,挑取分离良好的单克隆细胞扩增培养及冻存。用重组辅助病毒rHSV1-rep5cap5感染各单克隆细胞株测试其包装AAV病毒的效果,选择包装效率最高的单克隆细胞株作为rAAV5/5-EGFP的生产细胞。
1.2.4rAAV5/5-EGFP的大量制备和纯化
将1.2.3中挑选出的rAAV5/5-EGFP的生产细胞扩大培养至5个转瓶 (220 mm×10 cm),用空斑纯化后的重组辅助病毒 rHSV1-rep5cap5 以 moi(Multiplicity of infection)=1~5感染细胞,72 h后,收集上清和病变细胞,1 200×g离心15 min收集病变细胞 (弃去上清),用PBS液重悬细胞沉淀,−70℃与 37℃之间反复冻融 3次。按吴小兵等[6]发表的方法进行粗纯化。将粗纯的rAAV5/5-EGFP样品用100 kDa切向流膜包 (millipore公司) 进行超滤,用PBS液置换液体,最后浓缩至约5 mL,用0.22 μm的滤膜过滤除菌,分装于−70℃条件下保存。用地高辛标记的 CMV探针点杂交方法测定病毒滴度(Viral genomes/mL,vg/mL)。
1.2.5电镜分析
将纯化后的 rAAV5/5-EGFP病毒用 2%钨酸盐负染后,置透射电子显微镜下,观察病毒形态和空壳率,并拍照。
1.2.6SDS-PAGE分析
将纯化的 rAAV5/5-EGFP病毒用 10% SDSPAGE电泳分析纯度。用本课题组以前制备的rAAV2/2-EGFP及rAAV2/1-EGFP病毒作为对照。考马斯亮兰R250染色。
1.2.7rAAV5/5-EGFP病毒感染性检测
将 HEK293细胞按 1×105cell/孔的细胞量接种到6孔 (24孔板) 中。培养过夜后,按1×105vg/cell加入rAAV5/5-EGFP病毒,对照孔加等量rAAV2/2-EGFP病毒。24 h后置倒置荧光显微镜下观察EGFP表达情况。
2 结果
2.1 AAV5质粒载体
构建的通用型 AAV5/5载体质粒 pAAV5neo和携带EGFP的AAV5载体质粒pAAV5neo-EGFP结构如图1所示。pAAV5neo质粒携带了AAV5病毒的2个ITR(ITR5),CMV立早启动子 (Pcmv)、可供外源基因插入的KpnI和SalI位点、牛生长激素基因的多聚腺苷酸加尾信号 (bGH polyA),质粒骨架上含有氨苄青霉素抗性基因 (Ampr) 和neo基因表达单位 (neo)。将EGFP基因插入pAAV5neo的KpnI和SalI位点间得到pAAV5neo-EGFP。
2.2 辅助病毒rHSV1-rep5cap5的产生
将 AAV5repcap基因片段插入到粘粒 Cos6的XbaI位点中,得到了重组粘粒 Cos6-rep5cap5。酶切鉴定结果 (图2B) 显示,用XbaI酶切可以切出2条带,包括约4.3 kb的rep5cap5片段和一条更大的DNA片段 (cos6)。
将 Cos6-AAVrep5cap5、Cos28、Cos14、Cos56和Cos48用PacI线性化后共转染293细胞,获得了重组单纯疱疹病毒 rHSV1-rep5cap5,其基因组结构如图 2A所示。用 PCR方法鉴定空斑纯化后的rHSV1-rep5cap5 (图2C),可见用AAV5cap引物对可以扩增出一条位于 250~500 bp之间的特异条带(泳道1),与预期的310 bp扩增片段相符;用AAV5cap上游引物与UL2上游引物未扩增出条带 (泳道3),而用AAV5cap上游引物与UL2下游引物可扩出约500 bp的条带 (泳道4),说明rep5cap5是正向插入UL2基因中的。

图1 pAAV5neo及pAAV5neo-EGFP质粒图谱Fig.1 Map of pAAV5neo and pAAV5neo-EGFP.
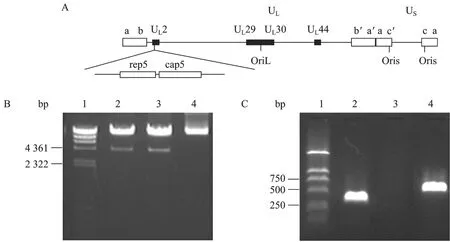
图2 重组辅助病毒rHSV1-rep5cap5的产生和鉴定Fig.2 Generation and identification of rHSV1-rep5cap5. (A) Map of rHSV1-rep5cap5 genome structure. (B) Cos6-rep5cap5 digested byXbaI. 1: λ/Hind III DNA marker; 2, 3: cos6- rep5cap5 digested byXbaI; 4: cos 6. (C) Identification of rHSV1-rep5cap5 by PCR. 1: BM2000 DNA marker; 2: PCR with primers cap5F and cap5R; 3: PCR with primers cap5F and UL2 up; 4: PCR with primers cap5F and UL2 down.
2.3 rAAV5/5-EGFP生产细胞株的获得
将pAAV5neo-EGFP转染至BHK21细胞中,用含800 mg/L G418的完全培养基培养15 d后,获得混合克隆的载体细胞株 BHK21/pAAV5neo-EGFP。挑取表达绿色荧光蛋白的单克隆细胞株12株,并用重组辅助病毒rHSV1-rep5cap5测试其AAV病毒包装功能,选出一株包装效果最好的单克隆细胞株C020作为rAAV5/5的生产细胞株 (图3)。结果可见C020细胞几乎100%表达绿色荧光蛋白。
2.4 纯化后的rAAV5/5-EGFP的SDS-PAGE分析
AAV5的衣壳由3种蛋白质组成,即VP1、VP2、VP3,进行10% SDS-PAGE电泳时,可以见到二细一粗的3条特征性条带。将纯化后的rAAV5/ 5-EGFP病毒进行SDS-PAGE分析,如图4所示,VP1、VP2、VP3这3种蛋白的条带十分清晰,由杂蛋白产生的条带基本不可见,经凝胶扫描图像分析,杂蛋白含量少于5%,且与rAAV1/2-EGFP (图4,泳道3) 和rAAV2/2-EGFP (图4,泳道2) 相比,带型有一定的差别。
2.5 纯化后的rAAV5/5-EGFP的电镜分析
将纯化后的rAAV5/5-EGFP经钨酸盐负染后在透射电子显微镜下观察并照相 (图 5)。从图中可见,rAAV5/5-EGFP病毒粒子清晰可见,其中有少量的空壳。

图3 rAAV5/5-EGFP的生产细胞株C020Fig.3 Production cells C020 for rAAV5/5-EGFP. (A) C020 cells under visible light. (B) C020 cells under UV light.
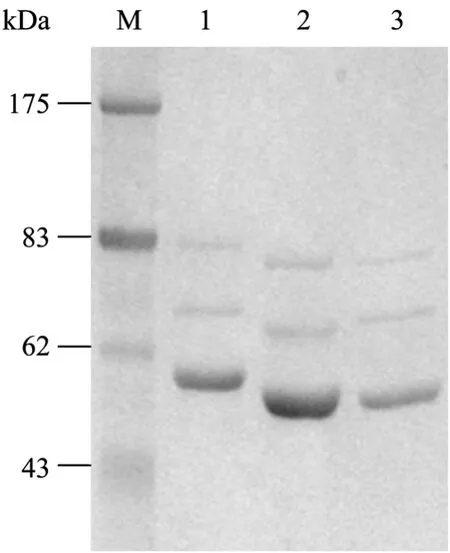
图4 rAAV5/5-EGFP、rAAV2/2-EGFP和rAAV2/1-EGFP病毒样品的SDS-PAGE电泳图Fig.4 SDS-PAGE with coomassie bright blue stain for rAAVs. M: protein molecular marker; 1: rAAV5/5-EGFP; 2:rAAV2/2-EGFP; 3: rAAV2/1-EGFP.
2.6 rAAV5/5-EGFP转导HEK293细胞实验
为了检测 rAAV5/5-EGFP的感染性,用每细胞1×105vg rAAV5/5-EGFP病毒感染培养的HEK293细胞,等量的rAAV2/2-EGFP病毒作为对照。24 h在荧光显微镜下照相结果见图 6。可见感染 rAAV5/5-EGFP的HEK293细胞约30%绿色荧光阳性,且荧光强度较弱;而感染 rAAV2/2-EGFP的对照细胞几乎100%阳性,荧光强度较强。
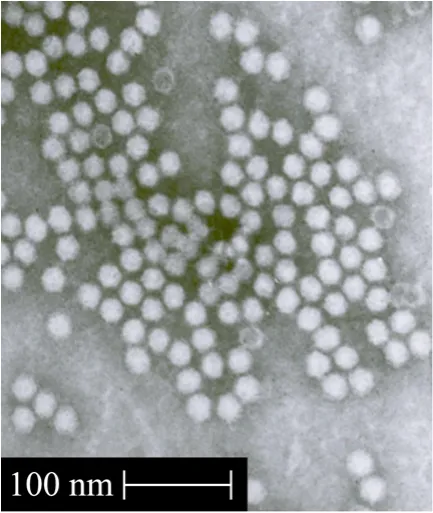
图5 rAAV5/5-EGFP病毒的透射电镜图 (52 000×)Fig.5 Transmission electron microscopy of rAAV5/5-EGFP(52 000×).

图6 rAAV5/5-EGFP及rAAV2/2-EGFP感染HEK293细胞Fig.6 Infection of HEK293 cells by rAAV5/5-EGFP and rAAV2/2-EGFP. A: 293 cells infected by rAAV5/5-EGFP with 1×105vg/cell, 24 h; B: HEK293 cells infected by rAAV2/2-EGFP with 1×105vg/cell, 24 h.
3 讨论
AAV病毒载体因具有广泛的细胞和组织嗜性、转染效率高、安全性好、免疫原性较低等优点而在基因治疗中得到越来越多的应用。近年来多种血清型的 AAV载体 (AAV1~11) 的发展使得 AAV载体的应用有了更多的选择[7]。不同血清型的AAV载体具有明显不同的组织细胞嗜性。目前,除了 AAV2载体之外,受到广泛关注的还有 AAV1、AAV5、AAV8、AAV9等载体。AAV1载体在肌肉组织高表达,AAV8载体在肝脏、肌肉组织中高表达;AAV5载体在呼吸道上皮、视网膜、神经组织中高表达;AAV9载体在心肌组织中高表达;而 AAV2载体在各种组织的表达相对其他 AAV载体来说都是中等水平[1]。
最早建立起来的AAV载体系统是基于AAV2病毒的。载体质粒构建时将外源基因表达单位插入两个AAV2 ITR之间,在AAV2repcap质粒及辅助病毒 (腺病毒或疱疹病毒) 或辅助质粒 (如携带了腺病毒E2A、E4ORF6、VA RNA的pHelper质粒) 存在下包装成重组AAV2病毒。目前国际上包装其他血清型AAV病毒载体通常采用交叉包装的方式[4],即用杂合的rep2cap(n)质粒 (n代表相应的血清型) 替代AAV2repcap质粒包装携带了AAV2 ITR的病毒,形成重组AAV2/(n) 病毒。
AAV5与其他血清型AAV在基因组序列水平上的差异较大。AAV5与AAV2的rep基因的同源性仅为67%,而AAV2、AAV3和AAV6之间的rep基因同源性约为90%左右。AAV5的ITR与AAV2的ITR之间的同源性只有58%,远比AAV2与AAV3、AAV6之间的 ITR的同源性要低[8]。研究发现在包装重组AAV2/5时包装效率较低[4]。可能是因为AAV2的rep蛋白不能有效地将带有 AAV2 ITR的单链基因组DNA 包装到AAV5的外壳中去。
Xiao等[8]提出的三质粒共转染生产AAV载体至今仍是国际上AAV载体制备的主要方法。该系统的特色在于用携带了5型腺病毒的E2A、E4 ORF6和VA RNA基因的辅助质粒代替腺病毒作为辅助病毒的功能,将该质粒与AAV载体质粒、repcap助手质粒共转染HEK293细胞,即可包装出重组AAV载体病毒。与传统方法相比,其主要优越性在于生产系统中无需辅助病毒,因此称为无辅助病毒的AAV包装系统 (Helper free AAV packaging system)。然而,这个系统依赖于转染,需要大量制备高质量的质粒DNA等不足之处,更为不利的是,用三质粒共转染包装系统生产的AAV病毒含有较多的空壳病毒,需要用超速离心方法去除。
本课题组曾用“一种病毒感染一个载体细胞株”的策略建立了一种高效制备AAV2/2载体的方法[9],并在基因治疗研究中得到广泛应用。随后本课题组用同样的策略成功地建立了 AAV2/1载体包装系统并用于基因治疗研究[10-11]。这种生产策略具有操作简便、无需转染细胞、可以大规模生产的优点。本研究拟用类似的策略组建一种rAAV5/5病毒的包装系统。
本研究构建了通用型的AAV5载体pAAV5neo,其中携带了2个AAV5的ITR (172 bp,比AAV2 ITR 145 bp稍长)。两个AAV5 ITR 之间是CMV启动子、多克隆位点和牛生长激素基因polyA加尾信号。在质粒骨架上插入了neo基因表达单位,用于筛选稳定转染的 AAV5载体细胞株。在此基础上构建了pAAV5neo-EGFP,用于测试该载体的功能。同时,本研究利用携带 HSV1 (17 strain) 的一套粘粒(setC,包含 cos6、cos14、cos28、cos48、cos56) 获得了重组单纯疱疹病毒 rHSV1-rep5cap5,并进行空斑纯化,作为包装AAV5/5载体的辅助病毒。
为了测试该包装系统的功能,本研究用pAAV5neo-EGFP转染BHK-21细胞,用G418选择培养,并挑选出单克隆细胞株 C020作为生产rAAV5/5-EGFP的生产细胞。用 HSV1-AAV5repcap感染C020细胞株,72 h后收获上清和细胞,用本课题组建立的“氯仿处理-聚乙二醇/氯化钠-氯仿抽提”方法[6]进行粗纯化,之后用100 kDa分子量截流超滤方法进一步纯化和浓缩。从SDS-PAGE分析结果看,rAAV5/5-EGFP病毒显示出清晰的 3条外壳蛋白条带 (从大到小为 VP1、VP2、VP3),未见其他杂蛋白带。与对照的 rAAV2/2-EGFP和 rAAV2/1-EGFP病毒相比,3条外壳蛋白带之间的相对距离略有差别。电镜分析结果表明 rAAV5/5-EGFP病毒颗粒完整,以实心颗粒为主。
体外细胞实验表明,rAAV5/5-EGFP病毒可以有效感染 HEK293细胞。然而与相同量的 rAAV2/2-EGFP病毒相比,rAAV5/5-EGFP病毒的感染效率和细胞表达EGFP的水平都不如rAAV2/2-EGFP。这个结果与 Klein等[12]的报道是一致的。他们的研究认为不同血清型AAV载体介导EGFP基因体外感染HEK293细胞的表达水平依次是AAV2 >>AAV1 >>AAV8 >AAV5。然而,值得注意的是,AAV载体的体外感染实验与体内感染实验的结果往往是不一致的[13],因此不能依据体外实验的结果选择体内应用的AAV载体血清型。
本研究表明,“一株载体细胞/一株辅助病毒”策略及“氯仿处理-聚乙二醇/氯化钠-氯仿抽提”粗纯化方法[6]同样适合于制备 rAAV5/5病毒。在此基础上,用100 kDa分子量截流超滤方法可以进一步纯化AAV病毒并置换缓冲液。
Wustner等也曾报道过用携带AAV5rep和cap基因的重组 HSV1病毒来包装AAV5/5载体[14]。本研究与其不同之处是本研究采用了 BHK-21细胞而不是HEK293细胞作为生产细胞;本研究的rep5cap5插入 HSV1基因组中的位置是UL2基因,获得的rHSV1-rep5cap5是复制型的,而他们的rep5cap5是插入 HSV1 TK中,并且是复制缺陷的 (缺失了ICP27基因);他们采用瞬时转染载体质粒加辅助病毒感染的方式制备 AAV5/5病毒,而本研究采用辅助病毒感染稳定转染的载体细胞的方式。他们的研究结果表明其生产系统的包装效率受到辅助病毒引起生产细胞 (HEK293细胞) 产生病变的限制。本研究未发现 AAV5/5载体包装效率低的问题,下一步拟对 AAV5/5载体的包装效率做更深入的研究。总之本研究建立的rAAV5/5载体包装系统和纯化方法为下一步开展rAAV5/5的规模化制备和应用研究打下了基础。
REFERENCES
[1] Wu ZJ, Asokan A, Samulski RJ. Adeno-associated virus serotypes: vector toolkit for human gene therapy.Mol Ther, 2006, 14(3): 316–327.
[2] Walters RW, Yi SMP, Keshavjee S,et al. Binding of adeno-associated virus type 5 to 2,3-linked sialic acid is required for gene transfer.J Biol Chem, 2001, 276(23):20610–20616.
[3] Pasquale GD, Davidson BL, Stein CS,et al. Identification of PDGFR as a receptor for AAV5 transduction.Nat Med,2003, 9(10): 1306–1312.
[4] Rabinowitz JE, Rolling F, Li CW,et al. Cross-packaging of a single Adeno-associated virus (AAV) type 2 vectorgenome into multiple AAV serotypes enables transduction with broad speci fi city.J Virol, 2002, 76(2): 791–801.
[5] Cunningham C, Davison AJ. A cosmid-based system for constructing mutants of herpes simplex virus type 1.Virology, 1993, 197(1): 116–124.
[6] Wu XB, Dong XY, Wu ZJ,et al. A novel method for purification of recombinant adeno-associated virus vectors on a large scale.Chin Sci Bull, 2001, 46(6): 485–489.
吴小兵, 董小岩, 伍志坚, 等. 一种快速高效分离腺病毒伴随病毒的方法. 科学通报, 2000, 45(19): 2071–2075.
[7] Choi VW, McCarty DM, Samulski RJ. AAV hybrid serotypes: improved vectors for gene delivery.Curr Gene Ther, 2005, 5(3): 299–310.
[8] Xiao X, Li J, Samulski RJ. Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus.J Virol, 1998, 72(3): 2224–2232.
[9] Wu ZJ, Wu XB, Hou YD. Construction of a recombinant herpes simplex virus which can provide packaging function for recombinant adeno-associated virus.Chin Sci Bull, 1999, 44(8): 715–719.
伍志坚, 吴小兵, 侯云德. 具有AAV载体包装功能的重组HSV的产生. 科学通报, 1999, 44(5): 506–509.
[10] Yan H, Guo Y, Zhang P,et al. Superior neovascularization and muscle regeneration in ischemic skeletal muscles following VEGF gene transfer by rAAV1 pseudotyped vectors.Biochem Biophys Res Commun, 2005, 336(1):287–298.
[11] Han G, Wang R, Chen G,et al.Gene delivery GAD500 autoantigen by AAV serotype 1 prevented diabetes in NOD mice: transduction efficiency do not play important roles.Immunol Lett,2008, 115(2): 110–116.
[12] Klein RL, Dayton RD, Leidenheimer NJ,et al. Efficient neuronal gene transfer with AAV8 leads to neurotoxic levels of tau or green fluorescent proteins.Mol Ther, 2006,13(3): 517–527.
[13] Lipshutz GS, Titre D, Brindle M,et al. Comparison of gene expression after intraperitoneal delivery of AAV2 or AAV5in utero.Mol Ther, 2003, 8(1): 90–98.
[14] Wustner JT, Arnold S, Lock M,et al. Production of recombinant adeno-associated type 5 (rAAV5) vectors using recombinant herpes simplex viruses containing rep and cap.Mol Ther, 2002, 6(4): 510–518.
A novel packaging system of recombinant AAV5/5 vector
Xiaoyan Dong1,2,3*, Wenhong Tian1*, Zhenhua Yuan1, Shuping Tan1, and Xiaobing Wu1
1State Key Laboratory for Molecular Virology and Genetic Engineering,Institute for Viral Disease Prevention and Control,Chinese Center for Disease Prevention and Control,Beijing100052,China
2State Key Laboratory of Genetic Engineering,Institute of Genetics,School of Life Science,Fudan University,Shanghai200433,China
3Beijing Fiveplus Molecular Medicine Institute,Beijing100176,China
Received:January 3, 2010;Accepted:March 4, 2010
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2007AA021202), Autonomous Research Program of State Key Laboratory for Molecular Virology and Genetic Engineering (No. 2008-s-0008).
Corresponding author:Xiaobing Wu. Tel: +86-10-63523187; Fax: +86-10-63532053; E-mail: wuxb0168@vip.sina.com
*These authors contributed equally to this study.
国家高技术研究发展计划 (863计划) (No. 2007AA021202),病毒基因工程国家重点实验室自主课题 (No. 2008-s-0008) 资助。

