根区局部灌溉和有机无机氮比例对种植玉米土壤酶活性的影响
余江敏,李伏生,农梦玲
(广西大学农学院,广西南宁530005)
分根区交替灌溉(APRI)是一种作物局部根系受旱时,既能控制蒸腾耗水满足作物水分需求,又能发挥肥料最大肥效,提高作物产质的农田水分调控新思路。有关APRI对作物生理、生长发育、养分吸收、产量和提高水分利用效率等方面的影响研究已取得较大的进展[1-2]。Li等[3]研究表明,在施肥和充分供水条件下,与常规灌溉相比,APRI节水38.4%,水分利用效率和氮肥表观利用率分别提高24.3%和16.4%。目前有关APRI对土壤微生物的影响也有报道,Wang等[4]认为,在同一灌水方式下,轻度水分亏缺处理下微生物数量占有一定的优势,交替1/2根系灌水根系两侧土壤微生物数量分布均匀。土壤水分含量大小影响土壤酶活性。一般情况下,土壤干旱时,土壤酶活性下降,重新湿润时又能稍许提高酶活性[5];但土壤过湿或土壤含水量减少时,酶活性都会减弱[6]。有机无机肥配施是我国农田施肥的有效制度,它能提高土壤微生物和酶活性[7-12]。何炎森等[11]的试验表明,有机无机肥配施可提高土壤蔗糖酶、脲酶、蛋白酶、过氧化氢酶的活性,但在不同有机无机氮配施条件下,根区局部灌溉对土壤酶活性的影响研究较少。本试验在不同有机无机氮比例下,研究根区局部灌溉(PRI)对玉米拔节期、大喇叭口期和灌浆期土壤中酶活性的影响,旨在为根区局部灌溉应用和保持土壤质量提供科学依据。
1 材料与方法
1.1 试验设计
盆栽试验在广西大学农学院农业资源与环境教学实习基地网室大棚中进行。供试土壤采自广西大学农科教学基地的赤红土,土壤pH值为5.1、碱解氮79.9 mg/kg(1 mol/L NaOH碱解扩散法)、速效磷19.4 mg/kg(0.5 mol/L NaHCO3法)、速效钾 88.2 mg/kg(1 mol/L中性NH4Ac法),田间持水量为28%(质量百分数)。供试玉米(Zea mays)品种为强盛12。
试验采用完全方案设计,设3种灌水方式和3种有机无机氮比例,共9个处理,重复3次。灌水方式分别为常规灌溉(CI),每次对盆内土壤全部均匀灌水;分根区交替灌溉(APRI),每次交替对盆内1/2区域土壤灌水;固定部分根区灌溉(FPRI),每次固定对盆内其中一个1/2区域土壤灌水;在土壤采集时,FPRI处理灌水区为湿润区(FPRI-W);非灌水区为干燥区(FPRI-D);APRI处理取样前最后一次灌水区域为湿润区(APRI-W);非灌水区域称为干燥区(APRI-D)。3种有机无机氮比例分别为100%无机氮(F1)、70%无机氮+30%有机氮(F2)、40%无机氮+60%有机氮(F3)。化肥氮用尿素(分析纯)供给,0.15 g/kg;磷用磷酸二氢钾(分析纯)供给、磷酸二氢钾中钾不足时,用氯化钾(分析纯)补给,施用量分别为P2O50.10 g/kg和K2O 0.15 g/kg。有机肥为沤熟的牛粪(含N量为0.53%),其用量以纯N量计算。有机肥和无机肥均以基肥施入,装盆前与土壤充分拌匀。
试验用聚乙烯塑料桶(盆高23 cm、直径30 cm),所有处理盆中间均用塑料薄膜隔开,以阻止水分交换,两边各装风干土7 kg,每盆共装风干土14 kg。每盆均放置塑料灌水管到桶底部,灌水管的下半截均匀打数个小孔,底部与四周均有细纱布包裹,可以防止土壤因灌水而引起的土壤板结,在播种前将其浇至田间持水量的80%。
2008年4月13 日每盆播6粒已催芽露白的玉米种子播在塑料薄膜隔开处;4月27日选择均匀株间苗,每盆在塑料薄膜隔开处保留1株玉米苗;3~5片叶时(5月3日)开始对供试玉米进行灌水处理,控水前保持土壤含水量范围在田间持水量70%~ 80%。常规灌溉(CI)处理苗期土壤含水量保持在60%~80%,拔节期、大喇叭口期和灌浆期土壤含水量保持在85%~90%;固定部分根区灌溉(FPRI)与分根区交替灌溉(APRI)处理每次按CI灌水量的60%进行灌水。每次均于下午4至6点称重确定每次灌水量,苗期至拔节期间隔3d称1次,拔节期至收获间隔2 d称1次,用量筒量取灌水量,并记下各个处理的灌水量。6月9日收玉米植株。
1.2 样品采集和测定
试验分3次采集土样,即5月14日(播后31 d,拔节期)、5月24日(播后41 d,大喇叭口期)、6月 9日(播后56 d,灌浆期)。每次用土钻分别在湿润区和干燥区分别采样,每次采样时间为灌水后第2天上午8:00至11:00,采土前用采土区土壤擦拭1~2次,每次每个区域分2点采0—16 cm土层土壤,风干,过0.1mm筛,封袋保存,同时用烘干法测定土壤水分含量(质量百分数),以便计算每克干土中酶活性。
过氧化氢酶用高锰酸钾滴定法[0.1 mol/L KMnO4mL/(g◦h)];脲酶用苯酚-次氯酸钠比色法[NH3-N mg/(kg◦d)];酸性磷酸酶用磷酸苯二钠比色法[Phenol mg/(kg◦d)];转化酶用3,5-二硝基水杨酸比色法[Glu.mg/(g◦d)][6]测定。
试验数据的方差分析用SPSS12.0软件;多重比较用Duncan法,采用SPSS12.0软件进行分析。
2 结果与分析
2.1 根区局部灌溉和有机无机氮比例对土壤含水量的影响
本次试验共分3次采样。第1次采样(拔节期,图1A):单施无机氮(F1)时,固定部分根区灌溉湿润区(FPRI-W)土壤含水量明显高于常规灌溉(CI)和分根区交替灌溉湿润区(APRI-W),但CI和APRI-W之间的差异不明显;70%无机氮+30%有机N(F2)时,则以CI处理土壤含水量最高,但并未明显高于根区局部灌溉(PRI)湿润区;40%无机氮+60%有机N(F3)也以CI处理土壤含水量最高,明显高于APRI-W,但与FPRI-W之间差异不明显。第2次采样(大喇叭口期,图1B):3种有机无机氮比例均以FPRI-W土壤含水量最高,但并未明显高于CI和APRI-W。第3次采样(灌浆期,图1C):F1时,以FPRI-W土壤含水量最高,与CI差异不显著,但明显高于APRI-W;F2、F3时,以APRI-W土壤含水量最高,与CI和FPRI-W的差异不显著。另外,在3种有机无机氮比例条件下,3次采样根区局部灌溉(PRI)处理的干燥区土壤含水量均明显低于CI和PRI湿润区。
2.2 根区局部灌溉和有机无机氮比例对土壤酶活性的影响
试验表明,灌溉方式、有机无机氮比例和采样时期均明显影响土壤过氧化氢酶和转化酶活性;土壤脲酶和酸性磷酸酶活性,不仅灌溉方式、有机无机氮比例和采样时期对它们有显著影响,而且两因素和三因素之间的交互作用也有明显影响(表1)。
2.2.1 过氧化氢酶 过氧化氢酶促进土壤过氧化氢的分解,有利于防止它对生物体的毒害作用,它是参与土壤中物质和能量转化的一种重要氧化还原酶,在一定程度上可以表征土壤生物氧化过程的强弱[13]。表2看出,CI处理相比,F1时,大喇叭口期APRI干、湿两区土壤过氧化氢酶活性分别提高8.9%、2.0%,3个时期FPRI处理干、湿区过氧化氢酶活性均降低;F2时,拔节期APRI干、湿两区分别提高9.6%、5.6%,FPRI分别提高4.4%、11.9%,大喇叭口期和灌浆期均降低;F3时,拔节期APRI和FPRI干、湿两区过氧化氢酶活性有所提高,大喇叭口期和灌浆期FPRI-W均有所提高,增幅为2.0%~9.8%。统计分析表明,APRI处理,3个时期各有机无机氮比例干、湿两区和FPRI处理,拔节期各有机无机氮比例干、湿两区过氧化氢酶活性差异均不显著,而大喇叭口期和灌浆期过氧化氢酶活性干、湿两区差异显著,且均是湿润区过氧化氢酶活性大于干燥区。
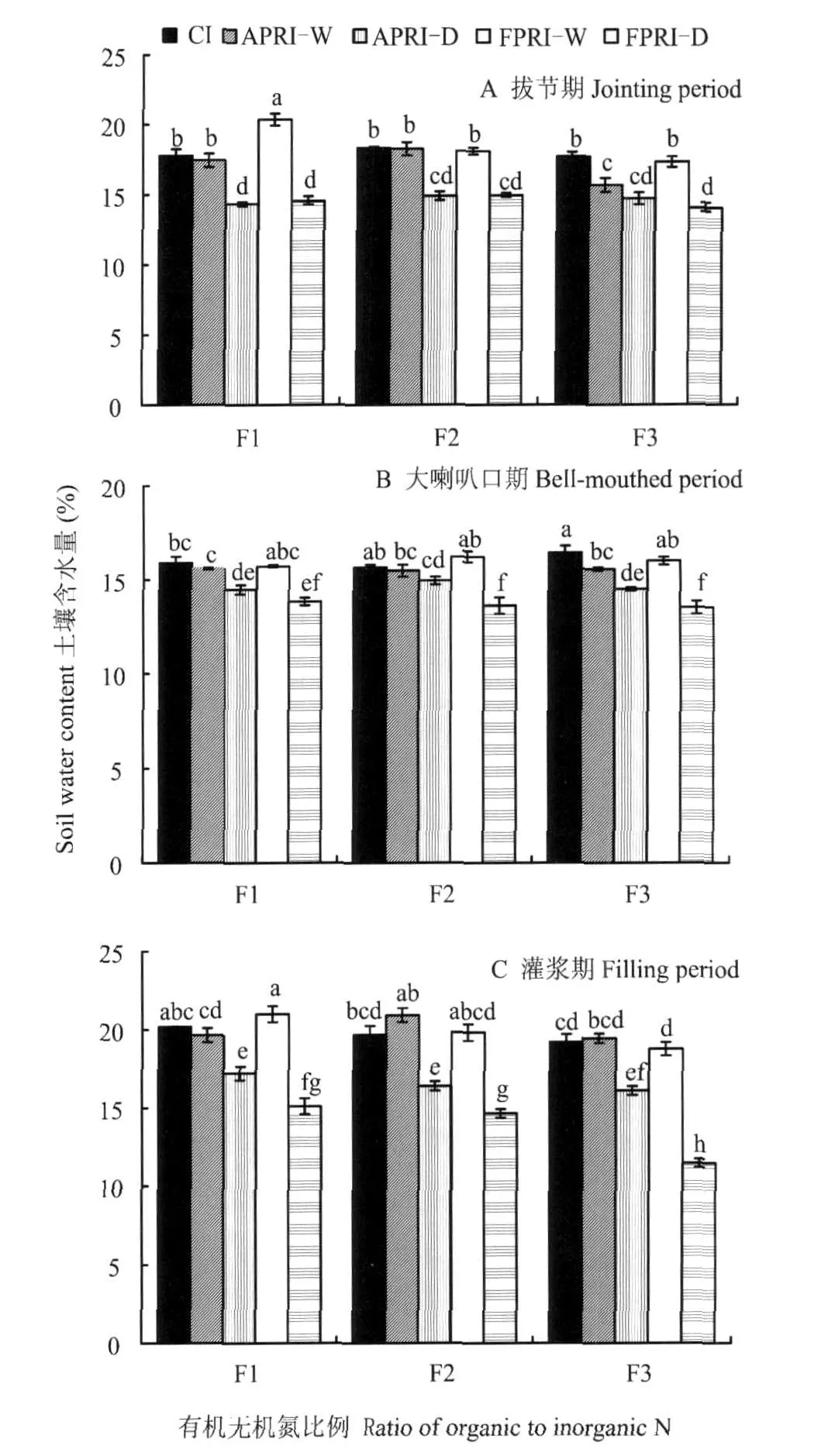
图1 根区局部灌溉和有机无机氮比例对土壤含水量的影响Fig.1 Effects of partial root-zone irrigation and ratio of organic to inorganic N on soil water content

表1 灌溉方式、有机无机氮比例和采样时期对4种土壤酶活性的影响方差分析Table 1 Probabilities of treatment differences in four soil enzymatic activities treated with the irrigation methods,ratios of organic to inorganic N and sampling stages
表2还看出,3种灌溉方式下,3个时期土壤过氧化氢酶活性以F3处理最高,以灌浆期过氧化氢酶活性最大。CI处理,F2处理拔节期、大喇叭口期和灌浆期分别比F1提高5.0%、24.8%和18.7%;F3时分别提高40.6%、54.2%和21.4%。APRI处理,与F1干、湿两区相比,拔节期、大喇叭口期和灌浆期,F2时干、湿区分别平均提高14.8%、19.6%,F3时分别平均提高39.1%、40.6%。FPRI处理,与F1干、湿两区相比,拔节期、大喇叭口期和灌浆期,F2干、湿区平均分别提高27.9%、23.9%,F3分别平均提高51.4%、48.4%。
2.2.2 脲酶 在土壤酶中,脲酶对尿素的转化作用具有重大影响的酶,酶促反应的最终产物—氨是植物氮源之一[13]。与 CI处理相比,F1时,拔节期,APRI-D和FPRI-W脲酶活性提高0.6%和0.9%;F2时,拔节期FPRI-D提高6.3%,大喇叭口期FPRI-W提高6.9%;F3时,APRI和FPRI干、湿两区在拔节期分别提高 25.2%、14.9%和 16.0%和 6.4%。APRI处理,各有机无机氮比例干、湿区两区脲酶活性在灌浆期没有显著差异,而在拔节期和大喇叭口期有明显差异。FPRI处理,各有机无机氮比例3个时期脲酶活性干、湿两区差异均显著,一般是湿润区脲酶活性大于干燥区(表2)。

表2 根区局部灌溉和有机无机氮比例对土壤过氧化氢酶和脲酶活性的影响Table 2 Effects of partial root-zone irrigation and ratio of organic to inorganic N on soil catalase and urease activities
表2表明,CI处理,与F1相比,F2拔节期、大喇叭口期和灌浆期脲酶活性分别提高45.0%、31.7%和7.9%,F3分别提高 37.7%、61.1%和 21.7%。APRI处理,与F1干、湿区相比,F2干燥区拔节期、大喇叭口期和灌浆期脲酶活性分别提高13.8%、30.7%和1.0%,湿润区分别提高20.2%、38.7%和8.1%。FPRI处理,与F1干、湿两区相比,3个时期F2干、湿区分别平均提高28.8%和36.6%;F3干、湿区分别平均提高37.4%和33.7%。
2.2.3 酸性磷酸酶 在pH 4~9的土壤中均有磷酸酶,磷酸酶对土壤磷素的有效性具有重要的作用,土壤中有机磷通过磷酸酶作用转化为无机磷供植物吸收利用,其活性是评价土壤磷素生物转化方向与强度的指标[13]。表3看出,与CI处理相比,F1时,灌浆期FPRI-W磷酸酶活性提高4.6%,F2时,拔节期FPRI-W提高41.5%,F3时,灌浆期APRI-D和FPRI-W提高2.8%和6.5%;其它条件下,根区局部灌溉土壤磷酸酶活性有所下降。APRI处理,F3干、湿两区磷酸酶活性拔节期差异显著,F1、F2处理3个时期差异均不显著,FPRI处理,F2分别在大喇叭口期磷酸酶活性差异不显著,F1、F3干、湿区在拔节期、大喇叭口期和灌浆期差异均显著,F3拔节期磷酸酶活性干燥区大于湿润区,大喇叭口期和灌浆期则相反。
3种灌溉方式下,CI处理,与F1相比,F2和F3拔节期到大喇叭口期,大喇叭口期到灌浆期,磷酸酶活性分别平均提高9.1%和3.6%。APRI处理,与F1干区相比,拔节期到灌浆期,F2、F3干区磷酸酶活性分别平均提高8.9%和8.7%;与F1湿区相比,F2、F3湿区灌浆期分别降低2.4%和1.4%,拔节期和大喇叭口期均有所提高。FPRI处理,与F1干、湿区相比,F2湿润区在拔节期提高58.3%,在大喇叭口期和灌浆期有所下降,F2干燥区则在灌浆期下降4.1%,拔节期和大喇叭口期均有所提高;F3湿润区在大喇叭口期下降8.3%,在拔节期和灌浆期以及F3干燥区在3个时期均有所提高。
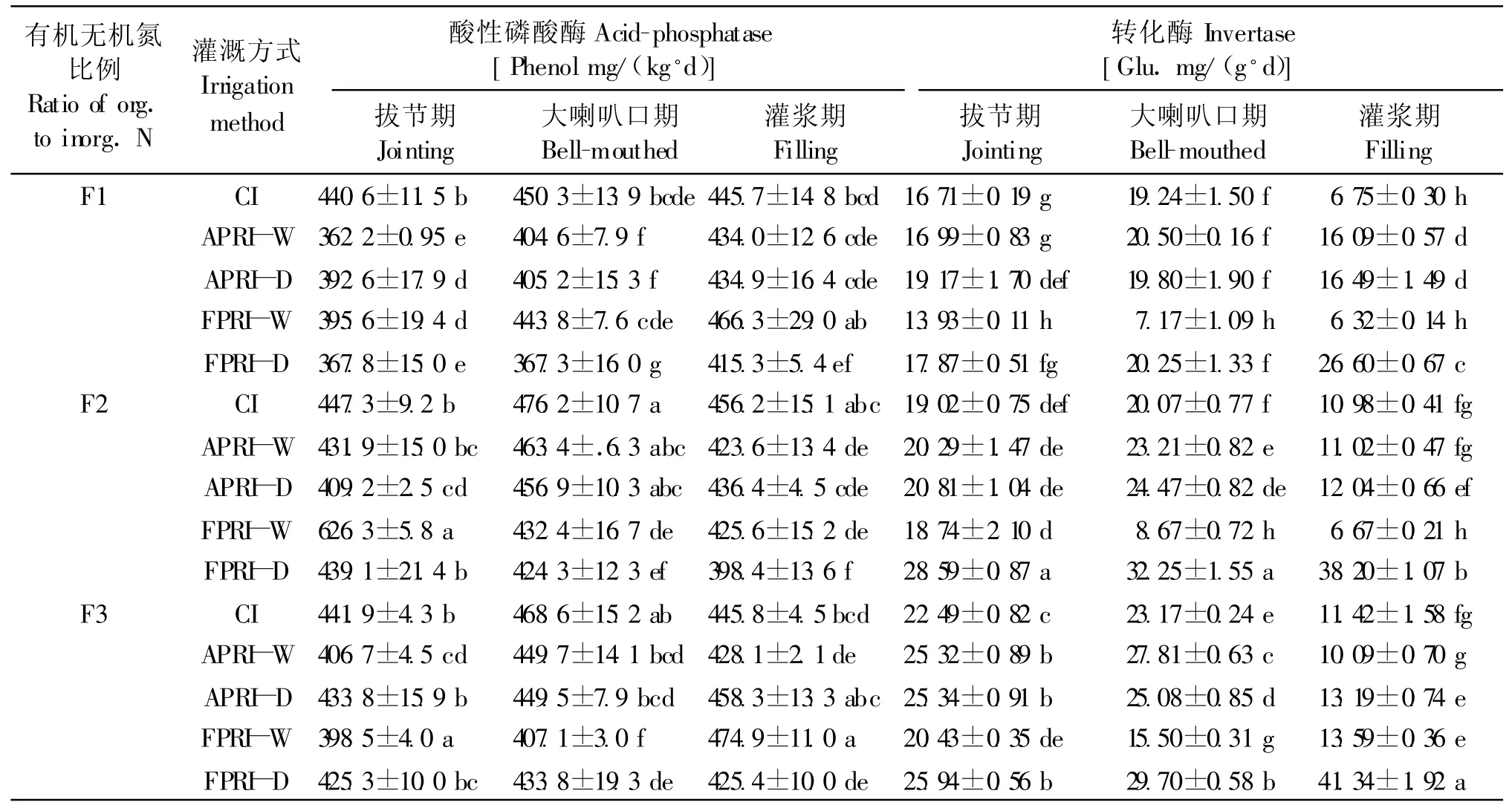
表3 根区局部灌溉和有机无机氮比例对土壤酸性磷酸酶和转化酶活性的影响Table 3 Effects of partial root-zone irrigation and ratio of organic to inorganic N on soil acid-phosphatase and invertase activities
2.2.4 转化酶 土壤转化酶又叫蔗糖酶,它参与土壤中碳水化合物的转化,使蔗糖水解成葡萄糖和果糖,转化为植物和微生物能够利用的营养物质[13]。与CI处理相比,F1时,APRI干、湿区在拔节期、大喇叭口期、灌浆期则分别提高1.7%、6.6%、138.3%和14.7%、2.9%、144.2%;FPRI-W3个时期均低于CI处理,FPRI-D拔节期、大喇叭口期、灌浆期平均提高78.2%。F2时,APRI干区在拔节期、大喇叭口期、灌浆期分别提高9.4%、21.9%和9.7%,湿区分别提高6.7%、15.6%和0.4%;3个时期FPRI-W均低于CI处理,FPRI-D则平均提高136.7%。F3时,APRI-W在拔节期、大喇叭口期分别提高12.6%和20.0%;APRI-D在拔节期、大喇叭口期及灌浆期分别提高6.7%、15.6%和0.4%;3个时期FPRI-W均低于 CI处理,而 FPRI-D平均提高了 139.9%。APRI处理,F1在拔节期、F2在拔节期及大喇叭口期干、湿两区转化酶活性差异显著,3个时期F3干、湿区差异均不显著;FPRI处理,3种有机无机氮比例3个时期转化酶活性均是干燥区大于湿润区且差异均显著(表3)。
表3还看出,3种灌溉方式下,CI处理,与F1相比,拔节期灌浆期F2、F3转化酶平均分别提高了26.8%和 36.6%。APRI处理,与 F1干、湿区相比,F2、F3干、湿区灌浆期转化酶活性低于F1干、湿区,拔节期和大喇叭口期则分别平均提高了24.8%、17.3%和 28.1%、38.8%。FPRI处理,与 F1干、湿区相比,F2、F3干、湿区 3个时期分别平均提高了101.2%、35.9%和 113.9%、99.3%。
3 讨论和结论
据报道,土壤干燥磷酸酶活性较低,在一定范围内随着土壤含水量的增加脲酶有增强的趋势[14];亦有研究认为,土壤过氧化氢酶、脲酶和酸性磷酸酶随着供水水平降低显著下降[15]。本试验表明,在相同施肥条件下,F1时,拔节期过氧化氢酶活性最大值出现在CI,此时土壤含水量最大,而大喇叭口期和灌浆期过氧化氢酶活性最大值出现在APRI-W和CI,而这两个时期土壤含水量分别以CI和APRI-W最大(图1),F2、F3时亦出现相似规律。除土壤转化酶的最高值出现在土壤含水量相对较低的PRI-D,FPRI-W由于长时间灌水,转化酶活性逐渐下降。3个时期脲酶和磷酸酶与过氧化氢酶活性呈相似规律。由此可知,过氧化氢酶、脲酶和磷酸酶的最高值均出现土壤含水量较高的PRI-W与CI区域,说明土壤含水量高低影响土壤酶活性,但对不同土壤酶活性的影响有所不同。
与CI处理相比,APRI不仅显著节约灌水量(约15%),并使根区维持较高的含水量。由于这种干湿交替循环模式使土壤微生物数量有所提高,避免由于过度干燥(FPRI-D)或缺氧(FPRI-W或CI)影响微生物的繁殖和代谢[4,16]。同时,APRI处理下微生物的增加能保证较高的土壤酶活性,且在3个时期和有机无机氮比例处理下,其干燥区和湿润区土壤酶活性差异并不显著。FPRI-D由于水分胁迫造成不利于土壤微生物生长的环境从而降低微生物数量,因此除转化酶外,其它土壤酶的活性均降低。
植物根系分泌物是土壤酶的重要来源。Gramss等[17]的研究表明,将近90%的土壤酶活性可能是通过植物根系分泌物提供的。植物生长旺盛时对养分需要较多,根系代谢旺盛,根系分泌物增多,微生物、酶代谢活动增强,活性上升[18-19]。本试验条件下,3次采集的样本中,土壤过氧化氢酶、脲酶、转化酶都在玉米生长旺盛的大喇叭口期或灌浆期出现最大值。
增施有机肥能提高土壤酶活性[20],尿素与有机肥配合的处理,土壤酶活性有较大幅度的增加[21-23]。本研究表明,土壤过氧化氢酶、脲酶及转化酶活性均随着有机氮比例的增加而提高;低磷胁迫促进植物根系分泌磷酸酶是植物适应低磷胁迫的机理之一[24],但也有研究表明,当有机肥施用超过某临界用量时也会抑制碱性磷酸酶的活性[25]。本研究看出,土壤酸性磷酸酶在F2处理时达到最大,原因可能是施用较多的有机肥,土壤有效磷增加,从而抑制玉米根系分泌磷酸酶。
综上所述,本试验条件下,土壤过氧化氢酶、脲酶和酸性磷酸酶活性的最大值均出现在CI或PRIW区域;但转化酶活性的最高值却出现在土壤含水量较低的PRI-D区域;土壤含水量大小会影响土壤酶活性,但对不同土壤酶活性的影响有所不同。与CI、FPRI相比 ,F1、F2、F3 时APRI在 3 个时期均能保证较高土壤酶活性且干、湿两区域差异不显著。与单施无机氮相比,土壤过氧化氢酶、脲酶及转化酶活性随着有机氮比例的增加而提高,酸性磷酸酶活性则在F2时达到最大。
[1] 梁宗锁,康绍忠,张建华,高俊凤.控制性分根区交替灌水对作物水分利用效率的影响及节水效应[J].中国农业科学,1998,31(5):88-90.Liang Z S,Kang S Z,Zhang J H,Gao J F.Effect on water use efficiency and water-saving by controlled root-divided alternative irrigation[J].Sci.Agric.Sin.,1998,31(35):88-90.
[2] 黄春燕,李伏生,覃秋兰,等.两种施肥水平下根区局部灌溉对甜玉米水分利用的效应[J].节水灌溉,2004,(6):8-12.Huang C Y,Li F S,QinQ L et al.Effect of partial root-zone irrigation on the growth and water use of sweet corn under two fertilization level[J].Water Sav.Irri.,2004,(6):8-12.
[3] Li F S,Liang J H,Kang S Z,Zhang J H.Benefits of alternate partial root-zone irrigation on growth,waterand nitrogen use efficienciesmodified by fertilization and soil water status in maize[J].Plant Soil,2007,295:279-291.
[4] Wang J F,Kang S Z,Li F S et al.Effectsof alternate partial rootzone irrigation on soil microorganism and growth of maize[J].Plant Soil,2008,302:45-52.
[5] 周礼恺.土壤酶的活性[J].土壤学进展,1980,8(4):9-15.Zhou L K.Soil enzyme activities[J].Advan.Soil Sci.,1980,8(4):9-15.
[6] 关松荫,张德生,张志明.土壤酶及其研究法[M].北京:农业出版社,1986.GuanS Y,Zhang D S,Zhang Z M.Soil enzyme and its research methods[M].Beijing:Agricutural Press,1986.
[7] 张辉,李维炯,倪永珍.生物有机无机复合肥对土壤微生物活性的影响[J].农业生态环境,2004,20(1):34-40.Zhang H,Li W J,Ni Y Z.Effects of biological-organic-inorganic complex fertilizer on soil microorganism activity[J].Rur.Eco-Environ.,2004,20(1):34-40.
[8] Saha S,Prakash V,Kundu S et al.Soil enzymatic activity as affected by long term application of farmyardmanure and mineral fertilizerundera rainfed soybean-wheat system in N-W Himalaya[J].Eur.J.Soil Biol.,2008,44(3):309-315.
[9] 隋跃宇,焦晓光,张兴义,等.不同施肥制度对大豆生育期土壤微生物量的影响[J].土壤通报,2006,37(5):894-896.Sui Y Y,Jiao X G,Zhang X Y et al.Effect of different fertilizer application strategies on soil microbial biomass during soybean growth periods[J].Chin.J.Soil Sci.,2006,37(5):894-896.
[10] 罗明,文启凯,纪春燕,等.不同施肥措施对棉田土壤微生物量及其活性的影响[J].土壤,2001,(1):53-56.Luo M,Wen Q K,Ji C Y et al.Influence of different fertilization measures onmicrobial biomass and activities in cotton soil[J].Soils,2001,(1):53-56.
[11] 何炎森,李瑞美.有机无机肥配施对甘蔗产量及土壤酶活性的影[J].中国糖料,2004,(4):36-38.He Y S,Li RM.Effect of the organo-inorgano-mixed fertilizerapplication on sugarcane yield and soil enzymatic activity[J].SugarCrops China,2004,(4):36-38.
[12] 吕卫光,黄启为,沈其荣,等.不同来源有机肥及有机肥与无机肥混施对西瓜生长期土壤酶活性的影响[J].南京农业大学学报,2005,28(4):68-71.Lü W G,Huang Q W,ShenQ R et al.The effect of organic fertilizer and organic-inorganic fertilizer application on soil enzymes activities during water melon growing period[J].J.Nanjing Agric.Univ.,2005,28(4):68-71.
[13] 周礼恺.土壤酶学[M].北京:科学出版社,1987.Zhou L K.Soil enzymology[M].Beijing:Science Press,1987.
[14] 倪治华,马国瑞.有机无机生物活性肥料对蔬菜作物生长及土壤生物活性的影响[J].土壤通报,2002,33(3):212-215.Ni Z H,Ma G R.Effect of bio-activated organo-inorgano-mixed fertilizer on growth of cabbage and soil biological activity[J].Chin.J.Sci.,2002,33(3):212-215.
[15] 柴强,黄高宝,黄鹏.供水及间甲酚对小麦间作蚕豆土壤微生物多样性和酶活性的影响[J].应用生态学报,2006,17(9):1624-1628.Chai Q,Huang G B,Huang P.Effects of water supply and 3-methylphenolon soil microbial diversity and enzyme activity in wheat field intercropped with horse bean[J].Chin.J.Appl.Ecol.,2006,17(9):1624-1628.
[16] 余江敏,李伏生,韦彩会,等.根区局部灌溉对有机无机肥配施土壤微生物和玉米水分利用的影响[J].干旱地区农业研究,2008,6(26):63-69.Yu JM,Li F S,Wei C H et al.Effect of partial root-zone irrigation on soil microorganism and maize water use under combined application of organic and inorganic fertilizers[J].Agric.Res.Arid Areas,2008,26(6):63-69.
[17] Gramss G,Voigt K D,Kirsche B.Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material[J].Chemosphere,1999,38:1481-1494.
[18] 赵兰坡,姜岩.施用有机物料对土壤酶活性的影响[J].吉林农业大学学报,1987,9(4):43-50.Zhao L P,Jiang Y.Effects of application organic material on soil enzyme activities[J].J.Jilin Agric.Univ.,1987,9(4):23-28.
[19] 杨丽娟,李天来,付时丰,须晖.施用有机肥和无机肥对菜田土壤酶动态特性的影响[J].土壤通报,2005,36(2):223-226.Yang L J,Li T L,Fu S F,Xu H.Effect of manure and chemical fertilizer on the dynamics of soil enzymatic activities in vegetable soil[J].Chin..Sci.,2005,36(2):223-226.
[20] Marcote I,Hernández T,García C,Polo A.Influence of one or two successive annual applications of organic fertilizers on the enzyme activities of a soil under barley cultivation[J].Biol.Techn.,2001,79:147-154.
[21] 任祖淦,陈玉水,唐福钦,等.有机无机肥料配施对土壤微生物和酶活性的影响[J].植物营养与肥料学报,1996,2(3):280-285.Ren Z G,Chen Y S,Tang F Q et al.Effect of inorganic fertilizer combined with organic manure on the microflora and enzyme activities in paddy soil[J].Plant Nutr.Fert.Sci.,1996,2(3):280-285.
[22] 李娟,赵秉强,李秀英,Hwant Bing So.长期有机无机肥料配施对土壤微生物学特性及土壤肥力的影响[J].中国农业科学,2008,41(1):144-152.Li J,Zhao B Q,Li X Y,Hwant Bing So.Effects of long-term combined application of organic and mineral fertilizers on soil microbiological properties and soil fertility[J].Sci.Agric.Sin.,2008,41(1):144-152.
[23] 袁玲,杨邦俊,郑兰军,等.长期施肥对土壤酶活性和氮磷养分的影响[J].植物营养与肥料学报,1997,3(4):300-306.Yuan L,Yang B J,Zheng L J et al.Effects of long-term fertilization on enzymatic activities and transformation of nitrogen and phosphorus in soil[J].Plant Nutr.Fert.Sci.,1997,3(4):300-306.
[24] Vance C P,Uhde-Stone C,Allan D L.Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource[J].New Physiol.,2003,157:423-447.
[25] 张建林,陆欣,王申贵.有机物料配比施用对土壤碱性磷酸酶活性的影响[J].土壤通报,2001,32(2):75-79.Zhang J L,Lu X,Wang S G.Effect of combined organic materials application on soil alkaline phosphatase activity[J].Chin.J.Soil Sci.,2001,32(2):75-79.

