光谱法研究6-糠氨基嘌呤与牛血清白蛋白的相互作用
董丽红,吴 霞
(1.淮安生物工程高等职业学校,江苏淮安 223200;2.山东大学化学与化工学院,山东济南 250100)
光谱法研究6-糠氨基嘌呤与牛血清白蛋白的相互作用
董丽红1,吴 霞2
(1.淮安生物工程高等职业学校,江苏淮安 223200;2.山东大学化学与化工学院,山东济南 250100)
利用荧光光谱法、紫外光谱法、荧光寿命和圆二色光谱法等方法研究了6-糠氨基嘌呤(KT)与牛血清白蛋白(BSA)之间相互作用机理.结果表明,KT可以显著猝灭BSA的内源荧光,其猝灭机制为静态猝灭,猝灭常数 Ksv在288 K和303 K时分别为1.45×104和1.42×104L/mol,Stern-Volmer曲线是两段相交于 cKT=8.0×10-5mol/L的回归曲线,说明 KT与BSA之间存在两类结合位点.数据处理及热力学参数计算表明:低浓度 KT-BSA(cKT<8.0×10-5mol/L)的结合主要是疏水作用,结合位点数约为1;较高浓度 KT(cKT>8.0×10-5mol/L)主要以氢键、范德华力与BSA结合,结合位点数为3.7.紫外光谱和圆二色光谱实验结果表明,KT的存在使BSA二级结构发生了改变.
6-糠氨基嘌呤;牛血清白蛋白;荧光光谱法
0 引言
细胞激动素(Kinetin,KT),学名为6-糠氨基嘌呤(6-Furfurylaminopurine),是一种高效的细胞生长刺激素,能促进细胞的分裂、分化,延缓蛋白质和叶绿素的降解.将其用于水稻、小麦、茶叶、黄瓜等作物能增加产量[1].蛋白质是人体中重要的一类生物大分子,它与生命的起源、生物的进化、细胞的结构、酶、病毒、营养均有密切关系.随着化学的不断发展,蛋白质化学尤其是有关生物大分子与小分子探针的反应已经引起诸多科学工作者的关注,小分子在生物大分子上的聚集形式及机理的探讨也已经成为生命科学、临床医学和化学研究的重要内容之一.
本文利用荧光光谱、紫外吸收光谱法研究了模拟生理条件(pH 7.40,NaCl:0.9%),KT与牛血清白蛋白(BSA)相互作用的机理,测定并计算出分子间相互作用的结合常数,确定了 KT在血清白蛋白上的结合位点与结合力类型.
1 实验部分
1.1 仪器和试剂
LS-55型荧光磷光发光光度计(美国PE公司);U-4100紫外-可见分光光度计(日本日立);JASCO J-810圆二色光谱仪(日本分光);D320-S型酸度计(中国上海);Edinburgh FLS920型荧光分光光度计(英国爱丁堡公司).
牛血清白蛋白储备液(BSA,上海润捷化学试剂有限公司):1.0×10-4g/mL;6-糠氨基嘌呤溶液(KT,惠兴生化):1.0×10-3mol/L);NaCl溶液(99.8%,南汇彭镇公社营房化工厂):9%;Tris-HCl缓冲溶液(pH 7.4,上海浩然生物技术有限公司):0.05mol/L.试剂均为分析纯,实验用水为三次蒸馏水.
1.2 实验方法
在10mL比色管中依次加入0.5mL 9%NaCl溶液,0.5mL 0.05mol/LTris-HCl缓冲溶液,0.5mL 1.0×10-4g/mLBSA及一定体积的 KT溶液,用蒸馏水稀释至5mL,振荡摇匀,用1 cm石英比色池进行测定.
荧光光谱:以280 nm为激发波长,在荧光分光光度计上扫描300~420 nm波长范围内的发射光谱,记录347 nm处BSA的荧光强度.激发和发射狭缝均为10 nm,波长扫描速度为500 nm/min.
同步荧光光谱:分别固定发射和激发波长的波长差Δλ=20 nm和Δλ=60 nm,在240~340 nm波长范围内进行同步扫描,得到同步荧光光谱.激发狭缝为10 nm,发射狭缝为15 nm,波长扫描速度为500 nm/min.
2 结果与讨论
2.1 KT对BSA的荧光猝灭作用和猝灭类型
2.1.1 KT对BSA的荧光猝灭作用
固定BSA浓度,以280 nm为激发波长,扫描不同浓度KT存在下体系在300~420 nm波长范围内的荧光光谱(NaCl:0.9%;Tris-HCl buffer:0.005 mol/L,pH 7.4,cBSA=1.0×10-5g/mL;cKT=0,1.0,2.5,4.0,5.5,7.0,8.5(×10-5)mol/L),如图1所示.由图可见,BSA在347 nm处有一强特征荧光峰,随着 KT浓度的增加,BSA的荧光强度有规律的降低,峰形基本不变,说明KT与BSA之间存在相互作用.
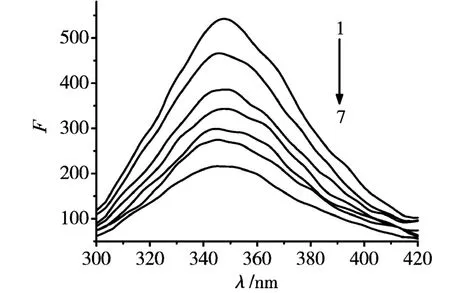
图1 KT对BSA的荧光猝灭光谱
若将猝灭剂对荧光体荧光的猝灭归因于分子碰撞引起的动态猝灭,应符合Stern-Volmer方程:

以 F0/F对[Q]绘制体系的Stern-Volmer图,根据式(1)进行线性回归,通过直线斜率可得猝灭常数Ksv.当荧光猝灭体系满足条件:无论是动态还是静态猝灭,必须是一个单一的过程;对于静态猝灭,猝灭剂与荧光分子应形成1∶1的复合物[2,3].此时,由 F0/F对[Q]作图才会存在单一线性关系.
实验绘制了不同温度下KT对BSA荧光猝灭体系的Stern-Volmer图(cBSA=1.0×10-5g/mL;cKT=0,1.0,2.5,4.0,5.5,7.0,8.0,9.0,10,11,12和13(×10-5)mol/L),如图2.在所研究的浓度范围内进行线性回归处理.从图中可看出,KT浓度在1.0×10-5mol/L~1.30×10-4mol/L范围内,F0/F与 KT浓度并不是一条线性关系,而是两段相交于 cKT=8.0×10-5mol/L的回归曲线,即随着 KT的浓度增加,曲线存在两部分线性.这表明高浓度KT猝灭BSA内在荧光的过程不同于低浓度.

表1 不同温度下KT对BSA的猝灭常数和双分子猝灭速率常数
我们认为低浓度KT与BSA可能存在一个结合位点而高浓度KT与BSA可能存在多个结合位点.KT浓度较低时,即 cKT<8.0×10-5mol/L,用Stern-Volmer方程计算不同温度的猝灭常数.另外由式(1)知道 Ksv=kqτ0,由于生物大分子的荧光寿命约为10-8s,故可进而求得双分子猝灭速率常数 Kq(表1).从表1可以看出,随着温度的升高,猝灭常数减小;各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数约为1010L/(mol·s)数量级,由表1可知,KT对BSA猝灭过程的速率常数 Kq远远大于此值,因此,初步判断 KT浓度较低时,即 cKT<8.0×10-5mol/L时,该荧光猝灭为静态猝灭.KT浓度较高,即 cKT>8.0×10-5mol/L时,若存在多结合位点,则用Stern-Volmer方程计算的猝灭灭常数是不准确的[4].

图3 不同浓度KT对BSA荧光猝灭的对数曲线
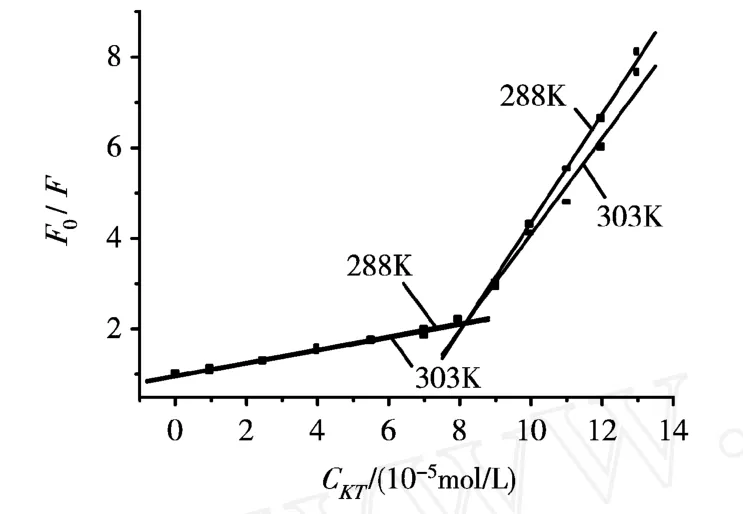
图2 KT与BSA作用的Stern-Volmer图
2.1.2 体系的荧光寿命
荧光寿命的测定是区分静态猝灭与动态猝灭最准确的方法.实验中利用单光子记数法测定了不同浓度 KT加入时BSA的荧光寿命.BSA本身的荧光寿命为6.98 ns,当 KT浓度为2.0×10-5mol/L、1.0×10-4mol/L时,BSA的荧光寿命分别为6.68 ns和6.82 ns.结果表明,KT的加入对BSA的荧光寿命影响不大,说明无论是高浓度还是低浓度的KT对BSA的荧光猝灭都以静态猝灭为主.因此,KT在高、低浓度时Stern-Volmer出现两条线性曲线可能归因于 KT在低浓度下与BSA主要为强亲和作用,而 KT浓度增大后,则存在多种亲和作用[5-7].
2.2 结合常数和结合位点
KT与BSA作用的结合常数和结合位点可用以下公式求算[8]:

由图2实验数据,以lg((F0-F)/F)对lg cKT绘图,可得到线性回归曲线(图3).由直线的斜率和截距可得不同条件下KT与BSA相互作用的结合常数 K和结合位点,见表2.

表2 不同温度和不同浓度条件下KT与BSA作用的结合常数和结合位点
文献[9-11]认为有些小分子配体与蛋白质的作用,结合部位的变化与配体的浓度有关,在配体浓度低时,与强结合力的部位发生作用,当配体浓度增加时,配体则进入低结合力的部位.由表2我们推测在低浓度时,KT以单一的结合位点进入到BSA结合力较强的部位;高浓度时,KT又可结合到其它低结合力和低选择性的位点,导致结合位点数增加.
2.3 KT与BSA作用力的确定
由实验数据,我们计算了不同浓度KT与BSA作用的热力学常数,并根据结合力与热力学参数的关系得出KT与BSA作用结合力类型(表3).
由表3并结合以上实验我们认为,低浓度KT(cKT<8.0×10-5mol/L)主要是靠疏水作用以单一的结合位点与BSA结合力较强的部位结合;由于KT分子结构中呋喃环上氧原子的存在,较高浓度KT(cKT>8.0×10-5mol/L)还可主要以氢键、范德华力为主结合到其它低亲和力的位点,使得结合位点数增大.
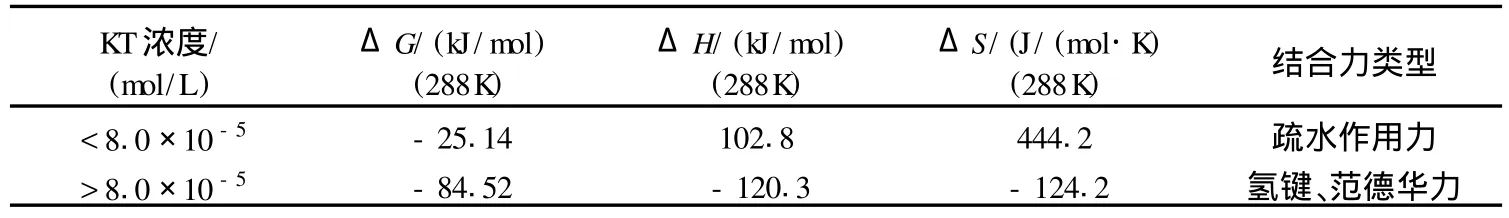
表3 不同浓度KT与BSA作用的热力学常数及结合力类型
2.4 结合位置
采用固定波长差进行同步扫描时能将蛋白质色氨酸和酪氨酸残基的荧光区分开,可得到荧光基团附近微环境的变化信息,并可以判断蛋白质构象的变化.
有关研究表明BSA的空间结构由三个结构域组成,每一个结构域由两个亚结构域以槽口相对的方式形成圆桶状结构,几乎所有疏水性氨基酸都包埋在圆桶内部,构成三个疏水腔,而在BSA分子表面存在着较大的疏水裂隙与这些疏水腔连通.BSA的序列分析表明BSA分子中有134和212两个色氨酸残基分别位于IB域和IIA域两个不同的空间结构域中,由于BSA分子表面较大的疏水裂隙的存在,134位色氨酸残基位于BSA分子结构的外层[12].
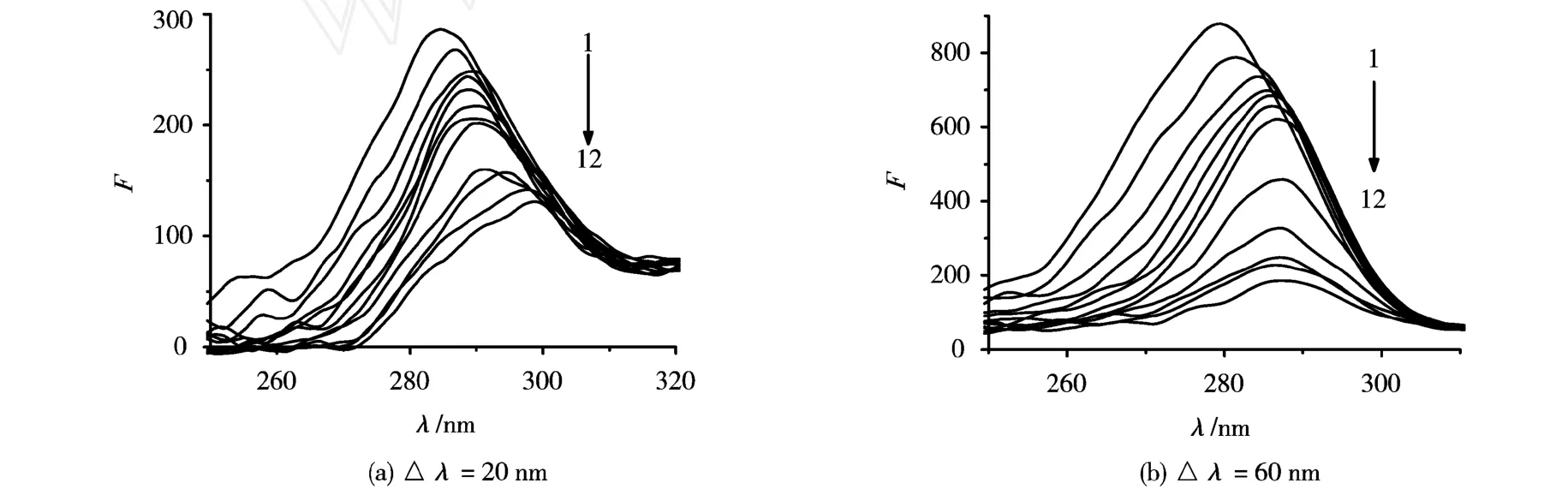
图4 KT对BSA同步荧光光谱的影响
由图4可以看出,在低浓度KT存在时,无论Δλ=20 nm还是Δλ=60 nm,随着KT浓度的增加,色氨酸和酪氨酸残基的最大波长均有红移,而且强度降低,其中色氨酸残基的荧光强度降低更大,说明6-BA主要是与色氨酸残基结合.由于低浓度 KT(cKT<8.0×10-5mol/L)主要是通过疏水作用与BSA以单一的结合位点结合,推测此条件下KT是与BSA的212位色氨酸残基结合,使BSA内部的疏水结构有所瓦解,肽链的伸展程度增加,残基所处微环境极性增强,疏水性降低,另外由于色氨酸残基和酪氨酸残基之间的能量转移因而使酪氨酸残基的荧光强度也有所降低.当KT浓度较高时对色氨酸残基最大波长无明显影响,而酪氨酸残基的波长仍有明显红移,而且二者荧光强度进一步降低.推测当BSA的212位色氨酸残基与KT的结合达到饱和以后,由于KT分子结构中呋喃环上氧原子的存在,较高浓度 KT(cKT>8.0×10-5mol/L)还可主要以氢键、范德华力为主结合到BSA的134位色氨酸残基及酪氨酸残基等其它低亲和力的位点,使得结合位点数增大.由于134位色氨酸残基位于BSA分子结构的外层,因此 KT与其结合对它所处微环境极性影响较小,故而对色氨酸残基最大波长不再有明显影响,但对酪氨酸残基的波长仍有一定影响.
2.5 BSA的构象变化
2.5.1 KT对BSA的紫外吸收的影响
蛋白质在远紫外区域的吸收,主要是肽键-CONH-所导致的.BSA在200 nm附近的吸收峰能够反映蛋白质骨架结构的改变,BSA与 KT反应前后的紫外可见光谱图(cBSA=1.0×10-5g/mL;cKT=0,1.0,2.0,8.0,9.0(×10-5)mol/L).图5显示,BSA溶液中加入KT后,BSA 192 nm处的吸收峰随着KT浓度的增大红移至196 nm处,吸收强度减小.吸收峰红移、吸收强度减小说明KT的加入使BSA骨架结构周围的微环境极性发生了改变,并导致BSA的构象改变,α-螺旋含量升高,发生了去折叠过程.
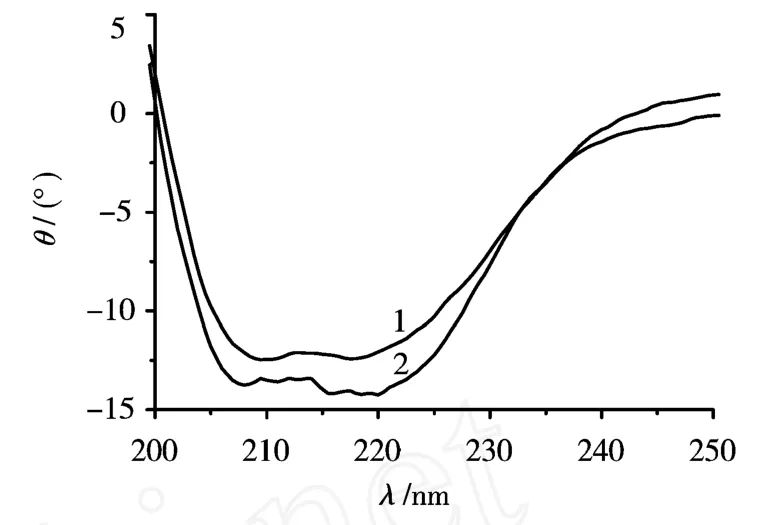
图6 KT-BSA的圆二色光谱图
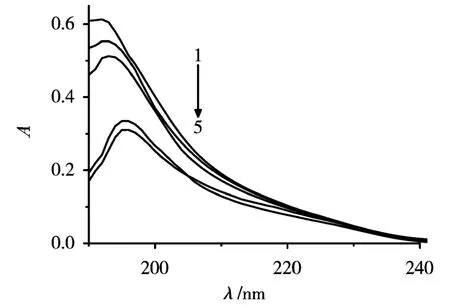
图5 KT-BSA的吸收光谱图
2.5.2 圆二色光谱
通过远紫外圆二色光谱研究了KT诱导的BSA构象的变化并得到相应谱图(cBSA=2.0×10-5g/mL;cKT=6.0×10-5mol/L.图中:1表示BSA,2表示KT-BSA).由图6可看出,KT的加入使BSA在220 nm和209 nm处的椭圆率发生变化,数据处理结果表明BSA分子中α-螺旋含量由32.6%增加到33.4%,同时,β-折叠的含量由36.9%降为31.9%.
3 结论
实验在模拟生理条件下,研究了KT与BSA作用的性质(包括荧光猝灭机理、结合常数、结合位点数、作用力类型和蛋白质二级结构的变化).实验结果表明KT与BSA的结合存在两类结合位点,这两类结合位点都是以静态的方式猝灭BSA的内在荧光.低浓度KT-蛋白(cKT<8.0×10-5mol/L)的结合主要是靠疏水作用,以单一的结合位点强烈地与BSA的212位色氨酸残基结合;较高浓度 KT(cKT>8.0×10-5mol/L)还可主要以氢键、范德华力为主结合到其它低亲和力的位点,使得结合位点数增大.紫外光谱、同步荧光光谱、圆二色光谱等研究表明,KT的加入使BSA骨架结构周围环境的极性发生了变化,导致BSA构象发生了改变.
[1] 周守祥.植物生长调节剂实用技术[M].北京:中国文史出版社,1990.
[2] Silva D,Cortez CM,Cunha-Bastos J,et al.Methyl Parathion interactionwith human and bovine serum albumin[J].Toxicol Lett,2004,147(1):53-61.
[3] Lakowicz J R.Principlesof Fluorescence Spectroscopy[M].New York:Plenum Press,1983.
[4] 陈国珍.荧光分析法[M].北京:科学出版社,2006.
[5] Lakowicz J R.Principlesof Fluorescence spectroscopy[M].New York:Kluwer Academ Plenum Publisher,1999.
[6] Dwight SJ,Gaylord B S,Hong JW,et al.Perturbation of Fluorescence by Nonspeicfic Interactionsbetween Anionic Poly(phenylenevinylene)s and Protein:Implications for Biosensor[J].JAm Chem Soc,2004,126(51):16850-16859.
[7] Wang J,Wang D,Miller E K,et al.Photoluminescence of Water-Soluble Conjugated Polymers:Origin of Enhanced Quenching by Charge Transfer[J].Macromolecules,2000,33(14):5153-5158.
[8] 张勇,张贵珠,王月梅,等.光谱法研究丝裂霉素、血清白蛋白以及金属离子间的相互作用 [J].分析科学学报,2000,16(6):445-448.
[9] Bertucci C,Domenici E.Reversible and covalent bindingof drugs to human serum albumin:methodological approachesand Physiological relevance[J].CurrMed Chem,2002,9(15):1463-1481.
[10] Kragh-Hnasen U.Structure and ligand binding propertiesof human serum albumin[J].Dan Med Bull,1990,37(1):57-84.
[11] Kamisara K,Listowsky I,Betheil J,et al.Competitive binding of bilirubin,sulfobromophthalein,indocyanine green and other organic anions to human and bovine serum albumin[J].Biochim Biophys Acta,1974,365(1):169-180.
[12] Eftink M R,Zajicek J,Ghiron CA.A hydrophobic quencher of protein fluorescence:2,2,2-trichloroethanol[J].Biochim Biophys Acta,1977,491(2):473-481.
Abstract:The interactionmechanism of Kinetin(KT)with BSA was studied by themethodsof fluorescence,fluorescence lifetime,UV absorption and CD spectrometries.KT could strongly quench the intrinsic fluorescence of BSA by static quenching.The quenching constantsof KTwith BSA at two temperatures(288K and 303K)wereobtained as 1.45×104and 1.42×104L/mol.The Stern Volmer curve had an intersection at cKT=8.0×10-5mol/L,which indicated that KT bound to different binding sites on BSA.The analytical results of fluorescence data showed when cKT<8.0×10-5mol/L,the numberof binding siteswas near 1,andwhen cKT>8.0×10-5mol/L,the numberof binding siteswas approximately 3.7.The thermodynamic parameterswere calculated by Van’t Hoff equation.The enthalpy change enthalpy change(Δ H)and entropy change(ΔS)were calculated at two concentration of KT.The results suggested that the hydrophobic interaction might play a main role in the interaction of KT(cKT<8.0×10-5mol/L)with the BSA,while cKT>8.0×10-5mol/L the hydrogen bonding and Vander Waals forces becamemajor.The investigations of the UV/Vis and CD spectra of the system showed that the secondary structure of BSA was changed in presence of KT.
Key words:kinetin;sodium dodecyl sulfonate;fluorescence
[责任编辑:蒋海龙]
Studies on the Interaction of Kinetin with Sodium Dodecyl Sulfonate by SpectroPhotometry
DONGLi-Hong1,WU Xia2
(1.Huaian Higher Vocational School of Biological Engineerin,Huain Jiangsu 223200,China)
(2.School of Chemistry and Chemical Engineering,Shandong University,Jinan Shandong 250100,China)
O657.3
A
1671-6876(2010)06-0501-06
2010-06-29
董丽红(1973-),女,讲师,硕士,主要从事分析化学及教学研究.

