酶-超声波辅助提取蓝莓果渣中花青素的工艺研究
赵尔丰,高 畅,高 欣,程大海
(哈尔滨市第三中学,哈尔滨 150001)
蓝莓(Vaccinium vitisidaea)为杜鹃花科(Ericaceae)越橘属(Vaccinium.spp)多年生落叶或常绿灌木。蓝莓原产北美洲,是地球上少有的真正蓝色食物之一。蓝莓果实集营养保健于一身,果皮中富含的活性物质—花青素,具有很强的抗氧化、抗肿瘤、增强心血管功能等作用[1-3]。此外,蓝莓花青素对改善人的弱视具有专一的功效[4-5]。蓝莓适于鲜食,更适于加工成果汁饮料、果酒饮品等[4-6]。据报道只有13%~23%的花青素在于巴氏杀菌的蓝莓果汁中,而大约42%存留在果渣中[7];我国的蓝莓商品化主要为初级加工产品,生产过程中产生大量的废弃果渣[8]。因此,为了更加充分利用蓝莓花青素资源,有必要对蓝莓果渣中花青素的提取工艺进行研究,从而获得一种高效、节能、安全的蓝莓果渣中花青素提取方法。
目前,蓝莓中花青素的提取方法有水提取、有机溶剂提取、超临界流体提取和酶辅助提取等方法。水提法成本低,但提取率差,原料利用率不高,资源浪费严重;有机溶剂易对环境及操作者产生危害;超临界流体法虽提取率高,但因设备昂贵,普及受限制[9-10]。已经报道的酶辅助提取方法较多,但多在强酸性条件下实施,对于蓝莓资源深入应用有极大的制约。为此,本研究以超声波为动力,利用酶解方法提取蓝莓果渣中花青素。本法操作简便,提取效率高,为蓝莓资源充分利用提供理论依据。
1 材料与方法
1.1 原料
蓝莓购自大兴安岭地区加格达奇市。
1.2 仪器与试剂
多功能匀浆机,SHIMADZU UV-2550型紫外可见分光光度仪,电子天平,DK-9821电子恒温水浴锅,SHB-Ⅲ循环水式多用真空泵,RE-52AA旋转蒸发仪水浴槽。
纤维素酶(30 U·mg-1)、果胶酶(5 U·mg-1)及中性蛋白酶(15 U·mg-1)(上海贺宝化工有限公司);95%食用酒精(哈尔滨市酿酒厂);其他试剂均为分析纯试剂。
1.3 酶-超声波辅助提取工艺参数单因素优化试验
精确称取蓝莓果渣5 g,加入水于匀浆机中匀浆2 min,将匀浆液转移到具塞三角瓶中,以超声波为动力,分别考察加入酶的不同类别(果胶酶、纤维素酶、中性蛋白酶及不同复合酶)、超声波功率(50、100、150、200和250 W)、不同温度条件(30、40、50和 60℃)、酶用量(2、5、8、10和15 mg·g-1)、培养提取时间(10、15、20、25、30和50 min)对果渣中花青素提取的影响,从而确定最优的提取条件。然后,向体系中补充加入95%的食用酒精,进一步超声波强化提取,提取液经离心、过滤后定容,测定花青素含量。
1.4 酶-超声波辅助提取工艺参数正交试验优化
上述单因素试验结果表明,采用纤维素酶-超声波辅助提取蓝莓果渣最合适,超声波最适功率为200 W,随后补充加入乙醇至40%浓度强化提取10 min,在此条件下以酶辅助提取温度(A)、酶用量(B)、料液比(C)和酶培养时间(D)为考察因素,对提取工艺采用L9(34)正交表进行正交试验研究,从而确定最佳的提取条件。
1.5 蓝莓果渣中花青素含量的测定[11]
取蓝莓果渣花青素提取液1 mL,分别加入pH 1.0和pH 4.5缓冲体系,定容至10 mL,分别于530和700 nm测定吸光度,以吸光度表示花青素的提取量,用示差法按照下述公式计算:

1.6 数据分析
每个处理重复3次,取平均值,所得数据采用DPS统计软件进行分析,用不同字母表示显著性水平。
2 结果与分析
2.1 酶种类的选择试验
以水为溶剂、料液比 1:20(g:mL)、40 ℃条件下,按照15 mg·g-1用量加入不同的酶于150 W超声波清洗器中培养提取30 min,考察酶种类对蓝莓果渣中花青素提取的影响,结果见图1。
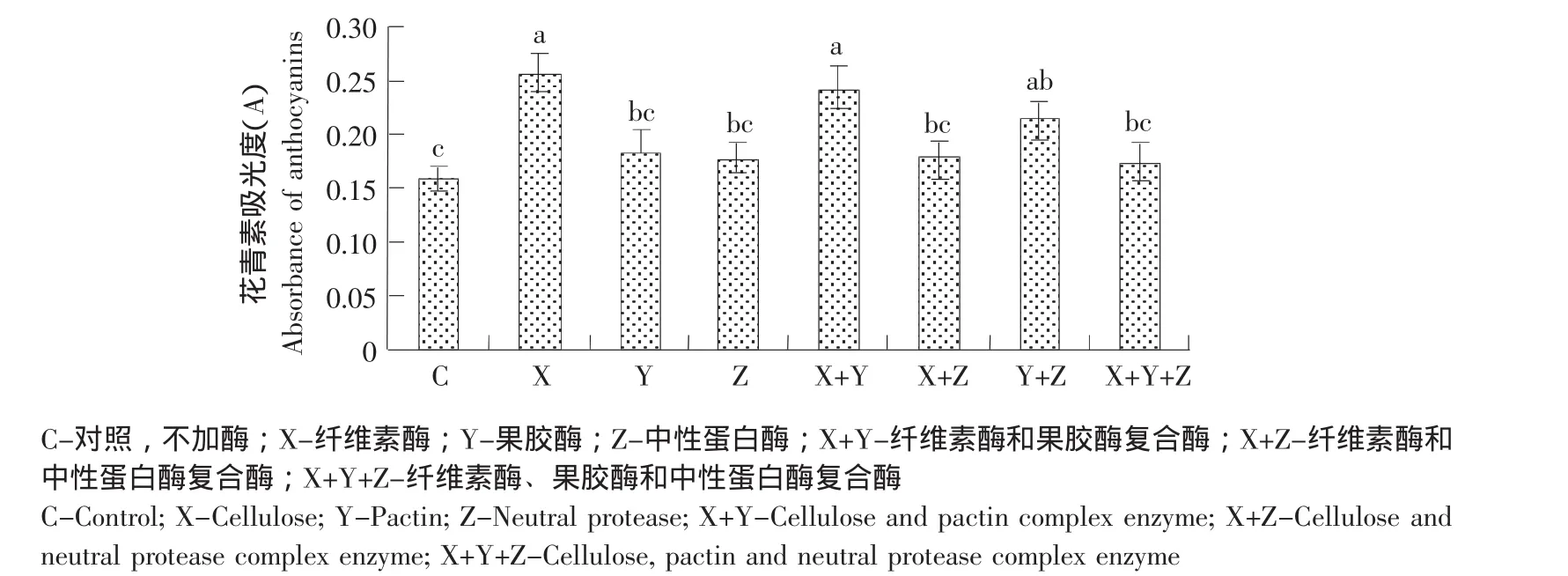
图1 纤维素酶、果胶酶、中性蛋白酶和三种酶的任意复合酶对蓝莓果渣中花青素提取的影响Fig.1 Effect of enzymatic types(cellulase,pactin,neutral protease and complex enzyme)on the extraction of anthocyanins
由图1可知,加入酶后,蓝莓果渣中花青素的提取增加。其中,纤维素酶使花青素的提取增加显著,果胶酶和中性蛋白酶作用较弱,花青素提取提高不明显,这与前人报道的酶法从蓝莓果或者蓝靛果果渣中提取花色苷所得结果相似。蓝莓果渣中大部分是纤维素组成的果皮,纤维素酶的加入可以温和地分解、破坏细胞壁,加速花青素的释放。果渣中果胶和蛋白质相对很少,使得果胶酶和中性蛋白酶的作用不明显。同时,上述三种酶的任意复合酶对花青素提取的影响均低于相同用量的纤维素酶,其中,仅纤维素酶和果胶酶的复合酶与单一使用纤维素酶的差别较小,说明果胶酶和纤维素酶之间的协同作用不明显,而蛋白酶与纤维素酶之间呈负协同。因此,选择单一的纤维素酶进行蓝莓果渣中花青素的辅助提取试验。
2.2 酶-超声波辅助培养提取功率对花青素提取量的影响
以水为溶剂、料液比 1: 20(g: mL)、40 ℃条件下,按照15 mg·g-1用量加入纤维素酶,在不同的超声波功率条件下(50、100、150、200和250 W)培养提取30 min,酶-超声波辅助培养提取功率对花青素提取量的影响,结果见图2。
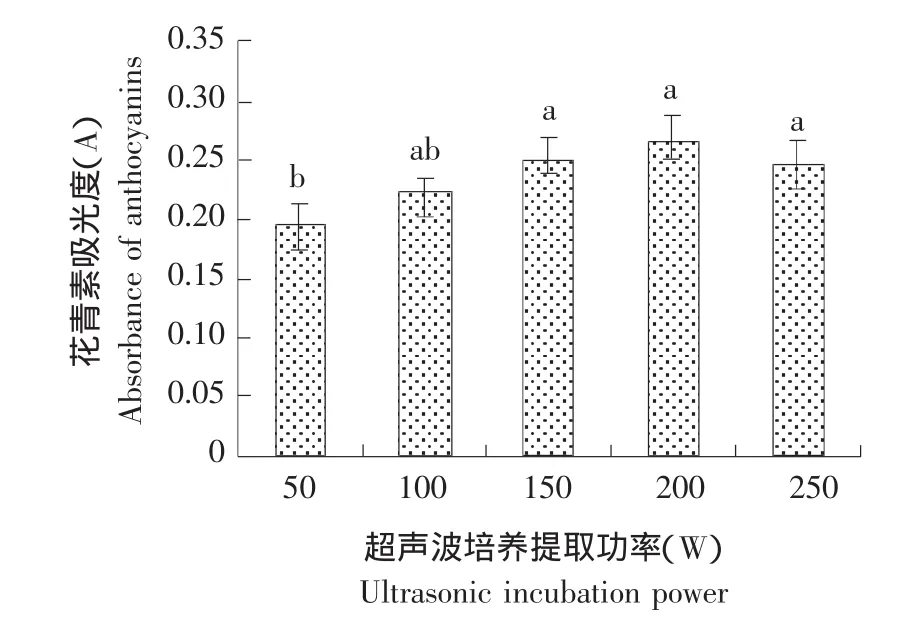
图2 酶-超声波辅助培养提取功率对花青素提取的影响Fig.2 Effect of ultrasonic incubation power on the extraction of anthocyanins
由图2可知,花青素的提取量随超声波功率的增加而增加,当超声波功率为200 W时,蓝莓果渣中的花青素提取量达到最大,继续增加功率,花青素的提取量反而减小。因为适当的超声波功率可以促进酶与底物的结合,从而增加提取量,但是过高的超声波功率可能对目标物质、酶以及酶促反应过程造成破坏,导致提取量降低。因此,在本试验中选择超声波200 W功率用于果渣中花青素的纤维素酶-超声波辅助培养提取。
2.3 酶辅助提取温度对花青素提取量的影响
在其他参数不变的条件下,考察温度对纤维素酶辅助提取蓝莓果渣中花青素提取的影响,结果如图3所示。

图3 温度对花青素提取的影响Fig.3 Effect of extraction temperature on the extraction of anthocyanins
由图3可知,花青素的提取随温度的升高而增加,当温度达到50℃时,蓝莓果渣中的花青素提取量达到最大,当温度升高至60℃时,花青素的提取量继而减小,试验结果与报道的从蓝莓果中提取花色苷所用温度一致[16-18]。因为酶促反应在最适合的温度条件下速度最快,在较低温度下,底物的分子热能较低,酶促反应速度慢,当温度过高时,酶易变性失活。因此,在本试验中选择50℃用于果渣中花青素的纤维素酶辅助提取。
2.4 酶用量对花青素提取量的影响
在以水为溶剂、料液比 1: 20(g: mL)、50 ℃、加入纤维素酶,超声功率200 W,培养提取30 min的条件下,考察纤维素酶用量对蓝莓果渣中花青素提取量的影响,结果见图4。

图4 酶用量对花青素提取的影响Fig.4 Effect of enzyme addition on the extraction of anthocyanins
由图4可知,当纤维素酶用量达到5 mg·g-1后,继续增加酶用量,花青素的提取量不再增加,因为酶作用的底物量是一定的,当底物被酶充分作用后,继续增加酶的用量不会导致花青素释放量的增加。因此,纤维素酶的加入量确定为5 mg·g-1,该用量与李颖畅等[17]提取蓝莓果中花色苷的酶用量一致,其原因是纤维素酶主要作用于果皮和果籽。
2.5 料液比对花青素提取量的影响
以水为溶剂、50℃条件下,加入5 mg·g-1纤维素酶,超声功率200 W,以不同的料液比培养提取30 min,考察料液比对蓝莓果渣中花青素提取的影响,结果见图5。

图5 料液比对花青素提取的影响Fig.5 Effect of solid to liqiud ratio on the extraction of anthocyanins
由图5可知,花青素的提取量随料液比的增加而增加,当料液比为1:10时即达到了最大值,继续增加至1:20,花青素提取量基本不变,但是当料液比达到1:25时,花青素的提取量开始减少。因为过量溶剂的使用一方面降低了酶的浓度,从而降低了酶与底物的接触;另一方面导致其他杂质的大量提取,从而降低了花青素的提取量。为了操作方便,选择料液比1:10。
2.6 纤维素酶培养提取时间的确定
以水为溶剂、料液比 1: 10(g:mL)、50 ℃条件下,按照5 mg·g-1用量加入纤维素酶,超声功率200 W培养提取不同时间,考察培养提取时间对蓝莓果渣中花青素提取的影响,结果见图6。
由图6可知,花青素的提取随着培养提取时间的增加而增加,并在20 min时即达到最大,之后基本保持不变。因为纤维素酶与底物的作用需要一定的时间,当酶促反应充分发生后,酶的效率得到充分利用,继续增加时间,花青素的提取不再增加。因此,选择20 min用于酶培养提取试验。这一结果远远优于相关报道的2~3 h[16-18],因为超声波的作用能够大大促进酶与底物的接触,从而实现高效提取。

图6 培养提取时间对花青素提取的影响Fig.6 Effect of extraction time on the extraction of anthocyanins
2.7 超声波-乙醇强化提取过程中乙醇浓度和时间的影响
为了最大量地提取蓝莓果渣中的花青素,对酶培养提取的蓝莓果渣进行进一步超声波-乙醇强化提取。在上述优化的酶-超声波辅助培养提取的条件下,对乙醇的加入方式、加入量和强化提取时间进行了优化,结果如表1所示。由表1可知,在强化提取过程中,两种乙醇的加入方式对花青素的提取没有明显影响,当体系中乙醇浓度为40%时,强化提取10 min后即可获得较大的花青素吸光值,继续增加体系中乙醇含量或者延长时间对花青素提取没有明显的影响。与已有的报道用50%乙醇[19]或80%甲醇[20]提取花青素相比,本试验采用40%乙醇所得效果更好,并且更安全。因此,为了简化操作程序,选择在酶培养提取的体系中直接补充加入乙醇,使得体系中乙醇的最终浓度为40%,在此条件下,强化提取10 min,此时,通过计算可知花青素提取物的得率为4.12%。
2.8 正交试验分析
正交试验因素水平与结果如表2所示。由正交试验结果可以看出,影响提取效果的因素排序为A>D>C>B,酶用量对花青素提取量影响最小,方差分析结果表明,5与8 mg·g-1的酶用量对花青素提取没有显著影响,温度、提取时间和料液比对花青素提取影响较大,因此,取酶用量8 mg·g-1,温度50℃,料液比1:10,提取时间20 min。

表1 乙醇的加入方式、加入量和强化提取时间对花青素提取的影响Table1 Effect of ethanol addition methods,amounts and extraction time on the extraction of anthocyanins
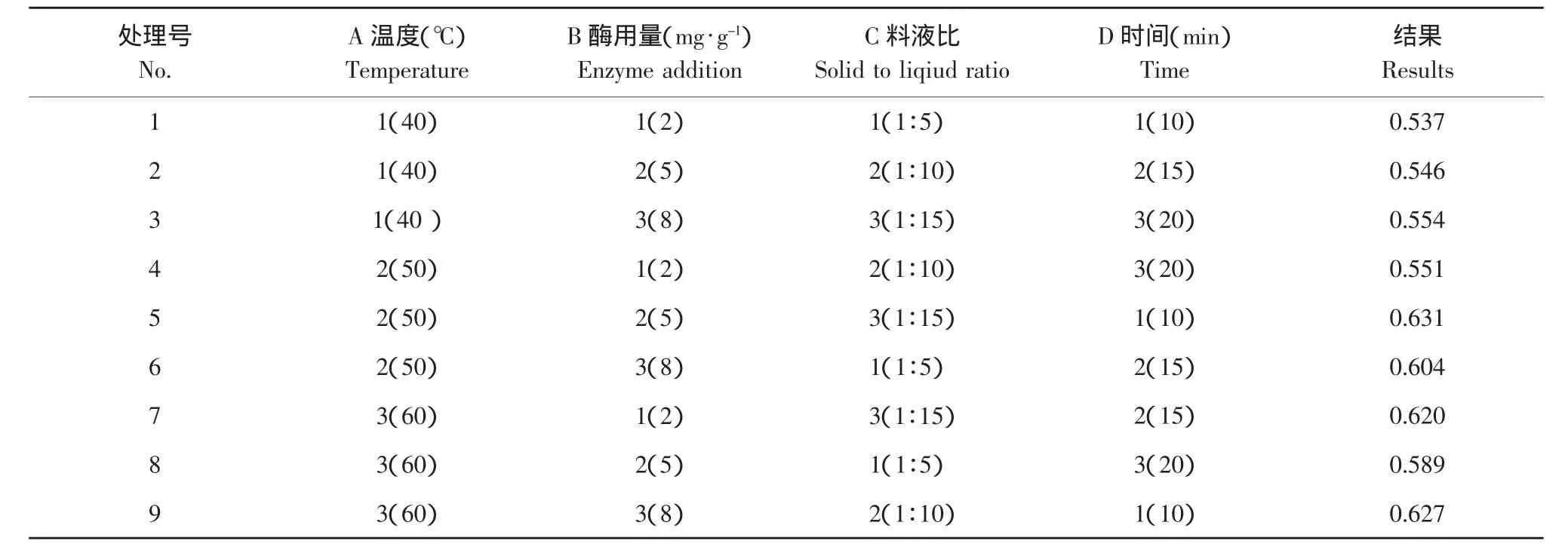
表2 正交试验因素水平Table2 Factors and levels of orthogonal test
3 结论
花青素又称花色素,是一类广泛存在于植物中的水溶性天然色素,属黄酮类化合物[13],花青素作为一种天然食用色素,具有安全、无毒、资源丰富、药理作用显著的特点,在食品、化妆、医药等方面有着巨大的应用潜力[14]。
试验结果表明,纤维素酶辅助提取花青素的效果最好,其最佳工艺条件为:温度50℃,酶用量5mg·g-1,以料液比1:10加入水培养提取20min,然后补充加入乙醇,使得体系中乙醇浓度为40%,强化提取10 min,所得蓝莓果渣中花青素的提取率为4.12%。但在使用酶-超声波辅助培养提取过程中,需要注意的是花青素的提取率并不是随着超声波功率的增加而提高。功率过高反而会造成提取率的下降。
酶-超声波辅助提取蓝莓果渣中花青素的方法是一个利用现代生物技术和物理技术进行试验的方法,具有提取率高、工艺简单、条件温和等特点,其应用前景广阔。
[1]王日为,张丽霞,高吉刚.茶叶中花青素类物质研究展望[J].茶叶科学技术,2002(4):428.
[2]莫巍.彩叶树种叶片中花青素含量的测定及动态分析[J].新疆农业科学,2007,44(S2):138-140.
[3]赵宇瑛,张汉.花青素的研究现状及发展趋势[J].安徽农业科学,2005,33(5):904-905.
[4]Cho M J,Howard L R,Prior R L,et al.Flavonoid glycosides and antioxidant capacity of various blackberry,blueberry and red grape genotypes determined by high-performance liquid chromatography/mass spectrometry[J].Journal of the Science of Food and Agriculture,2004,84:1771-1782.
[5]Tsang C,Higgins S,Duthie G G,et al.The influence of moderate red wine consumption on antioxidant status and indices of oxidative stress associated with CHD in healthy volunteers[J].British Journal of Nutrition,2005,93:233-240.
[6]Virachnee L,Mary M,George S,et al.Determination of anthocyanins in various cultivars of highbush and rabbiteye blueberries[J].Food Chemistry,2008,111:249-254.
[7]Lee J,Durst R W,Wrolstad R E.Impact of juice processing on blueberry anthocyanins and polyphenolics:Comparison of two pretreatments[J].Journal of Food Science,2002,67:1660-1667.
[8]刘庆忠,赵红军.越桔高效栽培与加工利用[M].北京:中国农业出版社,2003.
[9]吴春,张艳.纤维素酶法提取葡萄籽中原花青素的研究[J].食品科学,2006,27(10):258-260.
[10]石文娟,林松毅,刘静波,等.利用纤维素酶提取笃斯越桔花青素的研究[J].食品科学,2007,28(11):370-373.
[11]刘仁道,张猛,李新贤.草莓和蓝莓果实花青素提取及定量方法的比较[J].园艺学报,2008,35(5):655-660.
[12]Lawrence J P,Liana N.The conversion of procyanidins and prodelphinidin[J].Phytochemistry,1986,25(1):223-230.
[14]吕丽爽,曹栋.脱脂葡萄籽中低聚原花青素的提取[J].无锡轻工大学学报,2001,20(2):208-210.
[15]赵玉红,苗雨,张立钢.双酶法提取蓝靛果果渣中花色苷酶解条件的研究[J].中国食品科学,2008,8(4):75-79.
[16]王振宇,杨谦.酶法制备花色苷的研究[J].中国甜菜糖业,2004,7(4):26-29.
[17]李颖畅,孟宪军.酶法提取蓝莓果中花色苷的研究[J].食品工业科技,2008,29(4):215-218.
[18]向道丽.酶法提取越桔果渣花色苷酶解条件的研究[J].中国林副特产,2005(6):1-3.
[19]王兆雨,徐美玲,朱蓓薇.蓝莓花青素的提取工艺条件[J].大连轻工业学院学报,2007,26(3):196-198.
[20]石光,张春枝,陈莉,等.蓝莓果实中花色苷提取工艺的研究[J].食品研究与开发,2008,29(4):7-10.

