胍基化修饰结合稀土金属标记应用于蛋白质相对定量研究
林虹君,卫军营,贾 伟,张养军,钱小红,蔡 耘
(1.军事医学科学院放射与辐射医学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206;2.北京理工大学生命学院,北京 100081)
胍基化修饰结合稀土金属标记应用于蛋白质相对定量研究
林虹君1,卫军营2,贾 伟1,张养军1,钱小红1,蔡 耘1
(1.军事医学科学院放射与辐射医学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206;2.北京理工大学生命学院,北京 100081)
稀土金属元素标记技术利用双功能试剂二乙三胺五乙酸双酸酐(DTPA双酸酐)将稀土金属元素和目标肽段连接起来作为质量标签,结合基质辅助激光解吸/电离-飞行时间质谱(MALDI-TOF MS)分析实现蛋白质的相对定量研究。为进一步提高标记效率,本研究对反应体系温度、p H值、反应时间和金属标签过量倍数等进行优化,并结合胍基化修饰技术封闭蛋白质酶切肽段中的侧链ε-氨基,使标记反应只发生在末端氨基,提高标记选择性。标准蛋白质实验结果表明,所有酶切肽段胍基化反应效率均大于95%,且胍基化修饰反应对金属标记效率没有影响。对于选定的7个标准蛋白质而言,每个蛋白质都至少有3个肽段可以得到良好的标记结果。对于离子抑制效应带来的干扰,可通过标准曲线进行校正,结果表明,当两种金属离子浓度比小于6时,该效应对蛋白质相对定量没有影响。胍基化修饰结合稀土金属标记方法不仅能在肽段水平实现相对定量,而且能在蛋白质水平实现相对定量。
稀土金属标签;胍基化修饰;蛋白质定量
随着人类基因组草图的初步完成,生命科学已经跨入“蛋白质组学”时代[1]。蛋白质定量是蛋白质组学研究的核心内容之一,蛋白质定量方法包括相对定量和绝对定量:相对定量是指对不同生理病理状态下细胞、组织或体液蛋白质表达量的相对变化进行比较分析;绝对定量是测定细胞、组织或体液蛋白质组中每种蛋白质的绝对量或浓度[2]。
目前蛋白质组学的相对定量方法主要有:基于两维分离或与荧光标记结合的比较方法,如二维凝胶电泳(2DE)[3-4]和差示荧光二维电泳(DIGE)法[5];基于质谱技术的同一种肽段在不同状态下提取的离子流色谱图比较方法(非标记定量);稳定同位素标记方法,包括化学标记和代谢标记,如18O水标记[6-9]、同位素酸酐试剂标记、Isobaric tags for relative and absolute quantification(iTRAQ)[10-11]和stable isotope labeling by amino acids in cell culture(SILAC)[12]等。这些方法因存在成本太高,不能用于组织或体液中蛋白质的定量分析,不能满足低浓度、高通量要求等原因,影响了在实际样品中的应用。为了克服以上缺点,近年来发展了一种新的定量方法,通过双功能试剂DTPA双酸酐将稀土金属元素钇(Y)和铽(Tb)与肽段结合后作为质量标签[13],利用质谱检测实现对蛋白质的相对定量。该方法稳定性好、标记试剂廉价、操作简单,但存在的问题是,标记试剂DTPA双酸酐对于末端氨基和侧链氨基的标记无选择性,在蛋白质酶切的肽段中,大量含有侧链氨基的肽段将被重复标记,质谱检测中谱图复杂化,致使蛋白质的定量分析受到干扰[12]。
为了解决这一问题,本研究引入了胍基化修饰[14]对ε-氨基进行封闭,即将赖氨酸(Lys)的ε-氨基修饰为高精氨酸(homoarginine),使后续的反应只能发生在肽段的N端,并且胍基化修饰很完全。引入胍基化修饰之前,稀土金属定量方法只能对不含ε-氨基的标准肽段或酶切肽段中不含ε-氨基的标准蛋白质进行相对定量;引入胍基化修饰后,排除了ε-氨基对末端氨基的干扰,使得该定量方法的适用范围进一步扩大,能够被定量的肽段增加,丰富了同一蛋白质的定量信息,从而提高蛋白质定量的可信度。
1 实验部分
1.1 仪器与装置
4800 Proteomics Analyzer型基质辅助激光解析电离飞行时间串联质谱仪:美国应用生物系统公司产品;SC100A Speedvac Plus MODUL YOD-230型真空离心干燥机:美国 Thermo Savant公司产品;超纯水:由Millipore纯水系统制备。
1.2 主要材料与试剂
二乙三胺五乙酸双酸酐(diethylenetriamine-N,N,N’,N’,N’’-pentaacetic acid dianhydride,DTPA双酸酐):日本Dojindo公司产品;YCl3,TbCl3,三乙二胺碳酸盐(triethylammonium bicarbonate,TEAB)和还原剂三羧乙基磷(TCEP):美国Sigma公司产品;碘乙酰氨:比利时 Acros公司产品;乙腈(HPLC级):美国J.T.Baker公司产品;胰蛋白酶(trypsin,sequencing grade)和二硫苏糖醇(dithiothreithol,DTT):美国 Promega公司产品;乙酸、醋酸铵:北京化工厂产品。
肌红蛋白(myoglobin)、烯醇化酶(enolase)、胎球蛋白(fetuin)、α-牛奶酪蛋白(α-casein from bovine milk)、β-牛奶酪蛋白(β-casein from bovine milk)、甘油三磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)、细胞色素 C(cytochrome c from house heart)和标准肽段Kemptide(LRRASL G):美国Sigma公司产品。
1.3 样品溶液配制
TEAB:新购溶液为 1 mol·L-1、p H 8.5,用乙酸调至 0.05 mol·L-1、p H 7.0;醋酸铵:0.1 mol·L-1,p H 6.0;O-甲基异脲溶液:将 O-甲基异脲溶于1 mol·L-1NaOH溶液,最终浓度为1 mol·L-1,p H 11。
1.4 标记条件
将标准肽段 Kemptide(0.14 mg)和DTPA双酸酐(3.26 mg)固体加入到 TEAB溶液(320 μL)中,剧烈涡振1 min,离心样品至管底,室温放置0.5~1 h,真空离心干燥,用NH4OAc溶液重新溶解,加入 YCl3,37 ℃螯合 1~2 h,取0.6μL点靶,进行质谱分析。
1.5 实验条件
在基质辅助激光解析电离-飞行时间串联质谱仪上进行样品的质谱分析。取5μL处理好的样本溶液,与饱和的基质溶液(5 g·L-1CHCA,溶于含0.1%TFA的50%乙腈中)按照1∶9的比例混合,取0.6μL点靶,空气中挥发干燥后,在正离子模式下进行质谱分析。根据峰高的比值来评估反应进行的完全程度,从而确定标记反应的最佳条件。用标准多肽混合物进行质谱仪的外标校正。质谱数据采集使用MS-1 kV反射模式,加速电压20 kV,扫描范围 m/z 700~3 500,谱图采集累计1 500~2 000次。所有质谱图的分析都通过4800 Explorer V 2.0软件(美国应用生物系统公司)进行。
2 结果与讨论
2.1 稀土金属标记条件优化
因为不同的稀土金属具有不同的螯合常数,该螯合常数与温度、反应时间、p H和金属过量倍数有关,为了得到最佳螯合率,按照前述条件设计了以下实验,数据示于图1。
从上面的数据可以看出,优化后的最佳条件为:温度37 ℃、p H 6、反应时间2 h和金属离子浓度是肽段的5倍,由此最佳条件得到的质谱图示于图2。
从图2可以看出,在条件优化后,稀土金属Y与标准肽段LRRASL G螯合前质谱峰为1 148.00,螯合后质谱峰为1 233.92,螯合率为69%,多次重复实验表明,此比例稳定。用稀土金属 Tb重复上面的实验,螯合率为67%,且螯合率稳定。

图1 反应温度(a)、pH值(b)、反应时间(c)和金属离子与肽段摩尔比(d)对螯合效率的影响Fig.1 The effect of temperature(a),pH(b),time(c)and mole ratio of metal ion to peptides(d)on chelation rate

图2 优化条件下稀土金属与标准肽段(LRRASLG)螯合质谱图Fig.2 The MS spectrum of chelate of rare earth metal ion with peptide(LRRASLG)under the optimum condition
2.2 胍基化修饰对ε-氨基封闭
蛋白质酶切产物中大部分肽段都含有ε-氨基,由于DTPA双酸酐与氨基的结合没有选择性,这样ε-氨基就会对定量造成干扰。所以,在进行金属离子螯合之前,必须对ε-氨基进行封闭[14]。胍基化修饰的原理是:用化学试剂 O-甲基异脲修饰Lys的ε-氨基,使Lys的ε-氨基发生胍基化反应生成高精氨酸(homoarginine),质量增加42 u,而 O-甲基异脲只专一性地修饰ε-氨基,不会与N端氨基发生反应,反应原理示于图3。
胍基化反应的特点是反应完全,目的是封闭赖氨酸的ε-氨基,使后续的反应只发生在肽段的N端。优化后的胍基化反应条件为:p H 11.0,胍基化试剂浓度100 mmol·L-1,反应温度37℃,反应时间4 h。另外,由于高精氨酸的胍基(p Ka=12.48)比赖氨酸的氨基(p Ka=10.48)有更强的碱性,所以更容易结合质子带上正电荷,能提高以 K结尾肽段在MALDI源质谱中的信号强度,修饰前后的质谱图示于图4。
甘油三磷酸脱氢酶酶切肽段在胍基化修饰前,只有1 763.79和1 820.81丰度较强,而胍基化修饰后,无论高丰度峰个数和峰整体强度都有明显提高,示于图4。可见,胍基化修饰可较大幅度提高以 K结尾肽段在MALDI源质谱中的信号强度,这对后续的质谱检测很有帮助。
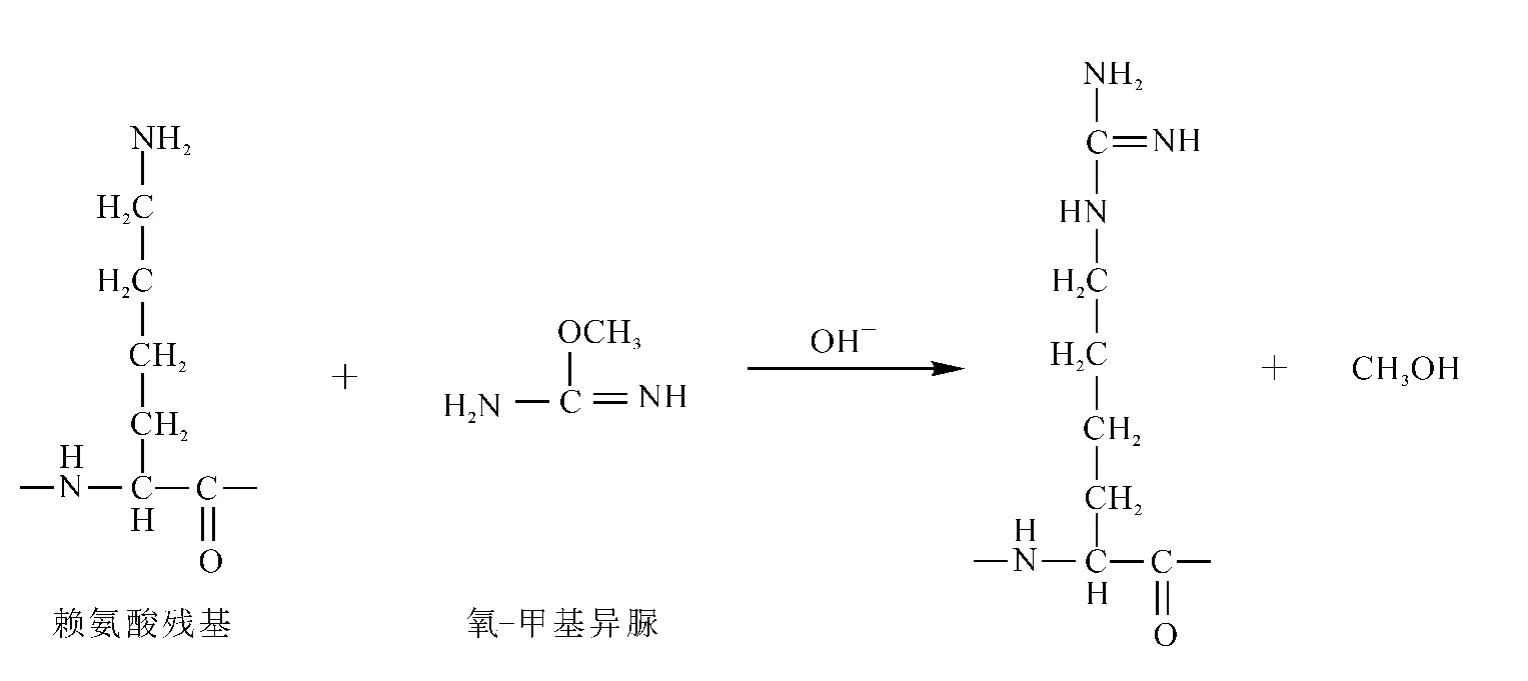
图3 胍基化反应原理图Fig.3 The reaction schematic diagram of guanidination
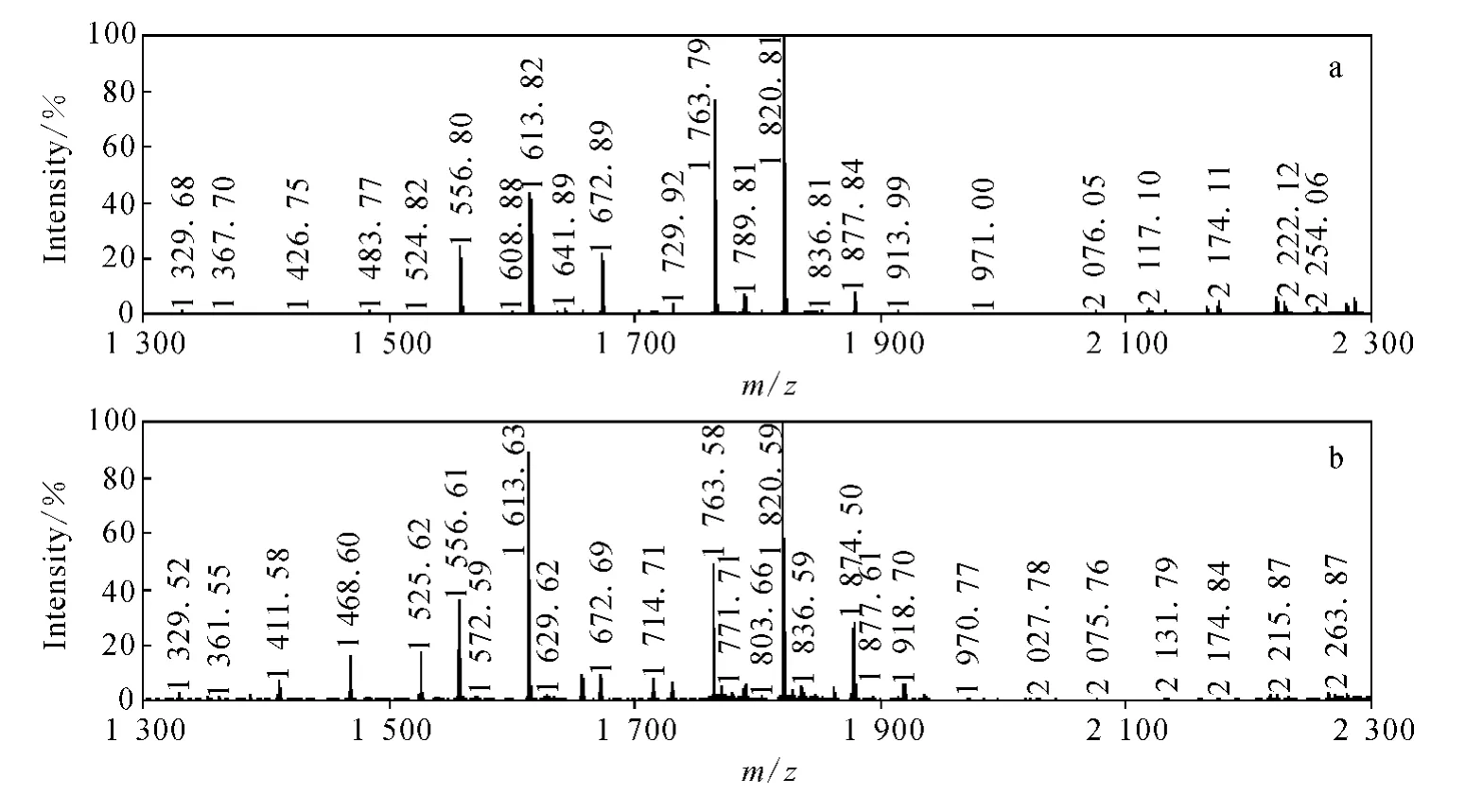
图4 甘油三磷酸脱氢酶酶切肽段胍基化修饰前(a)和修饰后(b)质谱图Fig.4 The MS spectrum of peptides from glyceraldehyde-3-phosphate dehydrogenase before guanidination(a)and after guanidination(b)
标准肌红蛋白酶切肽段胍基化修饰的结果表明,除了肽段 ALELFR和 VEADIAGHGQEVLIR因不含ε-氨基而没有发生胍基化修饰外,其余酶切肽段胍基化率都大于95%,结果列于表1。
2.3 在蛋白质相对定量中的应用
根据前面优化的条件,对肌红蛋白、烯醇化酶、胎球蛋白、α-牛奶酪蛋白、β-牛奶酪蛋白、甘油三磷酸脱氢酶和细胞色素C7个蛋白质分别与稀土金属进行螯合实验。
酶切肽段胍基化修饰后,只剩下末端氨基可以与DTPA双酸酐结合,并通过DTPA双酸酐与 Y螯合,细胞色素C酶切肽段MIFAGIK与Y螯合的质谱图示于图5。
从图5可以看出,细胞色素C酶切肽段MIFA GIK与稀土金属 Y螯合后的质谱峰为1 283.65,螯合前的质谱峰1 196.60已全部消失,螯合率达到了100%。为了验证此方法对蛋白质酶切肽段的普遍适用性,将7个蛋白质做平行实验,重复性好,每个蛋白质酶切肽段中至少有3个肽段与稀土金属的螯合率超过70%,且此比例稳定。根据此3个肽段完全可以实现该蛋白质的相对定量,数据列于表2。

表1 肌红蛋白酶切肽段胍基化修饰结果Table 1 The list of peptides from myoglobin after guanidination

图5 细胞色素C酶切肽段MIFAGIK与稀土金属Y螯合前(a)和螯合后(b)质谱图Fig.5 The MS spectrum of peptide MIFAGIKfrom cytochrome c before(a)and after(b)chelation with rare earth metal Y
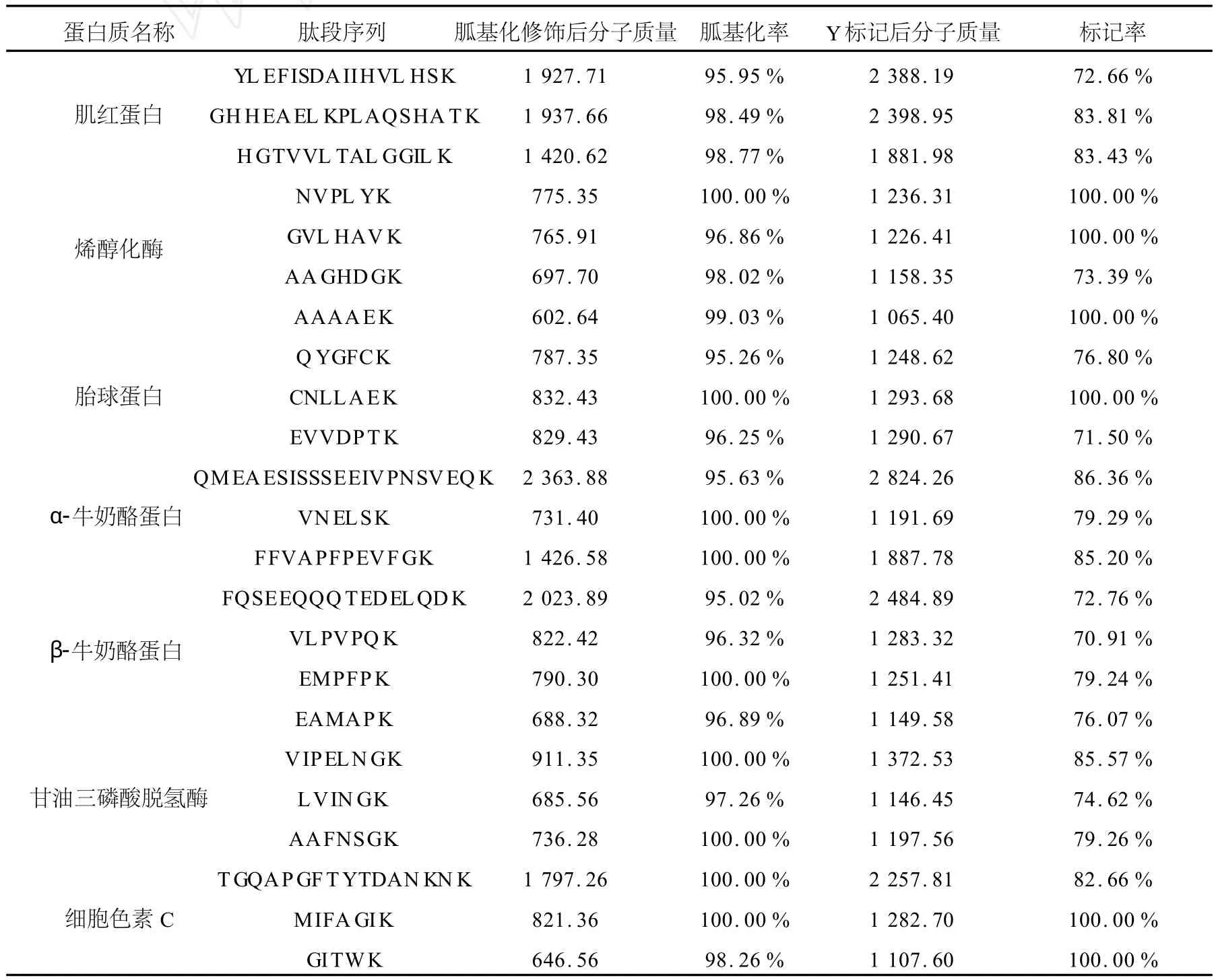
表2 7种标准蛋白质部分酶切肽段胍基化修饰及Y标记结果Table 2 The labeling results of partial peptides from seven standard proteins after guanidination and chelation with rare earth metal Y
对蛋白质进行相对定量,必须在酶切肽段中同时标记一对金属离子,通过两者的标记差异实现相对定量。稀土金属 Tb和 Y与DTPA双酸酐的稳定常数相近,并且两者都是单同位素元素,相对分子质量相差70 u[13],便于差异质谱峰的对比。另外用 Tb重复了上面 Y元素的所有实验,结果表明,胍基化率都大于96%,而且与7个肽段的标记效率较好,每个蛋白质酶切肽段中至少有3个肽段的标记率大于70%。所以,Tb可以和 Y作为一对质量标签用于蛋白质的相对定量。然而,同一溶液中有两种及两种以上金属离子对同一肽段标记时,存在金属离子的抑制现象。为了考察稀土金属 Tb和 Y的离子抑制效应,将两者按1∶1(摩尔比)加入到肌红蛋白的酶切肽段混合物中,检测到两者比例为1.49∶1。
为了验证稀土金属标记方法在蛋白质相对定量中应用的可行性,对该方法的动态范围进行考察。将肌红蛋白酶切肽段与稀土金属 Tb和Y按1∶10、1∶6、1∶3、1∶1、3∶1、6∶1、10∶1(摩尔比)混合,然后进行 MALDI-TOF MS分析,实验结果示于图6。
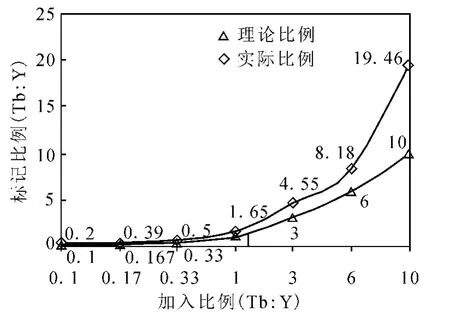
图6 肌红蛋白酶切肽段A LE LFR与Tb、Y螯合校正曲线Fig.6 The calibration curve of peptide A LE LFRfrom myoglobin chelating withrare earth metals TbandY
由于选用的两金属元素与DTPA双酸酐的结合常数分别为 Y(22.05)和 Tb(22.71),两者的结合常数都较大(都大于20),说明两者与DTPA双酸酐的结合能力都很强,而两数据又非常相近,意味着在同一体系中两者的浓度差较大时,容易发生离子交换,即产生离子抑制效应。实验数据表明,当两种金属离子的浓度相差超过6倍以上,由离子抑制带来的影响较为明显。所以,为了更加准确的进行蛋白质定量,首先要绘制校正曲线,以便对离子抑制效应进行校正。
3 结 论
引入胍基化修饰的稀土金属标记相对定量方法,排除了ε-氨基的干扰,提高了质谱峰强度,使其适用范围扩大到蛋白质水平,在实际样本中应用潜力较大。另外,该方法除了用于蛋白质相对定量外,还可用于差异蛋白质研究,为临床医学提供了有效途径;与电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)结合,可对蛋白质进行绝对定量,而ICP-MS具有对极低含量元素实施精确定量的优势(可达10-15),这使得该方法在蛋白质绝对定量研究中显示出巨大的潜力。随着研究的不断深入和条件的不断优化,该方法一定会在蛋白质组学定量研究中发挥重要的作用。
[1] 黄海涛,许桦林.蛋白质组学技术在消化疾病研究中的应用[J].临床消化病杂志,2006,18(2):127-128.
[2] 曹 冬,张养军,钱小红.基于生物质谱的蛋白质组学绝对定量方法研究进展[J].质谱学报,2008,29(3):185-191.
[3] 张 伟,王兴鹏.蛋白质组学在胰腺疾病研究中的应用[J].国际消化病杂志,2007,27(6):405-407.
[4] OU K,KESUMA D,GANESAN K,et al.Quantitative profiling of drug-associated proteomic alterations by combined 2-nitrobenzenesulfenyl chloride(NBS)isotope labeling and 2DE/MS identification[J].Journal of Proteome Research,2006,5:2 194-2 206.
[5] BREDEMEYER A,LEWIS R,MALONEJ,et al.A proteomic approach for the discovery of protease substrates[J].Proceedings of the National Academy of Sciences,2004,101(32):11 785-11 790.
[6] WANGJ,GUTIERREZ P,EDWARDS N,et al.Integration of18O labeling and solution isoelectric focusing in a shotgun analysis of mitochondrial proteins[J].Journal of Proteome Research,2007,6:4 601-4 607.
[7] LIU H,ZHANG Y,MENG L,et al.Non-gelbased dual18O labeling quantitative proteomics strategy[J].Anal Chem,2007,79:7 700-7 707.
[8] MIYAGI M,SEKHAR R.Proteolytic18O-labe-ling strategies for quantitantive proteomics[J].Mass Spectrometry Reviews,2007,26:121-136.
[9] LÓPEZ-FERRER D,RAMOS-FERNÁNDEZ A,MARTÍNEZ-BARTOLOMÉ S,et al.Quantitative proteomics using16O/18O labeling and linear ion trap massspectrometry[J]. Proteomics,2006,6:S4-S11.
[10] 李 伟.iTRAQ多重化学标记串联质谱技术在比较蛋白质组学中的应用[J].生命的化学,2006,26(5):453-456.
[11] DESOUZA L,DIEHL G,RODRIGUES M,et al.Search for cancer markers from endometrial tissues using differentially labeled tags iTRAQ and cICAT with multidimensional liquid chromatography and tandem mass spectrometry[J].Journal of Proteome Research, 2005, 4:377-386.
[12] ZHANG G,SPELLMAN D,SKOLNIK E,et al.Quantitative phosphotyrosine proteomics of EphB2 signaling by stable isotope labeling with amino acids in cell culture(SILAC)[J].Journal of Proteome Research,2006,5:581-588.
[13] LIU H,ZHANG Y,WANG J,et al.Method for quantitative proteomics research by using metal element chelated tags coupled with mass spectrometry[J]. AnalChem,2006,78:6 614-6 621.
[14] 赵丽艳,周春喜,张养军,等.基于生物质谱技术的磺酸化修饰策略及其在蛋白质组学中的应用[J].质谱学报,2007,28(3):185-192.
Improved Method for Protein Quantification by Using Rare Earth Metal-Chelated Tags after Guanidiation
LIN Hong-jun1,WEI Jun-ying2,J IA Wei1,ZHANG Yang-jun1,QIAN Xiao-hong1,CAI Yun1
(1.State Key L aboratory ofProteomics,Beijing Proteome Research Center,Beijing Institute of Radiation Medicine,Beijing102206,China;2.Beijing Institute ofTechnology,Beijing100081,China)
Rare earth metal can be chelated to target peptides by using bicyclic anhydride diethylenetriamine-N,N,N’,N’,N’-pentaacetic acid dianhydride(DTPA dianhydride),which can be used as tags and analyzed by matrix-assisted laser desorption/ionization-time of flight MS(MALDI-TOF MS)for protein quantification.To further improve the labeling efficiency,reaction temperature,p H value,time and the amount of metal tag were optimized in this study.And for the first time,guanidiation was introduced to make the labeling only take place at theN-terminal of the peptide,thus the selectivity was improved.The resultsshowed that the guanidiation rate of all peptides from standard proteins exceeds 95%,and guanidiation had little influence on the labeling.The results from seven standard proteins showed that at least three peptides of each protein can be stably labeled,and can be used for ideal tags for protein quantification.The interference of ion suppressive effect can be corrected by standard curve,and this suppressive effect has no influence on protein quantification before the ratio of two metal ions reached to 6.The improved strategy provides a technology that can be used in protein quantification not only at the peptide level,but also at the protein level.
rare earth metal-chelated tags;guanylation;protein quantification
O 657.63
A
1004-2997(2010)05-283-08
2010-01-26;
2010-04-15
“973”项目(No.2006CB910801,2006CB910803);“重大新药创制”科技重大专项(No.2009ZX09301-002);国家自然科学基金创新研究群体科学基金项目(No.30621063)资助
林虹君(1981~),男(汉族),山东人,助理讲师,从事药物分析研究。E-mail:linhongj@yahoo.com.cn
蔡 耘(1964~),女(汉族),江苏人,研究员,从事药物分析研究。E-mail:caiy_2007@yahoo.com.cn

