HPLC-MS/MS法快速测定淀粉生物粘附材料特异性结合糖类物质的含量
向 弘,朱 斌,王雪毓,刘 早,李晓玺,徐昕荣,陈 玲
(1.华南理工大学分析测试中心,广东广州 510640; 2.华南理工大学轻工与食品学院,广东广州 510640)
HPLC-MS/MS法快速测定淀粉生物粘附材料特异性结合糖类物质的含量
向 弘1,朱 斌1,王雪毓2,刘 早2,李晓玺2,徐昕荣1,陈 玲2
(1.华南理工大学分析测试中心,广东广州 510640; 2.华南理工大学轻工与食品学院,广东广州 510640)
研究了高效液相色谱-串联质谱(HPLC-MS/MS)法测定淀粉生物粘附材料与糖残基特异性结合实验中,岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺4种糖类物质含量的分析方法。将反应后的样品直接离心过滤后即可利用HPLC-MS/MS进行定性定量分析。以V(乙腈)∶V(水)=80∶20的溶液作为液相色谱流动相,质谱采用电喷雾负离子电离方式扫描,以多反应监测(MRM)模式进行定量分析。在添加水平为1.0~40.0 mg·L-1范围内,岩藻糖的回收率为111.0%,相对标准偏差(RSD)为6.55%;在添加水平为1.0~80.0 mg·L-1范围内,半乳糖、α-甲基甘露糖苷和N-乙酰葡萄糖胺的回收率分别为106.5%、99.0%和91.0%,相对标准偏差分别为7.78%、6.64%和5.68%。4种糖类物质的方法检出限(S/N≥3)分别为0.1 mg·L-1(岩藻糖),1.0 mg·L-1(半乳糖),0.1 mg·L-1(α-甲基甘露糖苷)和0.5 mg·L-1(N-乙酰葡萄糖胺)。该方法可用于评价淀粉粘附材料和糖类物质的特异性结合,为其他领域中糖类物质含量的测定提供可借鉴的方法。
淀粉生物粘附材料;高效液相色谱-串联质谱(HPLC-MS/MS);糖类物质
生物粘附(bioadhesion)是指天然或合成的高分子物质所具有的能够粘附到腔道粘液(mucus)或上皮细胞表面的能力[1]。在淀粉生物粘附材料中引入的糖蛋白侧链能特异性识别细胞表面的糖残基并与之结合,如 N-乙酰半乳糖胺、N-乙酰葡萄糖胺、半乳糖、果糖及唾液酸等,在细胞识别和粘附反应中起着重要作用[2-3]。因此,通过测定淀粉粘附材料上的糖蛋白与糖类物质特异性结合后剩余的糖量,计算得到能与粘附材料特异性结合的糖,从而可确定淀粉粘附材料与人体胃肠道上皮细胞特异粘附部位。
目前,测定糖类物质含量的最常用方法有比色法、气相色谱法和高效液相色谱法等。比色法[4]易受到其他可与显色试剂反应的物质的干扰;气相色谱法须将样品衍生化才能进行分析[5];液相色谱法不需要衍生化,但是测定糖常用的示差折光检测器灵敏度较低,需通过柱前衍生,然后用紫外和荧光检测提高灵敏度,操作繁杂且常出现异常干扰,影响分析的准确性[5]。高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)分析物质具有灵敏度高,样品一般不需衍生化处理的特点。目前国内采用LC/MS法测定糖类物质的报道中,主要是利用单级质谱或多级质谱法对糖类物质做定性研究。徐瑾[6]使用柱前衍生法分别对芦荟多糖样品和其水解产物进行衍生,结合LC/MS法检测,以说明其“结构单元”单糖的组成。孙志伟等[7]利用在线串联质谱的电喷雾电离模式监测,获得了油菜花粉多糖中各组分的质谱定性规律。Cappiello等[8]利用亲水作用色谱和电喷雾质谱直接研究海洋粘胶中低聚糖的组成情况。Wan等[9]通过LC/MS法研究大气气溶胶中三糖以下糖类物质的含量,以[M+NH4]+加合离子作为目标物质的定性定量离子。胡强等[10]建立了LC-MS/MS法测定人尿中乳果糖、甘露醇和乳糖含量,可用于肠通透性评价。而利用 HPLCMS/MS法直接进行糖类物质定量分析的报道较少。
用LC/MS法进行定量分析时,不采用总离子色谱图,而是采用与待测组分相对应的特征离子得到的质量色谱图或多离子监测色谱图。此时,不相关的组分将不出峰,可以减少组份间的互相干扰。LC/MS定量的最好方法是采用串联质谱(MS/MS)的多反应监测(MRM)模式。MRM技术是基于已知信息或假定信息,设定质谱检测规则,对符合规则的离子进行信号记录,去除大量不符合规则的离子信号干扰,从而得到质谱信息的一种数据获取方式。具体地说,即是根据母离子质量数和特征碎片离子质量数,选择母离子/特征碎片离子对,允许符合设定的母离子进入碰撞室,碰撞完成后,只记录设定特征碎片离子信号。通过母离子和特征碎片离子的两次选择,去除干扰离子,降低化学背景,提高灵敏度[11]。
本工作选择4种细胞表面含有的糖类物质,岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺,利用HPLC-MS/MS的MRM模式作为定量研究手段,直接测定未与淀粉粘附材料特异结合的剩余糖量,可用于评价淀粉生物粘附材料和细胞表面糖类物质的特异性结合。
1 材料与方法
1.1 试剂与仪器
乙腈(色谱纯):德国Merk公司产品;水:超纯水;岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺标准品:美国 Vector Laboratories公司产品。
Bruker Esquire HCT PLUS大容量离子阱质谱仪:德国Bruker公司产品,配有电喷雾离子源(ESI);1100系列高效液相色谱仪:美国Agilent公司产品,配有四元泵、在线真空脱气机、柱温箱和自动进样器。
1.2 标准溶液配制
准确量取一定体积的岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺标准品,用超纯水分别配制成浓度为1 g·L-1的标准储备液,摇匀,置于2~8℃,保存备用。
1.3 样品处理
将一定质量的淀粉生物粘附材料分别与已配制成一定浓度的岩藻糖、半乳糖、α-甲基甘露糖苷和N-乙酰葡萄糖胺溶液反应2 h,反应后将反应液以8 000 r·min-1高速离心3 min,取上清液,用0.2μm滤膜过滤后,进行液相色谱-质谱分离和检测。
1.4 试验条件
1.4.1 色谱条件 色谱柱:Agilent ZORBAX N H2(250 mm×4.6 mm×5μm);流动相:V(乙腈)∶V(水)=80∶20的溶液;流速:0.6 mL· min-1;柱温:常温;进样量:10μL。
1.4.2 质谱条件 电喷雾离子源负电子扫描(ESI-),多反应监测模式(MRM);毛细管电压: 4 000 V;雾化气压力:0.138 MPa;干燥气流量: 10 L·min-1;干燥气温度:250℃。
2 结果与讨论
2.1 质谱分析
取20 mg·L-1的岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺标准溶液,分别将其标准溶液采用直接注射进样法注入离子源中,在电喷雾负离子电离方式下进行母离子全扫描,对质谱条件进行优化,质谱条件主要是扫描范围、毛细管出口电压和锥孔电压,得到目标物质的[M-H]-准分子离子峰,确定岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺的准分子离子峰分别是 m/z163、179、193和220。分别以上述离子为母离子进行二级质谱分析,采用全扫描的二级离子质谱图得到碎片离子信息,然后再对得到的目标物质的二级质谱碎裂电压进行优化。为了增加检测的灵敏度,以MRM模式调谐二级质谱碎裂电压,即MRM碰撞能量,使每种糖类物质的母离子与特征碎片离子产生的离子对相对强度达到最大时为最佳。4种糖类物质的一级及二级质谱图示于图1,优化后的岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺的质谱分析条件列于表1。
由图1(a2)可见,岩藻糖二级质谱的主要特征碎片离子是 m/z145和 m/z89,各特征碎片离子归属如下:m/z145为岩藻糖分子离子的失水峰[M-H2O-H]-;m/z89为岩藻糖分子离子裂解后所产生的丁二醇分子的碎片离子峰。
由图1(b2)可见,半乳糖二级质谱的主要特征碎片离子是 m/z161、143和89,各特征碎片离子归属如下:m/z161为半乳糖分子离子的失水峰[M-H2O-H]-;m/z143为半乳糖分子离子失去2个水的离子峰[M-2H2O-H]-; m/z89为半乳糖分子裂解后所产生的丁二醇分子的碎片离子峰。
由图1(c2)可见,α-甲基甘露糖苷二级质谱的主要特征碎片离子是m/z161、145和101,各特征碎片离子归属如下:m/z161为α-甲基甘露糖苷分子经碰撞后丢失甲基后的失水峰[MCH3-H2O]-;m/z145为α-甲基甘露糖苷分子经碰撞后丢失甲氧基后的失水峰[M-OCH3-H2O]-;m/z101为α-甲基甘露糖苷分子裂解后所产生的戊烯二醇分子的碎片离子峰。
由图1(d2)可见,N-乙酰葡萄糖胺二级质谱的主要特征碎片离子是m/z119和101,各特征碎片离子归属如下:m/z119为α-甲基甘露糖苷分子裂解后所产生的戊三醇分子的碎片离子峰; m/z101为戊三醇分子离子进一步失水后所产生的戊烯二醇分子的碎片离子峰。
由以上4种糖类物质二级质谱图碎片离子分析可知,糖类物质分子在二级电离过程中易丢失水分子形成失水峰,并且也较易获得稳定度较高的多元醇分子或烯醇分子的碎片离子。岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺二级质谱图中,离子强度最高的碎片离子分别为m/z89、89、101和119,因此以 m/z89(163), m/z89(179),m/z101(193)和m/z119(220)分别作为对应糖类物质定量分析时的定量离子。

表1 岩藻糖、半乳糖、α-甲基甘露糖苷和N-乙酰葡萄糖胺的质谱分析条件Table 1 The analysis parameters of mass spectrum of fucose,galactose,α-methyl mannoside andN-acetylglucosamine

图1 4种糖类物质的一级和二级质谱图(a1)、(a2)岩藻糖;(b1)、(b2)半乳糖;(c1)、(c2)α-甲基甘露糖苷;(d1)、(d2)N-乙酰葡萄糖胺Fig.1 ESI(-)-MS and ESI(-)-MS/MS product-ion mass spectra of glucide (a1),(a2)fucose;(b1),(b2)galactose;(c1),(c2)α-methyl mannoside;(d1),(d2)N-acetylglucosamine
2.2 液相分析
分离糖类物质所采用的色谱柱主要有两类,即氨基柱和糖柱[5]。糖柱采用的是水作为流动相,在质谱分析阶段纯水会影响质谱的离子强度,而氨基柱使用了乙腈-水作为流动相,因此最终采用氨基色谱柱。
流动相中乙腈含量的多少直接影响分离效果。增加有机相有利于4种糖类物质组分间的分离;相反,增加水相比例有利于糖类的溶解,但不利于各组分间的分离。经多次实验,最终确定流动相为V(乙腈)∶V(水)=80∶20的溶液。岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺标准物质的提取子离子色谱图示于图2,以m/z89(163),m/z89(179),m/z101(193)和m/z119(220)分别作为4种糖类物质的提取离子。从图2可以看出,4种糖类物质得到较好的分离,各组分分析时间短,均可在8 min内完成。因此本方法可用于单独快速测定4类糖类物质的特异性结合实验,同时也可满足混合样品的分析,样品中各糖类物质的提取子离子色谱图示于图3。
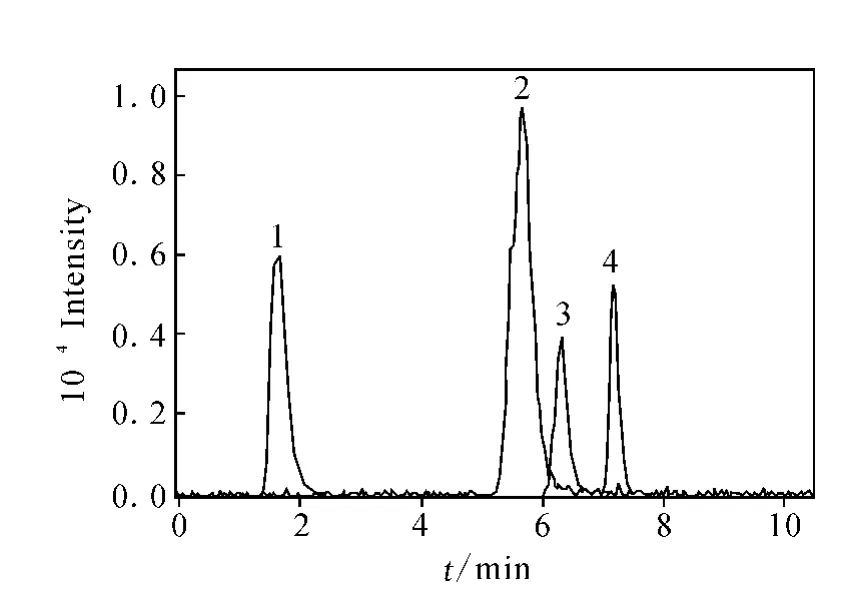
图2 4种糖类标准物质的提取子离子色谱图Fig.2 The extracted ion chromatogram of standard glucide

图3 样品中4种糖类物质的提取子离子色谱图Fig.3 The extracted ion chromatogram of samples
2.3 线性范围
取岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺的标准储备液,分别用超纯水配制成标准工作溶液,岩藻糖标准工作溶液的浓度为1.0、10.0、20.0、30.0和40.0 mg·L-1,半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺标准工作溶液的浓度为1.0、10.0、20.0、40.0、60.0和80.0 mg·L-1。
以标准浓度为 x轴,峰面积为 y轴,进行回归分析,经“1/X”权重可得回归方程:岩藻糖回归方程为 y=-3.27×103+4.35×103x,r= 0.994 5;半乳糖回归方程为 y=2.96×103+ 1.20×103x,r=0.999 6;α-甲基甘露糖苷回归方程为 y= -1.03×102+1.18 ×103x, r=0.998 7;N-乙酰葡萄糖胺回归方程为 y= -1.03×104+4.63×103x,r=0.999 3。实验结果表明,在1.0~40.0 mg·L-1范围内,岩藻糖具有良好的线性关系,半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺在1.0~80.0 mg·L-1范围内同样也具有良好的线性关系,它们都符合定量的要求。
2.4 回收率和精密度试验
用标准加入法进行回收率实验,对方法的准确度和精密度进行考察。在空白样品中精密加入岩藻糖、半乳糖、α-甲基甘露糖苷和 N-乙酰葡萄糖胺的标样溶液进行加标回收试验,结果列于表2。
2.5 灵敏度
依据样品的处理方法和测试条件,采用质谱进行定量分析时,4种糖类物质的方法检出限(S/N≥3)分别为0.1 mg·L-1(岩藻糖)、1.0 mg·L-1(半乳糖)、0.1 mg·L-1(α-甲基甘露糖苷)和0.5 mg·L-1(N-乙酰葡萄糖胺)。

表2 回收率与精密度测定结果(n=5)Table 2 Results of tests for recovery and precision of the method(n=5)
3 结 论
本工作建立了快速灵敏的检测与淀粉生物粘附材料特异性结合的4种细胞表面含有的糖类物质含量的高效液相色谱-串联质谱的分析方法,通过离子阱质谱的多级质谱功能对样品进行定性及精确定量分析。本方法样品直接离心过滤后即可进样,大大简化了样品处理步骤,提高分析效率,而且灵敏度高,分析时间短,回收率为111.0%~91.0%,重现性好,能满足生物样品分析方法的有关要求,为淀粉生物粘附材料与细胞表面糖类物质的特异性结合评价提供了可靠的分析方法,同时也为其他领域中糖类物质含量的测定提供了可借鉴的方法。
[1]王 健,毕殿洲.生物粘附材料的研究进展[J].沈阳药科大学学报,2002,19(5):373-380.
[2]HAL TNER E,EASSON J H,L EHR C M.Lectins and bacterial invasion factors for controlling endo-and transcytosis of bioadhesive drug carrier systems[J].Eur J Pharm Biopharm,1997,44:3-13.
[3]CLARK M A,J EPSON M A,SIMMONS N L,et al.Differential expression of lectin-binding sites defines mouse intestinal Mcells[J].J Histochem Cytochem,1993,41:1 679-1 687.
[4]林炎坤.常用的几种蒽酮比色定糖法的比较和改进[J].植物生理学通报,1989,(4):53-55.
[5]王 静,王 晴,向文胜.色谱法在糖类化合物分析中的应用 [J].分析化学,2001,29(2): 222-227.
[6]徐 瑾.高效凝胶渗透色谱及高效液相色谱和电喷雾-离子阱质谱法联用测定构成芦荟多糖的单糖[J].理化检测:化学分册,2008,44(12):1 133-1 136.
[7]孙志伟,刘凌君,户宝军,等.1-(2-萘基)-3-甲基-5-吡唑啉酮衍生试剂的制备及其在高效液相色谱-质谱法测定糖类化合物中的应用[J].色谱, 2008,26(2):200-205.
[8]CAPPIELLOA A,TRUFELLIA H,FAMIGLINIA G,et al.Study on the oligosaccharides composition of the water soluble fraction of marine mucilage by electrospray tandem mass spectrometry [J].Water Research,2007,41:2 911-2 920.
[9]WAN E C H,YU J Z.Determination of sugar compounds in atmospheric aerosols by liquid chromatography combined with positive electrospray ionization mass spectrometry[J].J Chromatogr A, 2006,1 107:175-181.
[10]胡 强,徐红兵,李水军,等.液相色谱-串联质谱法测定尿中乳果糖、甘露醇和乳糖含量[J].中国现代医学杂志,2008,18(13):1 810-1 817.
[11]BRUNO D,RUEDI A.mass spectrometry and protein analysis[J]. Science,2006,312: 212-217.
Rapid Detection of Glucide Specifically Linking with Starch Bioadhesive Materials by HPLC-MS/MS
XIANG Hong1,ZHU Bin1,WAN G Xue-yu2,LIU Zao2,LI Xiao-xi2,XU Xin-rong1,CHEN Ling2
(1.A nalytical and Testing Center,South China University ofTechnology,Guangzhou510641,China; 2.School of Light Chemistry and Food Science,South China University ofTechnology,Guangzhou510641,China)
A method was developed in determining 4 kinds of glucides which were fucose,galactose,α-methyl mannoside andN-acetylglucosamine,in experiment of adhesive property between starch bioadhesive materials and sugar residues by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).The sample was filtrated and analyzed by HPLC-MS/MS.Analyte was separated by liquid chromatography with a mobile phase consisting ofV(acetonitrile)∶V(water)=80∶20.The mass spectrometer was opera-ted at the negative ion mode via electrospray ionization(ESI)source.The quantitative analysis was determined by the multiple reactions monitoring(MRM).Linear relationship between values of peak area of detection signals and concentration of fucose are obtained in the ranges of 1.0—40.0 mg·L-1,while relationships of galactose,α-methyl mannoside andN-acetylglucosamine are obtained in the range of the linear ranges 1.0—80.0 mg·L-1.The recovery rate of fucose is 111%,and the RSD is 6.55%.The recoveries rates of galactose, α-methyl mannoside andN-acetylglucosamine are 106.5%,99.0%and 91.0%,the RSDs are 7.78%,6.64%and 5.68%,respectively.Limits of detection(S/N≥3)for fucose,galactose,α-methyl mannoside andN-acetylglucosamine are 0.1,1.0,0.1 and 0.5 mg·L-1, respectively.The method is proved to be rapid,reliable and sensitive,which is suitable for estimating the specific linking between starch bioadhesive materials and glucides.The proposed method is also suitable for rapid determination of glucides components in other complex system.
starch bioadhesive materials;high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);glucides
O 657.63
A
1004-2997(2010)05-291-06
2009-11-09;
2010-03-29
国家自然科学基金项目(20606014);国家支撑项目(2006BAD27B04)资助
向 弘(1980~),女(土家族),工程师,从事质谱仪测试方面研究。E-mail:hxiang@scut.edu.cn
陈 玲(1964~),女(汉族),博士,教授,从事生物材料方面研究。E-mail:felchen@scut.edu.cn

