跑台运动在动物实验研究中的应用
姚 璐,张 缨,张连峰
(1.中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021;2.北京体育大学 运动人体科学学院,北京 100084)
跑台运动在动物实验研究中的应用
姚 璐1,2,张 缨2,张连峰1
(1.中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021;2.北京体育大学 运动人体科学学院,北京 100084)
跑台在实验动物研究中的应用越来越多,主要集中在建立运动模型以及探究运动对生理和病理的作用,以促进运动训练的科学化、竞技体育成绩的提高、运动疗法在疾病康复中合理有效的应用等,同时也是研究运动与代谢,运动与心脑血管病等的研究工具。本文对动物跑台的基本构造、使用方法和研究进展进行了分析和总结,为利用跑台进行研究提供一定的参考。
跑台;运动模型;心血管;代谢;骨
1961年,Kimeldor设计了第一个大鼠跑台,距今已有近五十年的历史。目前,动物跑台已用于大鼠、小鼠、狗等实验动物,是运动训练、运动损伤、新陈代谢、生理和病理等实验研究的手段之一。文本旨在对动物跑台的构造、使用方法及其应用分析、总结,为跑台在实验动物研究中更加广泛的应用提供一定的参考。
1 动物跑台的构造
动物跑台与与人用的跑步机结构基本相同,为适应动物的体型设计成了不同的大小。动物跑台(图1)通常附带一个透明的塑料盖,防止动物跳出跑台。跑台的主要部分是一个滚动的传送带,表面的材质有利于动物抓地。分隔板将跑台划分成若干通道,通道的后壁安装有刺激电极和/或发声装置,各个通道的刺激装置是彼此独立的。当动物拒绝跑动或者跑速低于实验要求时,就会在传送带上退行而碰触到后壁的刺激装置,较强的电刺激或声音刺激将迫使动物按照跑台的速度奔跑。除此之外,还可以应用其它的方式,如光刺激。但是过多的刺激会引起生理上的变化,如肾上腺素升高;不同的刺激方式也会对实验结果造成影响,电刺激的强度比机械刺激大,有研究发现在达到相同的疲劳标准时,两种刺激所造成的疲劳对动物机体糖代谢的影响是有区别的[1]。因此,在跑台实验中应当尽量降低刺激强度和刺激频率。

图1 动物跑台Fig.1 The treadmill for laboratory animals
实验动物采用跑台的方式进行运动的主要优点在于:(1)运动方式符合实验动物日常的运动情况;(2)动物在各个通道内独立运动,不会受到干扰,彼此之间的限制因素较少;(3)与游泳和自主转笼运动相比,跑台运动可以更加准确地控制运动负荷,跑台的坡度和速度都是可以人工调节的;(4)随着电子信息技术的飞速发展,一些跑台采用了完全的计算机控制系统,可以准确地控制动物的状态,计算动物运动过程中做功并进行数据处理,能够实时获取实验数据,同时提高了实验数据的分析效率,是动物生理机能定量分析的发展趋势。
2 运动负荷和跑台参数的设定
根据不同的实验目的,动物的跑台运动包括持续性运动、间歇运动等各种方案。在对动物进行运动训练时,大多数研究中的运动频率为每天跑1~2次,每周5~6 d,持续若干周不等,并且通常需要1周左右的适应期,此期间运动量较小,使动物逐渐适应实验要求的运动负荷。
常用摄氧量与最大摄氧量(VO2max)的百分比衡量运动强度,对强度的控制可以通过调节跑台的速度和坡度来实现。VO2max与体重和性别有一定的关系,因此应全面考虑以确定运动强度。1979年,Bedford等[2]将年龄、性别、体重、训练程度等因素对大鼠最大摄氧量的影响进行了研究,并得出了不同速度和坡度与摄氧量之间的关系,为运动强度的量化提供了理论依据(表1)。
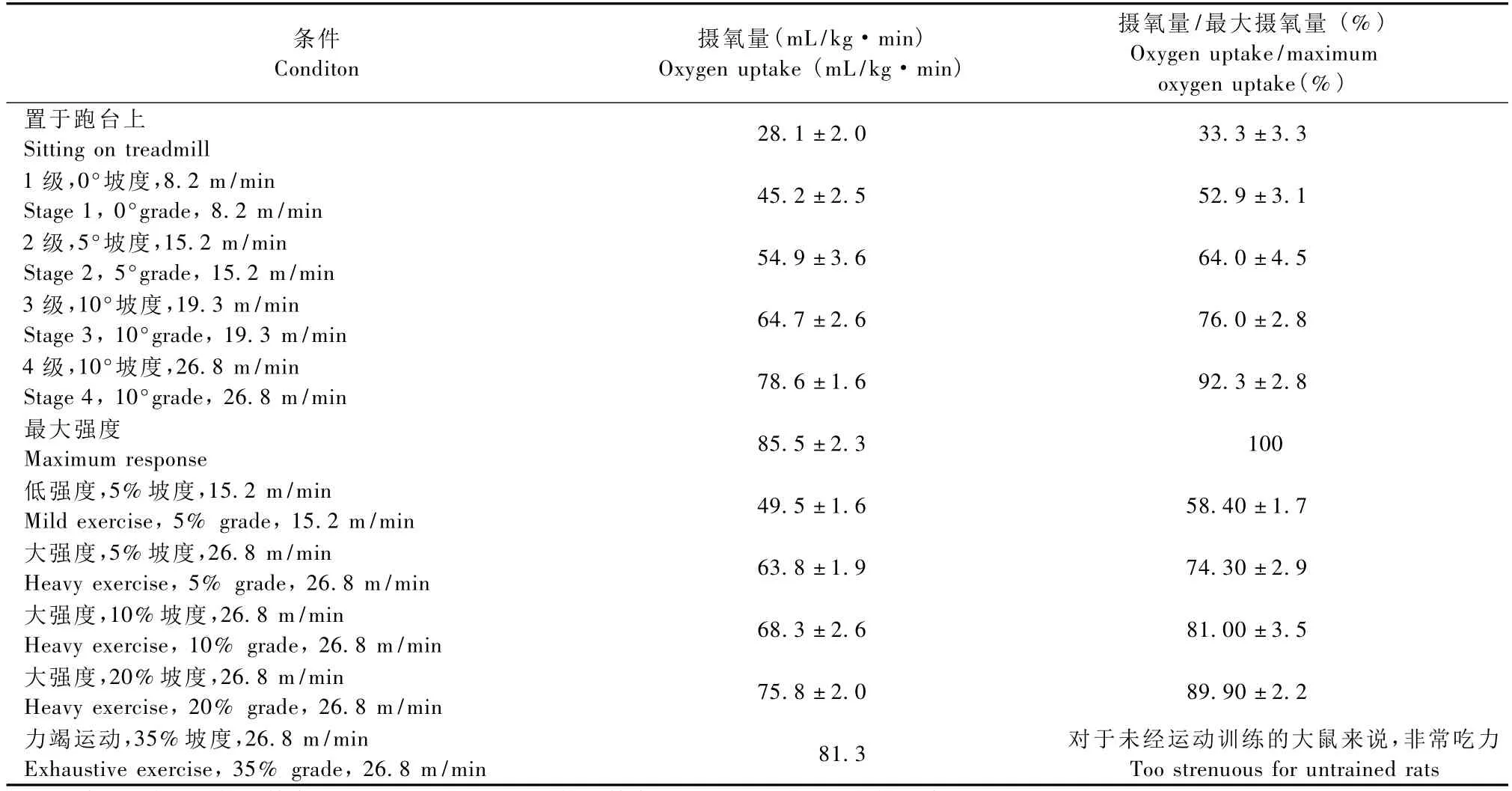
表1 大鼠在不同方式的递增负荷运动过程中的摄氧量变化[2]Tab.1 VO2changes during a progressive exercise test and with different training regimes
一些跑台的设计已经具备测定最大摄氧量的功能,但是在应用不能测量实验动物代谢状态的跑台时,可以根据 Bedford等[2]的研究结果做以粗略的估算:
(1)小于200 d的大鼠的 VO2max:雄性,0.19×体重(g)+91.16;雌性,0.20×体重(g)+95.58;
(2)大于200 d的大鼠的 VO2max:0.35×体重(g)0.69。
3 跑台运动在实验动物研究中的应用
3.1 跑台在建立运动模型中的应用
人体实验受到方法学和道德方面的限制,具有很大的局限性,影响了有关研究的深入。所以非常有必要采取动物模拟性实验,而复制动物模型是其中的重要环节,模型的适用性、可靠性和可行性直接关系到实验结果的科学性。
为了提高竞技水平,减少运动伤病,研究运动训练过程中机体的生理变化规律,创建了各种运动模型。采用动物模拟运动人体的各种生理和病理过程,探讨运动对机体的影响以及机体对运动的反应。跑台经常被用于实验动物的各种运动模型的建立中,如运动性疲劳模型、过度训练模型、运动性贫血模型、运动性损伤模型等。
3.1.1 运动性疲劳模型:当前运动成绩正逐渐接近人体的生物极限,强度越来越大,疲劳程度也就越来越深。运动性疲劳已经成为体育生物学科关注的热点问题,它是指机体的生理过程不能持续其机能在一特定水平或不能维持预定的运动强度。建立理想的运动性疲劳模型有助于深入研究运动性疲劳的发生机理和恢复手段,对训练的科学化以及运动员运动能力和健康的维护都有十分重要的意义。
田野等[3]根据动物的表情、逃避反应、跑姿和运动能力等指标判断是否达到疲劳和疲劳的程度,建立了几种不同的急性运动性疲劳动物模型:(1)大鼠在水平跑台上进行20 min、速度为28 m/min的向心运动,这种短时间、大强度的运动能够较快地诱发身体疲劳,但是疲劳程度较轻,可以通过增加运动组数加深疲劳;(2)采用长时间、中等强度的运动,以18 m/min的速度跑100 min,大鼠表现出明显的疲劳症状,恢复时间延长,可以作为有氧运动的疲劳模型;(3)力竭是疲劳的一种特殊形式,是在疲劳时继续运动,直到肌肉或器官不能维持运动的状态,以18 m/min的速度进行200 min的超长时间跑台运动后,大鼠基本无法继续运动,达到了力竭状态。在对具体的体育项目进行的动物实验研究时,可以依据运动方式的差异选择不同的运动性疲劳模型。
另外,还可以通过7周的大强度跑台运动建立慢性运动性疲劳动物模型。具体方法是:前五周采用递增负荷运动,每周训练5 d,每天训练20 min,各周的速度分别为 15 m/min、22 m/min、27 m/min、31 m/min、35 m/min;接下来两周的跑速维持在35 m/min,以两种运动时间建模,一般训练组每天跑20 min,强化训练组每天跑 25 min[4]。
3.1.2 过度训练模型:运动训练负荷过大,超过机体的承受能力,训练后机体未能得到充分恢复,运动训练与恢复的长期失衡会导致过度训练。过度训练综合征是最常见的运动性疾病,发病率在各类运动性疾病中占据首位,对运动员的身心健康和运动成绩的损害都是巨大的。
叶剑飞等[5]通过建立过度训练动物模型,对一些简便适用的指标进行了系统的分析和筛选,为运动训练提供了指导,也为后续的研究打下基础。大鼠模拟周期性耐力项目的反复超长距离跑,逐渐递增跑速和时间以加大运动量,应用心电图、饮食量、精神状况、毛发、运动能力以及血液等指标进行判断,确定诱发了过度训练。郑陆等[6]对大鼠的大运动量跑台训练也达到了过度训练状态。跑台坡度为10°,一般训练和力竭训练各4周,每周6 d,每天的运动量安排如下:第一周为10 m/min×10 min;第二周:10 m/min×10 min,然后再进行15 m/min×10 min;第三周:10 m/min、15 m/min和20 m/min各10 min;第四周:以 10 m/min、15 m/min、20 m/min 以及25 m/min的速度各进行10 min持续跑;从第五周起,每天分别进行15 m/min、20 m/min和25 m/min各10 min的运动后,加速至30 m/min和35 m/min各20 min,并不断递增跑速,直至力竭。同步监测大鼠的体重、血红蛋白、血尿素氮、血浆总睾酮和运动能力,符合人体过度训练的表现。
3.1.3 运动性骨骼肌损伤模型:运动性骨骼肌损伤是反复运动导致的肌纤维损伤,易发生在骨骼肌的离心收缩过程中,多见于周期性运动的耐力项目。运动性骨骼肌损伤的动物模型,基本上是驱使动物在一定坡度的跑台上进行下坡跑。在下坡运动中肌肉离心收缩做功,主要工作肌群是前肢的股四头肌和小腿三头肌,由于体重的分布原因,对后肢的作用效果小,所以在使用这种动物模型时,应该在前肢取材[7]。陈英杰等[8]的研究中,大鼠在 16°的跑台上以16 m/min的速度持续90 min下坡跑,引起肌纤维损伤。在光镜下可见肌细胞变性、坏死、炎细胞浸润;在电镜下可见肌细胞的肌丝扭曲、溶解、断裂,线粒体肿胀、破裂溶解等形态结构变化,是典型的运动性骨骼肌损伤的病理特点。在Armstrong的实验中,16°是大鼠下坡跑不打滑的最大坡度,然而不同型号跑台的传送带材料和质地存在差异,故可以适当地调整坡度。在保证大鼠能够正常跑步的前提下,坡度越大,模型的复制效果应该越明显[7]。
肌肉的慢性损伤是由于局部过度负荷、多次微细损伤的积累造成的劳损,或者是由于急性损伤处理不当转化而来的陈旧性损伤。对慢性肌肉损伤动物模型的复制,大都应用过度负荷或过度牵张等原理制作。大鼠以16 ~20步/10 s的速度在10°~15°的跑台上持续跑30~60 min,共训练272 d,复制出肌肉慢性损伤模型。上坡跑的难度较大,对于没有经过训练的实验动物,可以适当降低坡度或逐渐增加坡度和跑速,还可以应用间歇训练法。
3.2 跑台运动在生理和病理研究中的应用意义
跑台运动是耐力训练的一种很好的方式,使机体在生理上出现一系列有益的适应性变化。适当的运动可以调节机体各器官系统的功能,进而缓解病情,因此越来越多的研究开始致力于运动康复方向。
3.2.1 跑台运动与心血管功能的相互作用:耐力运动和心血管机能之间具有一定的关联性,心血管机能的增强可以提高耐力运动能力,同时耐力运动有助于改善心血管机能。
Chen等[9]研究了11种近交品系大鼠,发现它们的耐力能力和离体心脏机能之间都有很好的相关性(r=0.86),DA和COP大鼠的跑台运动能力相差两倍多,DA大鼠离体心脏的排血量比COP大鼠高出50%以上,DA大鼠心脏的其它一些指标也显著高于 COP大鼠,如离体乳突肌的最大张力、离体心肌细胞中Ca2+从肌浆网中的释放、离体心肌细胞的 Na+、K+-ATP 酶的活性。Buck 等[10]依据跑台测试成绩,将高运动能力(HCR)和低运动能力(LCR)的大鼠分别近交繁殖,与HCR子代相比,LCR子代的血压较高。跑台运动能力高的大鼠对室性心律失常的敏感性降低,这是由于在缺血过程中心脏的代谢需求减少,并且心率自动调控的范围扩大所引起的[11]。肌球蛋白R403Q突变的转基因小鼠诱发心肌病,其运动耐量显著受损[12]。常用上坡跑作为评价实验动物心功能的应激测试,进行性假肥大型肌营养不良(DMD)对心肌功能也有影响,微小肌营养不良蛋白转基因小鼠比同年龄同性别患有DMD心肌病的mdx小鼠的跑距远得多,转基因小鼠上坡跑能力的提高说明心脏功能得到了改善[13]。Medeiros等[14]通过多级跑台测试评估心衰小鼠的心脏状况。
心脏是运动最直接刺激的部位,剧烈运动会导致心脏病患者的病情加重,甚至有致命的危险。但是,强度适当的运动可以给予心脏良好的刺激,长期坚持能够改善心脏机能。人类流行病学调查和许多实验研究都表明有规律的运动可以减少心血管疾病的风险因子。有研究显示跑台运动引发了心脏的保护性应答,增加了热应激蛋白70(Hsp70)的转录和表达[15]。运动能够促进心肌细胞产生适应性肥大,增强心肌收缩功能。对雌性 SD大鼠进行间歇训练,训练期以85%~90%VO2max的强度跑8 min,间歇期以50%~60%的强度跑2 min,4周后发现心肌肌丝的Ca2+敏感性增加,这可能是心肌细胞收缩力增强的主要原因[16]。
然而运动对心血管的积极作用是否存在性别差异颇有争议。一般认为雌激素是对抗心血管疾病的保护性因子,流行病学调查显示绝经前女性的冠心病发病率低于男性,绝经后女性与男性发病率的差距缩小。但是考虑到生活方式这个因素后,冠心病发生率的性别差异也减小。大鼠在跑台上以30 m/min的速度运动60 min后,雄鼠和切除卵巢的雌鼠的心脏功能都得到了明显的改善,如左心室的最大收缩率和最大舒张率升高,而正常雌鼠的变化并不大,因此Paroo等[15]提出在预防心脏疾病上,运动疗法对男性可能比女性更有效,有利于缩小心脏敏感性的性别差异。
许多心脏疾病最终都发展成心力衰竭,它是造成死亡的一个重要原因。心力衰竭是由各种原因的初始心肌损伤引起心脏结构和功能的变化,最后导致心室泵血功能低下,心脏不能泵出足够的血液以满足组织的代谢需要,或仅在提高充盈压后才能泵出组织代谢所需要的血量。对于病情稳定的心衰病人,采用运动疗法是安全的,与药物治疗相结合,可以取得更佳的疗效。Emter等[17]和 Chicco等[18]先后对自发性高血压心衰大鼠模型进行研究,雄性和雌性大鼠分别以14 m/min和14.5 m/min的速度,每天跑45 min,每周3 d,结果都显示长期的运动训练推迟了心力衰竭的发生,提高了它们的存活率,他们认为运动可能是通过改善线粒体能量代谢的途径来达到缓解心力衰竭的目的[18]。在确定雄鼠训练强度的过程中,强度的增加导致了训练时的猝死[17]。不同原因引发的心力衰竭,运动疗法的效果不同。由于严重的心肌缺血阻碍了心肌能量的产生,影响心肌的舒缩功能,导致心力衰竭,可以通过运动改善侧枝循环和冠状微血管舒张,从而促进心肌灌注;由心肌梗死引起的心力衰竭对运动的敏感性较差[19]。不过,有研究对心肌梗死导致的充血性心力衰竭大鼠进行中等强度的跑台训练,发现最大摄氧量增加,腹膜巨噬细胞的功能得以恢复[20]。实验结果的不一致可能是由实验条件的差异造成的,如动物模型、心肌梗死的面积、心力衰竭的程度和持续时间等。
3.2.2 跑台运动对代谢的调节作用:运动所需的能量主要来源于糖和脂肪两类物质,通过运动可以调节机体的糖、脂代谢。肥胖就是由于脂代谢紊乱所造成的,已经成为全世界共同面临的公共健康问题,被列为世界四大医学社会问题之一,它会增加许多慢性疾病的发生风险。单纯性肥胖的主要原因之一是静坐少动的生活方式。因此在限制饮食的同时,进行适当的运动是应对肥胖的良策。
12周的跑台运动显著减小了雄性大鼠脂肪细胞的大小,增强了肾上腺素刺激的脂肪分解作用,Askew和Hecker[21]认为这是训练产生的代谢适应,食物限制虽然也能减轻体重,但是达不到这样的目的。Bhattacharya等[22]对雄性 BALB/c小鼠进行14周的跑台训练后发现,虽然运动导致了摄食量的增加,但是运动组的体重增加值却低于安静组,主要是由于体脂的含量和比例发生了变化,同时,运动降低了血浆葡萄糖浓度和瘦素水平。雄性SD大鼠在经过中等强度(60%VO2max)的耐力跑之后,全身的脂肪酸氧化水平提高,Ishikawa等[23]首次提出大脑中的生长转化因子-β参与了这种调节。
运动增加了Zucker大鼠的脂蛋白脂酶(LPL)活性,而对 Osborne-Mendel大鼠的研究结果与此相反,在这两种形式的肥胖中,LPL对脂肪生成和维持的作用具有较大的差异[24]。中等强度的跑台训练促使身体成分发生有益的变化,脂肪合成减少,但是在停训2周后,摄食量、体重、脂肪合成以及腹膜脂肪细胞的数量都迅速增加,Applegate[24]等提出训练时引起的胰岛素敏感性增加可能是原因之一。也有其它研究显示运动训练对脂肪代谢的改善作用不具有持续性,停训后脂肪沉积。这种现象也可能与训练期的长短等因素有关。
大多数研究都表明跑台运动具有增加瘦体重,降低体脂百分比的作用,然而关于年龄与运动的研究结果并不一致。随着年龄的增长,生活方式和生理机能发生了改变,体脂百分比逐渐增加,有人认为不同年龄的生理状况对运动的应答不同会造成运动效果的差异,运动对老年的减脂作用不明显。分别对6月龄、15月龄和27月龄的雌性大鼠进行12周的跑台训练,运动增加了6月龄和15月龄大鼠的摄食量和瘦体重,而27月龄大鼠的摄食量和瘦体重几乎没有变化,但是各年龄组大鼠的体脂含量都有明显下降[25]。在运动耗能相同的情况下,很难说明老年大鼠体重和体脂的降低是否直接由运动引起的,但是 Mazzeo[25]也指出,与27月龄对照组的体重和体成分变化(瘦体重下降)相比,运动组能够维持瘦体重不变,足以证明运动的积极作用了。该研究中的运动强度对于老年大鼠来说是非常大的,因此运动强度很可能是造成实验结果差异的主要原因。
跑台运动不仅对脂代谢有很好的调节作用,还能够改善糖代谢。运动中的骨骼肌是胰岛素的主要作用部位,长时间运动可以提高胰岛素敏感性。Straczkowskl等[26]发现红肌和肝脏中的甘油三酯(TG)含量和胰岛素之间具有明显的相关性,4周的跑台训练则削弱了TG对高胰岛素血症和胰岛素敏感性的负面效应。Zucker糖尿病肥胖(ZDF)大鼠可用作高脂饮食诱导的2型糖尿病模型,跑台运动增加了肌肉中GLUT4的蛋白表达,Smith等[27]认为训练可能通过降低FAT/CD36,削弱了胰岛素抵抗的现象。
3.2.3 跑台运动对骨质疏松症的改善:年龄的增长伴随着骨矿含量逐渐减少,骨小梁体积分数下降,骨质疏松是中老年人常见的疾病之一,特别是绝经后的女性。一般认为雌激素可以直接调节骨对机械力的应答反应,有助于增加骨量。另一方面,运动能够引起骨的形变,进而产生适应性应答反应[28]。尤其是撞击性运动项目如跑步,对骨的机械性撞击可以增加骨密度、加强骨骼强度,是预防和减缓骨矿物质流失的有效方法。跑台运动常被用于骨质疏松动物模型的研究中。
这方面的报道中,很多都是针对雌激素缺乏而展开的研究,实际上,雄性激素不足也会加速骨量的流失。Wu等[29]对雄性激素缺乏的睾切小鼠进行4周的中等强度训练,速度为12 m/min,研究结果提示我们运动预防骨质疏松的良好作用不仅适用于绝经后的女性,也适用于性功能低下的老年男性。在雄性激素不足的情况下,运动对骨量流失的预防作用主要是通过抑制骨的吸收,并不是促进骨的生成[29]。
Leppänen等[28]对 47~61 周龄的成年大鼠和75~102周龄的老年大鼠进行研究,发现老年大鼠的骨矿含量等指标显著低于成年大鼠,说明老年组的骨架结构已经发生了恶化;14周的跑台运动后,老年大鼠的骨量显著增加,产生了适应性应答。等量负荷作用于相对不坚硬的骨骼上,会发生更大的变形,产生更强烈的应答反应,因此对老年大鼠骨吸收的抑制作用更显著。
跑台运动对骨的积极作用表现出位置的特异性,远端骨受到更强烈的地面作用力,运动的刺激作用更显著,Wu和Hamrick等许多实验研究都证实了这一点。12周龄的雌性小鼠每天跑30 min,每周5 d,共4周,速度为12 m/min,运动对股骨远端的成骨作用大于骨干,这种差异性是多种机制共同作用的结果[30]。例如,运动增加了干骺端骨小梁的表面积,为成骨细胞和破骨细胞的附着并活化提供了更大的接触区域;干骺端和骨干的生长发育机制不同,可能会导致机械敏感性的不同。另有研究对切除卵巢的5月龄Wistar雌性大鼠进行3个月的中等强度跑台训练,除了长骨和椎骨发生了有益的变化之外,鼻骨显著增厚,并且骨细胞的连接增加。Ocarino等[31]认为运动不仅可以通过机械力的作用直接调节骨量,还可以引起激素的改变,促使骨细胞中细胞因子的产生和生长因子的释放,间接促进骨量的增长。不过,关于运动如何引起骨细胞形态和活性的变化,有待进一步的研究。
承受体重较多的骨对跑台运动的敏感性更高,实验动物如大鼠在跑步时,四肢骨比中轴骨承受更多的负荷,运动对胫骨和股骨的作用大于腰椎。但是,人在跑步过程中,中轴骨和下肢骨都受到机械负荷。因此不能将跑步对大鼠腰椎的影响用于对人类的分析中。还有人指出大鼠的密质骨缺少以哈弗氏管为基础的再塑造,所以运动对大鼠骨骼的作用并不完全适用于人类。此外,关于运动对密质骨的影响,说法并不一致。不同研究使用的实验动物品系不一,不同年龄的骨骼发育程度不同等因素都会造成实验结果的差异,需要更全面的考虑,更深入的研究探讨。
4 小结
随着竞技体育和大众健身的全面发展,关于运动训练和运动康复的研究越来越深入,跑台运动作为一种典型的耐力训练方式被广泛应用于实验动物研究中。通过跑台运动建立的运动模型有助于深入理解训练对机体的作用和恢复手段等问题。另一方面,还可以利用跑台运动对运动疗法作用于生理和病理的机制和效果进行进一步的探究。但是,跑台运动在实验研究中的具体应用仍存在一些问题,尤其是运动强度的确定,需要综合考虑多方面的因素。
[1]肖明珠,郭庆芳.动物运动性疲劳方法学研究之一——不同刺激方法对大鼠跑台运动疲劳及恢复期糖代谢的影响[J].中国运动医学杂志,1998,17(4):334-338.
[2]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[3]田野,高铁群.大鼠运动性疲劳模型的建立[J].北京体育大学学报,1995,18(4):49-53.
[4]郑澜,陆爱云.运动性疲劳动物模型的研究[J].中国体育科技,2003,39(2):20-23.
[5]叶剑飞,余闽 ,岑浩望.过度训练的病理生理及康复Ⅰ大鼠过度训练模型的建立[J].中国运动医学杂志,1992,11(1):15-21.
[6]郑陆,隋波 ,潘力平,等.过度训练动物模型的建立[J].中国运动医学杂志,2000,19(2):179-181.
[7]张胜年,陆爱云.骨骼肌运动损伤实验研究中的动物模型[J].中国运动医学杂志,2000,19(2):185-188.
[8]陈英杰,郭庆芳,赵保路,等.延迟性肌肉损伤与自由基代谢异常-运动延迟性肌肉损伤机制探讨之二[J].中国运动医学杂志,1993,12(2):65-69.
[9]Chen J,Feller GM,Barbato JC,et al.Cardiac performance in inbred rat genetic models of low and high running capacity[J].Am J Physiol,2001,535:611-617.
[10]Buck BJ,Kerman IA,Burghardt PR,et al.Upregulation of GAD65 mRNA in the medulla of the rat model of metabolic syndrome[J].Neurosci Lett,2007,419(2):178-183.
[11]Lujan HL,Britton SL,Koch LG,et al.Reduced susceptibility toventricular tachyarrhythmias in rats selectively bred for high aerobic capacity[J].Am J Physiol Heart C,2006,291:2933-2941.
[12]Freeman K,Rivera CC,Olsson MC,et al.Progression from hypertrophic to dilated cardiomyopathy in mice that express a mutant myosin transgene[J].Am J Physiol Heart C,2001,280:151-159.
[13]Bostick B,Yue YP,Long C,et al.Cardiac expression of a minidystrophin that normalizes skelet al muscle force only partially restores heart function in aged mdx mice[J].Mol Ther,2009,17(2):253-261.
[14]Medeiros A,Vanzelli AS,Rosa KT,et al.Effect of exercise training and carvedilol treatment on cardiac function and structure in mice with sympathetic hyperactivity-induced heart failure[J].Braz J Med Biol Res,2008,41(9):812-817.
[15]Paroo Z,HaistJV,Karmazyn M,et al.Exerciseimproves postischemic cardia function in males but not females:consequences of a novel sex-specific heat shock protein 70 response[J].Circ Res,2002,90:911-917.
[16]WisloffU, Loennechen JP, Falck G, et al.Increased contractility and calcium sensitivity in cardiac myocytes isolated from endurance trained rats[J].Cardiovasc Res,2001,50:495–508.
[17]Emter CA,McCune SA,Sparagna GC,et al.Low-intensity exercise training delays onset of decompensated heart failure in spontaneously hypertensive heart failure rats[J].Am J Physiol Heart C,2005,289:2030-2038.
[18]Chicco AJ,McCune SA,Emter CA,et al.Low-intensity exercise training delays heart failure and improves survival in female hypertensive heart failure rats[J].Hypertension,2008,51:1096-1102.
[19]Yoshinari K,Yaoita H,Maehara K,et al.Different therapeutic responses to treadmill exercise of heart failure due to ischemia and infarction in rats[J].Cardiovasc Res,2005,65:457-468.
[20]Batista Jr.ML,Santos RVT,Oliveira EM,et al.Endurance training restores peritoneal macrophage function in post-MI congestive heart failure rats[J].J Appl Physiol,2007,102:2033–2039.
[21]Askew EW,Hecker AL.Adipose tissue cell size and lipolysis in the rat:response to exercise intensity and food restriction[J].J Nutr,1976,106:1351-1360.
[22]Bhattacharya A,Rahman MM,Sun DX,et al.The Combination of dietary conjugated linoleic acid and treadmill exercise lowers gain in body fat mass and enhances lean body mass in high fat-fed male Balb-C mice[J].J Nutr,2005,135(5):1124-1130.
[23]Ishikawa T,Mizunoya W,Shibakusa T,et al.Transforming growth factor-β in the brain regulates fat metabolism during endurance exercise[J].Am J Physiol Endoc M,2006,291:1151-1159.
[24]Applegate EA,Upton DE,Stern JS.Exercise and detrainingeffect on food intake, adiposity and lipogenesis in Osborne-Mendel rats made obese by a high fat diet[J].J Nutr,1984,114(2):447-459.
[25]Mazzeo RS,Horvath SM.Effects of training on weight,food intake and body composition in aging rats[J].Am J Clin Nutr,1986,44(6):732-738.
[26]Straczkowski M,KowalskaI,Straczkowska SD,et al.The effect of exercise training on glucose tolerance and skelet almuscle triacylglycerol content in rats fed with a high-fat diet[J].Diabetes Metab,2001,27(1):19-23.
[27]Smith AC,Mullen KL,Junkin KA,et al.Metformin and exercise reduce muscle FAT-CD36 and lipid accumulation and blunt the progression of high-fat diet-induced hyperglycemia[J].Am J Physiol Endoc M,2007,293:172-181.
[28]Leppänen OV,Sievänen H,Jokihaara J,et al.Pathogenesis of age-related osteoporosis: impaired mechano-responsiveness of bone is not the culprit[J].Plos One,2008,3(7):2540-2549.
[29]Wu J,Wang XX,Chiba H,et al.Combined intervention of exercise and genistein prevented androgen deficiency-induced bone loss in mice[J].J Appl Physiol,2003,94(1):335-342.
[30]Hamrick MW,Skedros JG,Pennington C,et al.Increased osteogenic response to exercise in metaphyseal versus diaphyseal cortical bone[J].J Musculoskelet Neuronal Interact,2006,6(3):258-263.
[31]Ocarino NM,Marubayashi U,Cardoso TGS,et al.Physical activity in osteopenia treatment improved the mass of bones directly and indirectly submitted to mechanical impact[J].J Musculoskelet Neuronal Interact,2007,7(1):84-93.
The Applications of Treadmill in the Study of Laboratory Animals
YAO Lu1,2,ZHANG Ying2,ZHANG Lian-feng1
(1.Key Laboratory of Human Disease Comparative Medicine,Ministry of Health,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences & Comparative Medical Center,Peking Union Medical College,Beijing 100021,China;2.Institnte of Human Sports Science,Beijing Sport University,Beijing 100084,China)
More and more applications of treadmill in laboratory animal studies are focused on the establishment of sport models and exploration on the effects of exercise on physiology and pathology,in order to promote scientific exercise training,better sports performance,reasonable and effective application of exercise therapy in the rehabilitation and so on.Also,the treadmill is a kind of tool for studying the relationships between exercise and metabolism or cardiocerebral vascular diseases.In this review,the basic structure of treadmill,its applying method and research progress are analyzed and summarized.
Treadmill;Sport model;Cardiovascular;Metabolism;Bone
R331
A
1671-7856(2010)06-0075-07
2009-01-07
姚璐(1985-),女,硕士,研究方向:运动生物化学。
张连峰。E-mail:zhanglf@mail.cnilas.org

