猕猴结肠镜下活检组织病理学观察
张虹雨,范晓娜,黄 敏,曹 毅,郑永唐
(1.中国科学院动物模型与人类疾病机理重点实验室,昆明 650223;2.中国科学院研究生院,北京 100049;3.昆明市第一人民医院消化内科,昆明 650011)
猕猴结肠镜下活检组织病理学观察
张虹雨*1,2,3,范晓娜*1,黄 敏3,曹 毅1,郑永唐1
(1.中国科学院动物模型与人类疾病机理重点实验室,昆明 650223;2.中国科学院研究生院,北京 100049;3.昆明市第一人民医院消化内科,昆明 650011)
目的 通过对猕猴结肠镜检及活检取材,对结肠镜检测方法应用于非人灵长类动物予以评价。方法实验猴在麻醉状态下接受结肠镜检查和活检标本取材,对活检标本进行固定和病理切片观察,并对所检猴进行解剖和组织学观察,比较各取材点的情况。结果 结肠镜下及大体标本观察见猕猴肠壁厚度明显小于人体,活检取材部位见黏膜破损、肠出血,个别部位见肠穿孔。病理切片HE染色观察发现,与人体比较,猕猴大肠腺较小而表浅,固有层内淋巴小结数量较少,肌层、黏膜下层明显较薄。结论 对猕猴行结肠镜检查及镜下活检取材是可行的,但因猕猴肠壁较人体薄而极易穿孔,故需尽量应用活检杯小的活检钳,并需要充分的肠道准备和有经验的肠镜操作。
猕猴;结肠镜;黏膜活检
猕猴是生理结构最接近人体的实验动物之一,对建立适合多种疾病研究的非人灵长类动物模型具有重要价值。胃肠道不仅是消化器官,胃肠黏膜具有的屏障功能和免疫特性参与很多重要疾病的病理改变和免疫反应过程。猕猴内镜检查及镜下活检已成为研究消化道疾病和免疫性疾病如AIDS的重要方法[1,2]。本实验采用结肠镜技术对猕猴结肠黏膜进行镜下观察、活检标本取材和切片观察,对结肠镜检测技术应用于非人灵长类动物消化系统和免疫系统研究进行初步探索。
1 材料和方法
1.1 受试动物
雄性猕猴2只,体重及年龄分别为:1号12.6 kg、13岁;2号13.5 kg、20岁。由中国科学院昆明动物研究所实验动物中心提供[SCXK(滇)2008-0001]。
1.2 麻醉药物
复方氯胺酮(100 mg/支)、3%苯巴比妥。
1.3 肠黏膜取材相关器材
动物实验手术台;膜式电动吸引器(天津市医疗器械二厂);CF-40L型纤维结肠镜(日本OLYMPUS公司);FB-210U一次性活检钳(肠镜)(日本 OLYMPUS公司);KA2411S一次性活检钳(十二指肠镜)(日本PENTAX公司);静脉输液器。
1.4 内镜检查和活检取材
术前对手术室进行紫外照射消毒3 h,对手术台用75%酒精进行擦拭,对结肠镜及其配件按照内镜常规消毒程序进行消毒。术前动物禁食24 h,因动物拒绝食用肠道准备用药(硫酸镁溶入动物食物及水中),故未行肠道准备。用复方氯胺酮(生理盐水5∶1稀释,0.1mL/kg)肌肉注射麻醉,待动物肌肉松弛,呼吸平稳,睫毛反射消失后,将动物固定于检测台上。以生理盐水配制的3%苯巴比妥对昏睡中的猕猴后肢静脉点滴注射,在术中巩固麻醉效果。内镜前端用石蜡油润滑,内镜经肛门依次进入直肠、乙状结肠、降结肠,检查过程中利用与肠镜相连的膜式电动吸引器,先注生理盐水后吸引,将肠腔内残余粪便清理干净。由于未行肠道准备,动物肠腔内有较多粪便,虽应用内镜注水、吸引器抽吸,仍残留较多干大便,故肠镜检查仅能到达降结肠。内镜下注气使肠腔充盈以充分暴露肠壁,注意观察各段肠腔及黏膜状况,并在结肠各段取黏膜活检。在结肠镜下对1号猕猴用 FB-210U一次性活检钳(肠镜),对2号猕猴用KA2411S一次性活检钳(十二指肠镜)分次夹取肠黏膜取材,将肠黏膜标本用滤纸粘取后放入包埋框中,福尔马林固定。对1号猕猴,手术结束后停止静脉注射麻醉药,等待其自然苏醒后将其抬回笼中,观察其饮食和身体状况。1号猕猴于术后第3天死亡,对尸体行病理解剖发现有结肠穿孔和腹腔感染,行全身取材,随后行大体观察及显微镜观察。对2号猕猴,手术结束后继续静脉注射麻醉药使猕猴达到深度麻醉直至死亡,对尸体行病理解剖、全身取材,随后行大体观察及显微镜观察。
2 结果(图1~2见彩插8)
2.1 结肠镜下观察
所见大肠肠壁菲薄,黏膜表面平坦,无绒毛,色泽淡红,黏膜下血管清晰可见;直肠、乙状结肠、降结肠各段未见明显半月形皱襞,如直肠Houston瓣。
2.2 大体标本观察
所取肠段可见结肠带及结肠袋等结构与人体相似,但肠壁厚度明显小于人体肠壁,降结肠和乙状结肠肠壁厚度平均为1.25±0.16mm。2只猕猴大肠肠壁活检取材点中,多数取材点充血水肿,仅累及黏膜层者无出血,累及黏膜下层及肌层者因有丰富的血管分布而发生出血。1号猕猴个别取材部位不仅明显出血,且因累及浆膜层而穿孔(图1)。
2.3 病理切片HE染色观察
猕猴大肠肠壁解剖层次与人体基本相同,即由内到外分别为:黏膜层(单层柱状上皮、固有层、黏膜肌层)、黏膜下层(结缔组织)、肌层(内环、外纵)、浆膜层。猕猴大肠肠壁病理切片HE染色观察发现,与人体比较,猕猴大肠腺较小而位置表浅,固有层内淋巴小结数量较少,肌层、黏膜下层明显较薄,而单层柱状上皮、黏膜肌层、浆膜层无明显差异。活检取材部位充血水肿,黏膜缺损多深达黏膜下层,部分伴有出血。1号猕猴的个别取材部位有穿孔,累及浆膜层(图2)。
3 讨论
3.1 动物肠道准备
人体肠镜检查前,予患者服用泻药(如硫酸镁、聚乙二醇、甘露醇、番泻叶等)以排尽粪便,肠腔清洁便于内镜观察和手术,称为肠道准备,此过程需要随药物服用大量的水。本实验未能对猕猴成功实施肠道准备,因为:(1)猴饮水很少,主要从水果中摄取身体所需水分,实验者曾尝试把泻药(硫酸镁)混入水及食物中让猕猴服下,但其并不配合。原因可能是猕猴凭其嗅觉和味觉发现食物及水中混有异物,故拒绝食用;(2)实验者曾设想将猕猴在麻醉状态下从口腔送入泻药以进行肠道准备,但此操作很容易引起动物误吸而致窒息死亡。因此本实验在肠镜操作过程中,一边向肠腔注水,一边利用电动吸引器吸引稀释后的粪便,从而达到部分的肠道清洁。
3.2 结肠镜检查及镜下活检取材
成年人大肠全长约1.5 m,肠壁厚度一般小于3mm;成年猕猴大肠长约 96~100cm[3],目前尚无关于猴大肠肠壁厚度的研究报道。我们观测到,成年猕猴大肠肠壁厚度约为1.25±0.16mm,明显小于正常成人肠壁。人体大肠的表面有三条与大肠纵轴平行的结肠带,由肠壁肌增厚形成。由于结肠带短于肠管,使肠管皱缩,形成由横沟隔开的囊状外突,称结肠袋。结肠带之间形成半月形皱襞,此部位相对周围肠壁较厚。为避免肠黏膜取材时挖取过深而导致穿孔,应选取半月形皱襞进行活检取材。在本实验中应用内镜依次观察猕猴直肠、乙状结肠、降结肠各段肠腔及黏膜,我们发现两个值得注意的现象:(1)与人体比较,猕猴大肠肠壁明显菲薄。(2)镜下所见猕猴肠壁不具有半月形皱襞或者不明显,这直接导致活检取材时无法确定其肠壁的不同厚薄分布。上述特点明显增加肠黏膜活检取材的并发症发生率,即肠出血和肠穿孔。因无专门针对动物的内镜活检钳,我们对1号猕猴采用肠镜专用活检钳实施肠镜下活检取材手术,结果猕猴死亡,解剖发现其死于肠穿孔。考虑到肠镜专用活检钳的活检杯口对猕猴肠壁来说较大,故我们对2号猕猴采用活检杯口最小的十二指肠镜专用活检钳实施手术,术后解剖未发现肠壁穿孔。这说明对猕猴行大肠黏膜活检取材时,应尽量选用活检杯口小的活检钳,以降低肠穿孔的发生率。
3.3 术后解剖观察
人体与猕猴肠壁的解剖层次基本相同,即由内到外分别为:黏膜层、黏膜下层、肌层、浆膜层。猕猴大肠肠壁活检取材点中,多数取材点充血水肿,仅累及黏膜层者无出血,累及黏膜下层及肌层者因有丰富的血管分布而发生出血;个别取材部位不仅明显出血,而且因累及浆膜层而造成穿孔。活检取材导致穿孔的原因可能是(1)人体降结肠和乙状结肠肠壁厚度平均为2.36±0.19mm[4],而猴肠壁较人更为菲薄,我们测量本实验中的2只猕猴降结肠和乙状结肠肠壁厚度平均为1.25±0.16mm,故应用肠镜活检钳取材易穿孔,需尽量采用活检杯小的十二指肠镜活检钳;(2)镜下应选取肠壁半月形皱襞进行活检取材,但本实验镜下所见猕猴肠壁不具有半月形皱襞或者不明显。猕猴大肠大体标本观察可见结肠带及结肠袋等结构,为何镜下半月形皱襞结构不明显,可能与肠镜充气使肠壁充盈有关,但仍无法完全解释此现象,有待进一步研究。
3.4 结肠镜应用于猕猴活体消化道检查和活检取材的前景
国内已有关于胃镜检查非人灵长类动物上消化道的实验研究,主要应用于观察、比较动物感染SHIV 前后胃及十二指肠黏膜的病理变化[5,6],目前国内尚无应用结肠镜检查猕猴并行活检取材的实验报道。成人胃壁厚度一般小于5mm,最常活检取材的胃窦区平均为3.58±0.25mm[7]。在临床及实验研究中应用胃镜活检技术很少发生穿孔,而肠镜活检发生肠穿孔的风险要大得多,甚至肠镜检查本身也可能引起肠穿孔,其主要原因即为肠壁厚度小于胃壁。人体肠镜活检取材技术常用于大肠癌、大肠息肉等病变的病理诊断。胃肠黏膜具有的屏障功能和免疫特性与许多重要疾病如胃肠恶性肿瘤、AIDS等的病理改变和免疫反应过程密切相关。所以观测猕猴的胃肠黏膜变化对研究消化系统疾病或其它疾病的消化道病变有重要价值。目前国内外应用猕猴已成功建立了AIDS等多种动物模型[1],建立成功的猕猴消化内窥镜检测技术对这些疾病的研究具有现实意义。本实验应用结肠镜技术对猕猴结肠黏膜进行镜下观察、活检标本取材和切片观察,对今后利用此技术对非人灵长类动物模型的消化道病变进行活体动态观察和检测积累了重要的经验。
致谢:作者感谢中科院昆明动物所免疫药理实验室提供一只实验猕猴。
[1]Brenchley JM,Schacker TW,Ruff LE,et al.CD4+T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract[J].J Exp Med,2004,200(6):749-759.
[2]Mehandru S,Poles MA,Tenner-Racz K,et al.Primary HIV-1 infection is associated with preferential depletion of CD4+T lymphocytes from effector sites in the gastrointestinal tract[J].J Exp Med,2004,200(6):761-770.
[3]叶智彰,彭燕章,张耀平.猕猴解剖[M].北京:科学出版社,1985:148.
[4]王锡明,武乐斌,李振家,等.多层螺旋CT在大肠分区及肠壁厚度测量中的价值[J].医学影像学杂志,2005,15(2):144-146.
[5]代小伟,朱华,刘颖,等.非人灵长类动物胃镜检测技术的建立[J].中国比较医学杂志,2008,18(9):75-77.
[6]刘颖,朱华,代小伟,等.SHIV感染恒河猴十二指肠黏膜活检组织病理学观察[J].中国比较医学杂志,2009,19(3):28-31.
[7]王锡明,武乐斌,李振家,等.螺旋CT在胃分区及胃壁厚度测量中的价值[J]. 医学影像学杂志,2001,11(5):290-292.
Pathological Observation of Colonic Biopsy Sample on Rhesus Macaques
ZHANG Hong-yu*1,2,3,FAN Xiao-na*1,HUANG Min3,CAO Yi1,ZHENG Yong-tang1
(1.Key Laboratory of Animal Models and Human Diseases Mechanisms,Kunming Institute of Zoology,the Chinese Academy of Sciences,Kunming 650223,China;2.Graduate School of the Chinese Academy of Sciences,Beijing 100049,China;3.Gastroenterology Department,The First People’s Hospital of Kunming,Kunming 650011,China)
Objective To evaluate the significance of coloscopy on Rhesus macaques'alimentary tract by using coloscopy and mucosa biopsy.Method Monkeys underwent coloscopy at the state of anesthesia.Thereafter post-mortem examination was carried out on the monkeys.The colonic biopsy and autopsy specimens were fixed,stained with hematoxylin and eosin,and observed pathologically.Results Punctate hemorrhages and perforations were observed in the biopsy sites.Compared with human colon,the wall of monkeys'colon was thinner,especially submucosa and muscular layer.The crypts of Lieberkuhn in the colon mucosa were smaller and more superficial,and there were less folliculus lymphaticus in the lamina propria.Conclusion It is feasible to apply coloscopy and mucosa biopsy on Rhesus macaque.Because Rhesus macaque's colon is thin and easy to perforate,a suitable biopsy forceps,sufficient bowel preparation and experienced operation are essential for a success of coloscopy and mucosa biopsy.
Rhesus macaque;Coloscopy;Mucosa biopsy
R332
B
1671-7856(2010)06-0066-03
2010-01-20
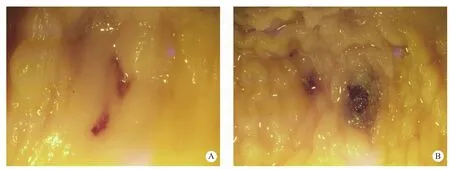
图1 猕猴结肠黏膜大体标本
Fig.1 Specimen of Rhesus Macaque's colonic mucosa
注:A:活检取材点出血;B:活检取材点穿孔
Note: A: haemorrhage in the biopsy site; B: perforation in the biopsy site
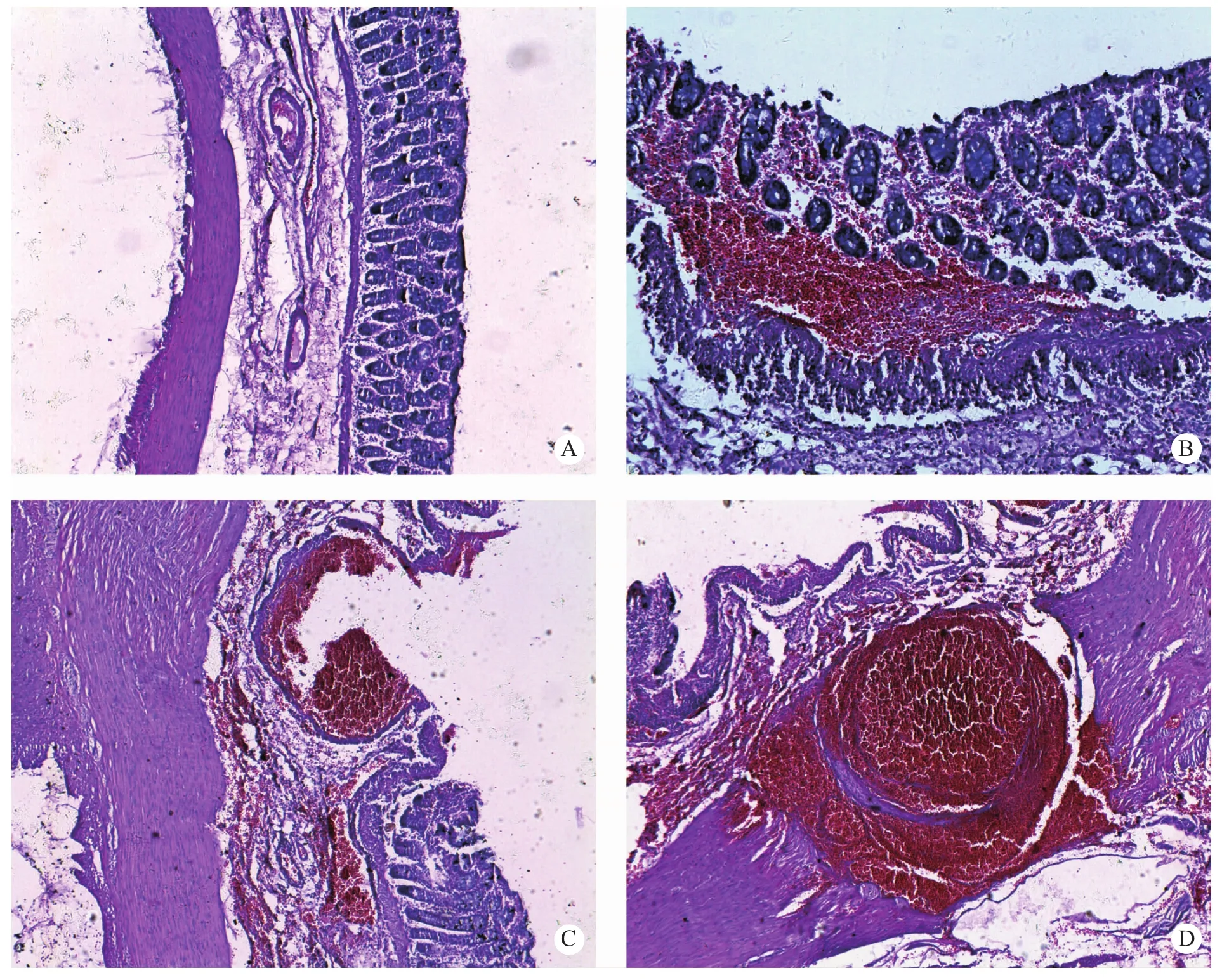
图2 猕猴结肠黏膜病理表现
Fig.2 Pathological appearance of Rhesus Macaque's colonic mucosa
注:A:正常结肠黏膜(HE×5);B:黏膜层出血(HE×20);C:活检取材点出血(HE×l0);D:活检取材点穿孔(HE×l0)
Note: A: normal colonic mucosa(HE×5); B: haemorrhage in mucous layer(HE×20);C: haemorrhage in the biopsy site(HE×l0); D: perforation in the biopsy site(HE×l0)
张虹雨,男,博士生,研究方向:黏膜免疫病理。范晓娜,女,助理研究员,研究方向:分子病理学。
*:共同第一作者。
曹毅,研究员,博士生导师。E-mail:caoy@mail.kiz.ac.cn

