食蟹猴血液学及血清生化指标日间节律性变化
曾宪成,马 璟,杨琛懋,姚昳舒,潘 严,潘 雯,周 超,姜子睿,潘学营
(上海医药工业研究院 国家上海新药安全评价研究中心,上海 201210)
食蟹猴血液学及血清生化指标日间节律性变化
曾宪成,马 璟,杨琛懋,姚昳舒,潘 严,潘 雯,周 超,姜子睿,潘学营
(上海医药工业研究院 国家上海新药安全评价研究中心,上海 201210)
目的 研究食蟹猴血液学及血清生化指标日间节律性变化,为正确全面评估血液学及血清生化测定结果提供一定的实验事实依据。方法 在9:30(am)~10:30(am)、12:30(pm)~13:30(pm)、15:30(pm)~16:30(pm)及19:30(pm)~20:30(pm)4个时间段对12只食蟹猴(雌雄各半)采血。采用全自动血细胞分析仪及血液生化分析仪分别测定血液学及血清生化指标。利用高效液相色谱(HPLC)方法分析血浆中皮质醇含量。结果 雌雄食蟹猴下午白细胞数(WBC)及尿素氮(BUN)显著升高;雌性食蟹猴下午血红蛋白(HGB)及血细胞压积(HCT)显著降低,天门冬氨酸氨基转换酶(AST)及丙氨酸氨基转换酶(ALT)活性显著升高;雄性食蟹猴下午血糖(GLU)及血浆皮质醇显著降低。结论 雌雄食蟹猴血液学及血清生化部分指标存在明显的日间节律性。
食蟹猴;血液学;血清生化;皮质醇;日间节律
对动物进行血液学及血清生化检测是目前药物药效及安全评价研究中一种常规方法[1]。部分指标的生理节律性现象已在大鼠(Rattus norvegicus)[1]、小型猪(Sus scrofa)[2]、比格犬(Canis familiaris)[3]、家兔(Oryctolagus cuniculus)[4]、猫头鹰猴(Aotus trivirgatus griseimembra)[5]、恒河猴(Macaca mulatta)及日本猴(Macaca fuscata)[6]等实验动物中发现,有关食蟹猴的研究尚未见报道。食蟹猴(Macaca fascicularis)已被广泛用于药效及药物安全评价研究[7-10]。在药效及药物安全评价研究中,通常在日间对食蟹猴进行血液采集。因此,本文主要研究食蟹猴血液学及血清生化指标的日间节律性变化,从而为正确全面评估血液学及血清生化测定结果提供一定的实验事实依据。
1 材料和方法
1.1 主要试剂和仪器
血细胞分析仪稀释液购自浙江金华鑫科医药科技有限公司。血清生化测定试剂来源于日本和光纯药工业株式会社。皮质醇及地塞米松标准品购自美国Sigma公司。色谱纯甲醇购自美国Fisher Scientific公司。色谱纯乙腈购自德国Merck公司。二氯甲烷、磷酸二氢钾、氢氧化钠、氢氧化钾及磷酸均为分析纯,购自上海国药集团化学试剂有限公司。
Medonic CA620全自动血细胞分析仪购自瑞典MEDONIC公司。HITACHI 7060型全自动血液生化分析仪购自日本日立公司。Waters高效液相色谱分析仪系统,配有510型泵、717 plus自动进样器、及486型紫外检测器,购自美国 Waters公司。ZORBAX Eclipse XDB-C18色谱分析柱(4.6mm×150mm,5 μm)购自美国安捷伦公司。Wondasil C18 I.D.色谱保护柱(4mm×10mm)购自上海安谱科学仪器有限公司。Heraeus Labofuge 400R台式多用离心机购自基因有限公司。AE240型电子分子天平购自梅特勒-托利多仪器(上海)有限公司。Milli-Q plus超纯水仪购自密理博(上海)贸易有限公司。pHST-4 pH计购自上海雷磁仪器厂。MD200-2氮气吹扫仪购自杭州奥盛仪器有限公司。XW-80C漩涡混合器购自上海医科大学仪器厂。TG16-W微量高速台式离心机,购自长沙湘仪离心机仪器有限公司。
1.2 实验动物
12只食蟹猴,雌雄各半,体重4~6 kg,年龄4~5岁,购自海南金港实验动物有限公司[SCXK(琼)2004-0001]。进行本试验时,上述猴在我动物房至少已饲养一年,且近两个月内没有接受任何试验。动物均被单独饲养于不锈钢笼具中(70cm×80cm×90cm),试验期间自由摄食和饮水,并辅以清洁水果。动物房温度维持在18℃~28℃ 相对湿度控制在40%~70%,室内空气每小时更换15~20次,每次均使用新鲜空气,光照强度150~300 lx,12 h光照/黑暗循环控制。
1.3 血液采集
所有动物在清醒状态下,每隔3~4 h采集一次血液,采血部位为左右前肢头静脉。第一次采血在9:30(am)~10:30(am)间完成,接下来三次采血时间段依次为12:30(pm)~13:30(pm)、15:30(pm)~16:30(pm)及19:30(pm)~20:30(pm)。每次采血量为1.6~2.0mL,其中0.6~1.0mL分装于血清用真空采血管中,用于血清生化指标检测;另1.0mL分装于EDTA-K2真空采血管中,用于血液学指标及皮质醇测定。
1.4 血液学指标测定
在采血后2 h内,将EDTA-K2真空采血管中血样置于Medonic CA620全自动血细胞分析仪进行白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血细胞压积(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)、红细胞平均血红蛋白浓度(MCHC)、血小板计数(PLT)及平均血小板体积(MPV)等血液学指标测定。
1.5 血清生化指标测定
在采血后2 h内,将血清生化管中血样离心(3500 r/min,4℃,10 min),将上层血清置于HITACHI 7060型全自动血液生化分析仪进行血清生化12项指标测定。具体指标及相应测定方法如下:天门冬氨酸氨基转换酶(AST),紫外速率法(UV-Rate);丙氨酸氨基转换酶(ALT),紫外速率法(UV-Rate);碱性磷酸酶(ALP),酶反应速率法(PNPP);尿素氮(BUN),尿素酶及谷氨酸脱氢酶(GIDH)法;总蛋白(TP),双缩脲法(Biuret);白蛋白(ALB),溴甲酚绿(BCG)法;血糖(GLU),己糖激酶及葡 萄糖-6-磷酸脱 氢酶(G-6-PDH)法;总胆红 素(TBIL),酶法(Enzyme);总胆固醇(CHOL),酶比色法(CHOD-PAP 法);肌酐(CREA),酶法(Enzyme);乳酸脱氢酶(LDH),紫外速率法(UV-Rate);及肌酸激酶(CK),紫外速率法(UV-Rate)。
1.6 血浆皮质醇测定
1.6.1 色谱条件:流动相:乙腈 -0.03 mol/L磷酸二氢钾(30∶70,体积比),用氢氧化钾及磷酸将0.03 mol/L磷酸二氢钾溶液 pH调至6.5;色谱柱:ZORBAX Eclipse XDB-C18 柱(4.6mm×150mm,5 μm),柱前连接 Wondasil C18 I.D.色谱保护柱(4mm×10mm);检测波长:254 nm;柱温:30℃;流速:1.0mL/min;进样量:100 μL。
1.6.2 血浆样品预处理:血液学指标测定后,将剩余全血离心(3500 r/min,4℃,10 min),取上层血浆放置于-70℃冰箱,待测。测定时,取血浆样品210 μL,加入内标(地塞米松甲醇溶液,5.5 ng/μL)及乙腈-H2O(30∶70)各 20 μL,再加入 2mL 二氯甲烷,30 s涡旋混匀后,4000 r/min离心20 min。将下层有机相依次用0.1 mol/L氢氧化钠溶液及超纯水洗涤,然后4000 r/min离心5 min(20℃),取下层有机相于空气流下(25℃)吹干。残留物以 150 μL乙腈-H2O(30∶70)复溶,16000 r/min离心2 min,吸取上清,进样100 μL。
1.7 统计学处理
使用SPSS 11.5软件进行统计处理。采用单因素重复测量方差分析比较采血时间对血液学、血清生化指标及皮质醇含量影响的显著性;利用LSD法进行组间均值的多重比较。
2 结果
2.1 血液学指标的日间节律性变化
雌雄食蟹猴下午的WBC均显著高于上午(P<0.01);雌性食蟹猴HGB及HCT则表现出反相的日间节律性变化(P<0.05)。其余指标虽然没有明显的日间节律性变化,但在某个时间段的测量值却会出现显著性变化(P<0.05)(表1,表2)。
表1 雄性食蟹猴血液学指标日间节律变化(n=6,±s)Tab.1Diurnal variations in hematological parameters in male cynomolgus monkeys(n=6,±s)

表1 雄性食蟹猴血液学指标日间节律变化(n=6,±s)Tab.1Diurnal variations in hematological parameters in male cynomolgus monkeys(n=6,±s)
注:与9:30~10:30相比,*P<0.05,**P<0.01Note:compared with 9:30~10:30,*P <0.05,**P <0.01
采血时间30 WBC 109/L 14.3±3.7 17.2±5.8 18.0±4.7** 18.1±3.9项目Item单位Unit Time of day 9:30~10:30 12:30~13:30 15:30~16:30 19:30~20:**RBC 1012/L 5.4±0.4 5.2±0.3* 5.2±0.2 5.4±0.3 HGB g/L 139.3±7.8 132.5±4.5* 134.8±6.0 137.3±7.2 HCT % 43.3±2.2 41.5±1.3* 42.3±1.8 42.7±2.4 MCV fL 79.9±2.6 80.0±2.5 80.6±2.4** 79.2±2.6**MCH pg 25.7±1.0 25.6±1.0 25.7±1.0 25.5±1.1 MCHC g/L 321.7±8.6 319.8±6.5 318.3±6.9* 321.8±6.1 PLT 109/L 278.2±45.0 283.0±47.9 279.8±43.8 283.0±55.5 MPV fL 9.5±0.8 9.5±1.1 9.3±0.9 9.6±0.8
表2 雌性食蟹猴血液学指标日间节律变化(n=6,±s)Tab.2Diurnal variations in hematological parameters in female cynomolgus monkeys(n=6,±s)
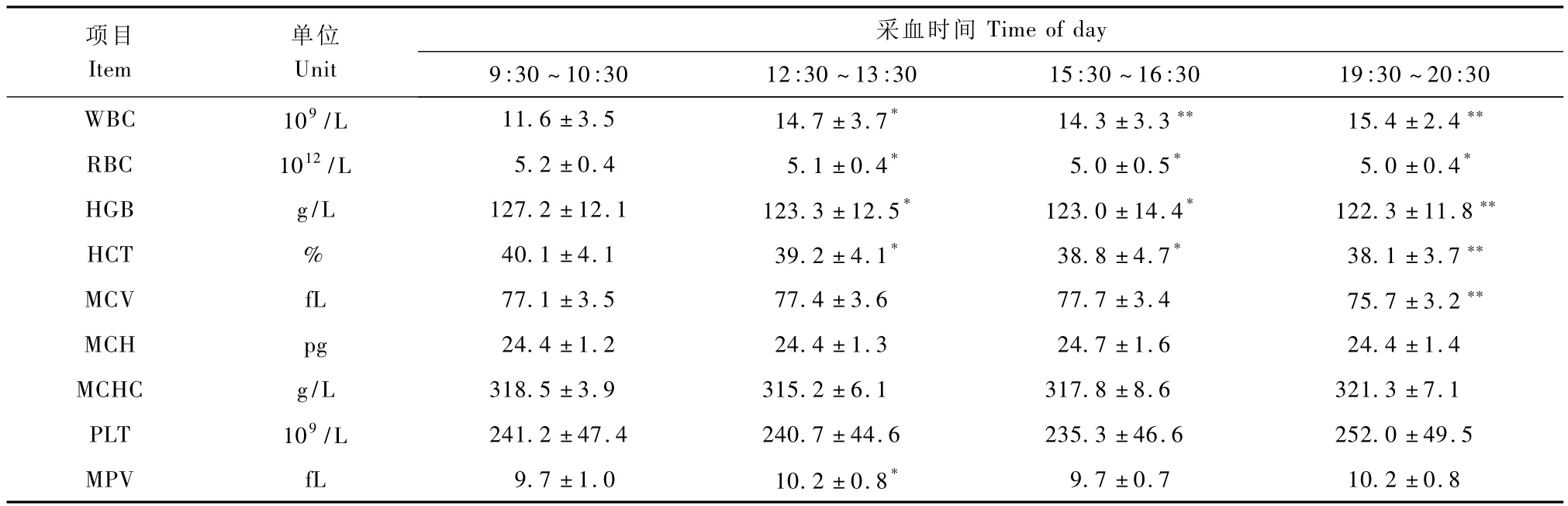
表2 雌性食蟹猴血液学指标日间节律变化(n=6,±s)Tab.2Diurnal variations in hematological parameters in female cynomolgus monkeys(n=6,±s)
项目Item采血时间30 WBC 109/L 11.6±3.5 14.7±3.7* 14.3±3.3** 15.4±2.4单位Unit Time of day 9:30~10:30 12:30~13:30 15:30~16:30 19:30~20:**9.7±0.7 10.2±0.8 RBC 1012/L 5.2±0.4 5.1±0.4* 5.0±0.5* 5.0±0.4*HGB g/L 127.2±12.1 123.3±12.5* 123.0±14.4* 122.3±11.8**HCT % 40.1±4.1 39.2±4.1* 38.8±4.7* 38.1±3.7**MCV fL 77.1±3.5 77.4±3.6 77.7±3.4 75.7±3.2**MCH pg 24.4±1.2 24.4±1.3 24.7±1.6 24.4±1.4 MCHC g/L 318.5±3.9 315.2±6.1 317.8±8.6 321.3±7.1 PLT 109/L 241.2±47.4 240.7±44.6 235.3±46.6 252.0±49.5 MPV fL 9.7±1.0 10.2±0.8*
2.2 血清生化指标的日间节律性变化
雄性食蟹猴血清BUN下午的测量值显著高于上午(P<0.01),而GLU变化趋势则刚好相反(P<0.01)。ALT及AST虽然没有表现出统计学差异,但是上下午测量均值波动幅度较大。ALP及TBIL测量值在某个时间段会出现显著性变化(P<0.05)(表3)。雌性食蟹猴血清 ALT、AST及BUN下午的测量值显著高于上午(P<0.05)。GLU及CK测量值会在某个时间段出现显著性变化(P<0.05)(表4)。
表3 雄性食蟹猴血清生化指标日间节律变化(n=6,±s)Tab.3Diurnal variations in biochemical values in male cynomolgus monkeys(n=6,±s)
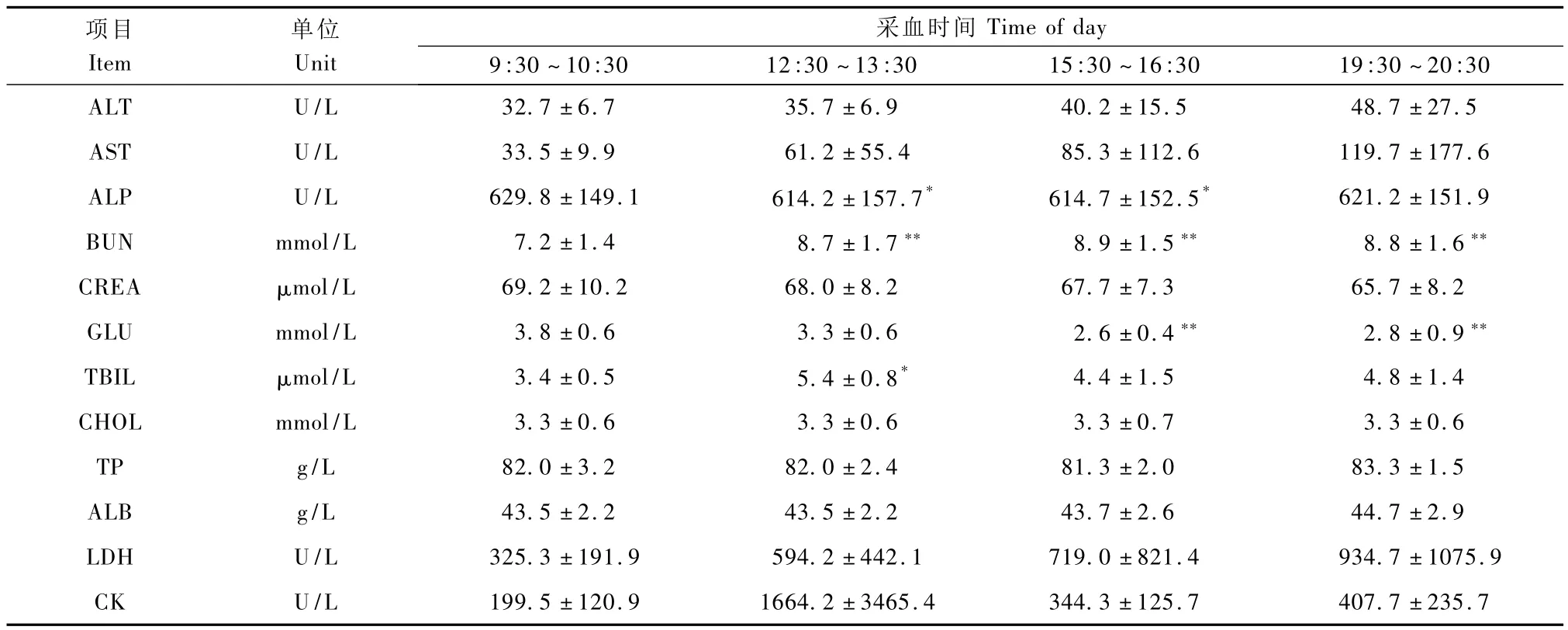
表3 雄性食蟹猴血清生化指标日间节律变化(n=6,±s)Tab.3Diurnal variations in biochemical values in male cynomolgus monkeys(n=6,±s)
注:与9:30~10:30相比,*P<0.05,**P<0.01Note:compared with 9:30~10:30,*P<0.05,**P<0.01
项目Item采血时间30 ALT U/L 32.7±6.7 35.7±6.9 40.2±15.5 48.7±27.5单位Unit Time of day 9:30~10:30 12:30~13:30 15:30~16:30 19:30~20:407.7±235.7 AST U/L 33.5±9.9 61.2±55.4 85.3±112.6 119.7±177.6 ALP U/L 629.8±149.1 614.2±157.7* 614.7±152.5* 621.2±151.9 BUN mmol/L 7.2±1.4 8.7±1.7** 8.9±1.5** 8.8±1.6**CREA μmol/L 69.2±10.2 68.0±8.2 67.7±7.3 65.7±8.2 GLU mmol/L 3.8±0.6 3.3±0.6 2.6±0.4** 2.8±0.9**TBIL μmol/L 3.4±0.5 5.4±0.8* 4.4±1.5 4.8±1.4 CHOL mmol/L 3.3±0.6 3.3±0.6 3.3±0.7 3.3±0.6 TP g/L 82.0±3.2 82.0±2.4 81.3±2.0 83.3±1.5 ALB g/L 43.5±2.2 43.5±2.2 43.7±2.6 44.7±2.9 LDH U/L 325.3±191.9 594.2±442.1 719.0±821.4 934.7±1075.9 CK U/L 199.5±120.9 1664.2±3465.4 344.3±125.7
表4 雌性食蟹猴血清生化指标日间节律变化(n=6,±s)Tab.4Diurnal variations in biochemical values in female cynomolgus monkeys(n=6,±s)
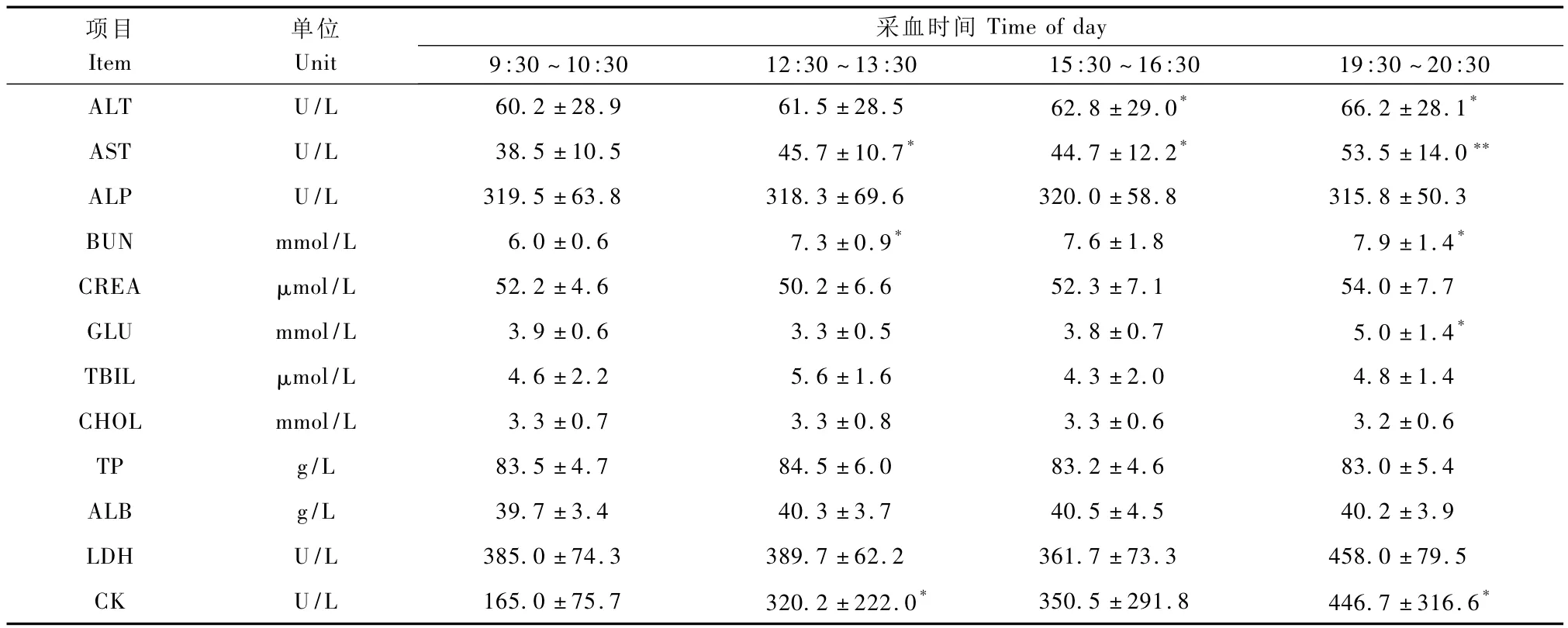
表4 雌性食蟹猴血清生化指标日间节律变化(n=6,±s)Tab.4Diurnal variations in biochemical values in female cynomolgus monkeys(n=6,±s)
注:与9:30~10:30相比,*P<0.05,**P<0.01Note:compared with 9:30~10:30,*P<0.05,**P<0.01
项目Item采血时间30 ALT U/L 60.2±28.9 61.5±28.5 62.8±29.0* 66.2±28.1单位Unit Time of day 9:30~10:30 12:30~13:30 15:30~16:30 19:30~20:*AST U/L 38.5±10.5 45.7±10.7* 44.7±12.2* 53.5±14.0**ALP U/L 319.5±63.8 318.3±69.6 320.0±58.8 315.8±50.3 BUN mmol/L 6.0±0.6 7.3±0.9* 7.6±1.8 7.9±1.4*CREA μmol/L 52.2±4.6 50.2±6.6 52.3±7.1 54.0±7.7 GLU mmol/L 3.9±0.6 3.3±0.5 3.8±0.7 5.0±1.4*TBIL μmol/L 4.6±2.2 5.6±1.6 4.3±2.0 4.8±1.4 CHOL mmol/L 3.3±0.7 3.3±0.8 3.3±0.6 3.2±0.6 TP g/L 83.5±4.7 84.5±6.0 83.2±4.6 83.0±5.4 ALB g/L 39.7±3.4 40.3±3.7 40.5±4.5 40.2±3.9 LDH U/L 385.0±74.3 389.7±62.2 361.7±73.3 458.0±79.5 CK U/L 165.0±75.7 320.2±222.0* 350.5±291.8 446.7±316.6*
2.3 血浆皮质醇日间节律性变化
皮质醇测定不受其它内源性物质及内标(地塞米松)干扰(图1)。血浆皮质醇在20~1280 ng/mL范围内线性关系良好,相关系数大于0.999,准确度绝对值不大于15.0%。由20、160及640 ng/mL三个浓度计算的日内及日间精密度均不大于6.2%。上述三个浓度的提取回收率(76.5±2.4)%、(79.0±1.3)%及(88.0±1.0)%,内标提取回收率(95.8±2.4)%。血浆皮质醇下午测定值显著低于上午(P<0.05),且呈逐渐下降趋势(图2)。在19:30~20:30采集血浆中,有2只食蟹猴皮质醇含量低于20 ng/mL,为了便于统计故将它们的含量记为20 ng/mL。
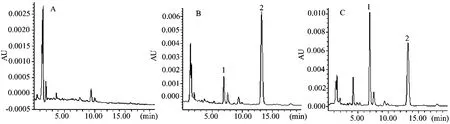
图1 皮质醇标准品及血浆样品色谱图Fig.1 Chromatograms of cortisol standard and plasma sample
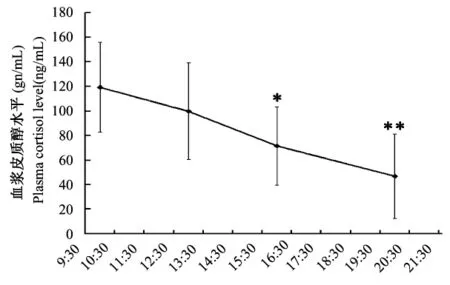
图2 6只雄性食蟹猴血浆皮质醇含量日间节律变化Fig.2 Diurnal variations of plasma cortisol level in six male cynomolgus monkeys.
3 讨论
Pocock等[11]研究了 7685例英国中年男子血液学及血清生化25项指标的日间节律性变化,WBC及BUN下午的测量值高于上午,而 HGB及HCT则刚好相反。在本次研究中,雌雄食蟹猴也表现出类似的变化规律。但是,Terao等[6]在恒河猴及日本猴中没有观察到WBC显著的生理节律性变化。虽然本文雄性食蟹猴ALT及AST各个时间段的测量值无显著性差异,但其日间节律变化不应被忽视,因为6只雄猴中有5只均表现出下午测量值高于上午。上述统计上的无显著性可能与个体测量值间变异较大有关,因为较大的组内变异将影响组间差异的比较[12]。血液学及血清生化测定在新药安全评价研究中发挥着重要作用。非人灵长类实验动物临床化学数据已被证明与动物种属[13]及饲养环境[14,15]有关。本研究的结果表明,食蟹猴血液学及血清生化指标测定值还与采血时间有关。因此,在进行食蟹猴临床化学测定时,应该保证血液样品采集时间的一致性,否则在解释临床化学数据时应该充分考虑采血时间对结果的影响。
研究动物血液学及血清生化的生理节律性现象必然要多次采血。目前,多采用静脉插管技术进行多次连续采血以消除动物保定时的应激反应[2,6]。但是上述实验设计需要较长的试验周期和更为周到的饲养管理,因为动物需要一段时间的术前适应期和术后恢复期以及术后和实验过程的监护管理等[6,16]。动物在清醒状态下保定采血必将受到不同程度的应激刺激[16],而应激可能会扰乱动物的生理节律[17,18]。但是如果对动物进行一定时期的训练使其适应采血操作,并且优化采血条件比如动物不移出笼具,缩短采血时间及动物熟识人员采血,可以消除采血过程中的应激[16,19]。本试验所采用的食蟹猴在本单位至少饲养了一年,在日常健康检查及药物安全评价试验中接受过数次采血操作,并且本试验的血液样本由专门负责其饲养管理的人员采集,采血时动物并不移出饲养笼具。因此,本文的采血操作对动物的应激较小。本研究中,血浆皮质醇水平呈现逐渐下降的趋势,一方面进一步证明了非人灵长类动物血浆皮质醇具有生理节律性[20,21],另一方面也表明采血并没有对动物造成应激。
综上所述,雌雄食蟹猴血液学及血清生化部分指标存在明显的日间节律性。我们在试验设计及结果分析时必须全面考虑取样时间对上述测定结果的影响。
[1]Minematsu S, Watanabe M, Tsuchiya N, et al. Diurnal variations in blood chemical items in Sprague-Dawley rats[J].Exp Anim,1995,44(3):223-232.
[2]Tsutsumi H,Monnai Y,Ishii H,et al.Diurnal variations and effects of fasting on blood constituents in minipigs[J].Exp Anim,1999,48(4):247-254.
[3]Lilliehook I.Diurnal variation of canine blood leukocyte counts[J].Vet Clin Pathol,1997,26(3):113-117.
[4]Fox RR, Laird CW.Biochemical parameters of clinical significance in rabbits.II.Diurnal variations[J].J Hered,1970,61(6):265-268.
[5]Klein R,Bleiholder B,Jung A,et al.Diurnal variation of several blood parameters in the owl monkey,Aotus trivirgatus griseimembra[J].Folia Primatol(Basel),1985,45(3-4):195-203.
[6]Terao K,Suzuki J,Ohkura S.Circadian rhythm in circulating CD16-positive natural killer(NK)cells in macaque monkeys,implication of plasma cortisol levels[J].Primates,2002,43(4):329-338.
[7]Bleavins MR,de la Iglesia FA.Cynomolgus monkeys(Macaca fascicularis)in preclinical immune function safety testing:development of a delayed-type hypersensitivity procedure[J].Toxicology,1995,95(1-3):103-112.
[8]Nishimura M,Koeda A,Morikawa H,et al.Comparison of Inducibility of multidrug resistance (MDR)1,multidrug resistance-associated protein(MRP)1,and MRP2 mRNAs by prototypical microsomal enzyme inducers in primary cultures of human and cynomolgus monkey hepatocytes[J].Biol Pharm Bull,2008,31(11):2068-2072.
[9]Liu A,Xie S,Sun H,et al.Myotoxicity of gemfibrozil in Cynomolgus monkey model and its relationship to pharmacokinetic properties[J].Toxicol Appl Pharm,2009,235(3):287-295.
[10]Su C,Cao H,Tan S,et al.Toxicology profiles of a novel p53-armed replication-competent oncolytic adenovirus in rodents,felids,and nonhuman primates[J].Toxicol Sci,2008,106(1):242-250.
[11]Pocock SJ,Ashby D,Shaper AG,et al.Diurnal variations in serum biochemical and haematological measurements[J].J Clin Pathol,1989,42(2):172-179.
[12]李武选.统计显著性、实际显著性及实际重要性[J].统计与决策,2008(4):145-146.
[13]王冬平,,隋丽华,洪宝庆,等.食蟹猴与猕猴血液生理和生化指标的比较[J].中国比较医学杂志,2007,17(7):400-403.
[14]唐贤丽,徐龙建,久田,等.实验用食蟹猴的生物学指标[J].中国比较医学杂志,2007,17(6):325-328.
[15]张六一,张玲,王振宇,等.食蟹猴血液学和生化学指标数据背景资料的建立[J].四川生理科学杂志,2005,27(1):39-40.
[16]Suzuki J,Ohkura S,Terao K.Baseline and stress levels of cortisolin conscious and unrestrained Japanese macaques(Macaca fuscata)[J].J Med Primatol,2002,31(6):340-344.
[17]Barriga C,Martin MI,Tabla R,et al.Circadian rhythm of melatonin,corticosterone and phagocytosis:effect of stress[J].J Pineal Res,2001,30(3):180-187.
[18]Couto-Moraes R,Palermo-Neto J,Markus RP.The immunepineal axis:stress as a modulator of pineal gland function[J].Ann NY Acad Sci,2009,1153:193-202.
[19]Reinhardt V,Cowley D,Scheffler J,et al.Cortisol response of female rhesus monkeys to venipuncture in homecageversus venipuncture in restraint apparatus[J].J Med Primatol,1990,19(6):601-606.
[20]Plant TM. Time courses of concentrations of circulating gonadotropin,prolactin,testosterone,and cortisol in adult male rhesus monkeys(Macaca mulatta)throughout the 24 h light-dark cycle[J].Biol Reprod,1981,25(2):244-252.
[21]Hotchkiss CE,Jerome CP.Evaluation of a nonhuman primate model to study circadian rhythms of calcium metabolism[J].Am J Physiol,1998,275(2 Pt 2):R494-R501.
Diurnal Variations of Hematological and Biochemical Parameters in Cynomolgus Monkeys(Macaca fascicularis)
ZENG Xian-cheng,MA Jing,YANG Chen-mao,YAO Yi-shu,PAN Yan,PAN Wen,ZHOU Chao,JIANG Zi-rui,PAN Xue-ying
(National Shanghai Center for Drug Safety Evaluation and Research&Shanghai Institute of Pharmaceutical Industry,Shanghai 201210,China)
Objective To investigate the diurnal variations of hematological and biochemical parameters in cynomolgus monkeys.Methods The blood samples were collected in 12 cynomolgus monkeys(6 of each sex)at 9:30(am)~10:30(am),12:30(pm)~13:30(pm),15:30(pm)~16:30(pm)and 19:30(pm)~20:30(pm).The hematological and biochemical parameters were determined with automated hematological and biochemical analyzers respectively.The plasma cortisol levels were determined by high-performance liquid chromatography(HPLC).Results White blood count(WBC)and blood urea nitrogen(BUN)increased significantly in the afternoon in male and female monkeys.Hemoglobin(HGB)and hematocrit(HCT)markedly reduced in the afternoon in female monkeys.The activities of asparate aminotransferase(AST)and alanine aminotransferase(ALT)significantly increase in the afternnon in female monkeys.The serum glucose and plasma cortisol reduced significantly in the afternoon in male monkeys.Conclusions Parts of the hematological and biochemical parameters show obvious diurnal variation in male and female cynomolgus monkeys.
Cynomolgus monkey;Hematology;Serum biochemistry;Cortisol;Diurnal variation
Q461;R331
A
1671-7856(2010)06-0043-06
2010-01-21
创新药物重大专项 (2008ZX0935-006)。
曾宪成(1981-),男,博士生,研究方向:分子毒理学。
马璟,女,医学博士,研究员,硕士生导师,研究方向:分子药理及毒理学。E-mail:jma@ncdser.com

