调血脂药阿托伐他汀钙的合成研究进展
张宜凡,虞心红
(1.上海医药高等专科学校药学系,上海 201318; 2.华东理工大学药学院,上海 200137)
随着对高脂血症的不断研究和综合治疗经验的积累,治疗高脂血症的药物品种及其使用情况也在不断地发生变化[1]。3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,简称他汀类(statins)药物,由于作用机制新颖,应用范围较广,疗效显著,毒副反应小,耐受性好,被认为是目前最为经典和有效的调血脂药[2-3]。阿托伐他汀是第3代HMG-CoA还原酶的选择性、竞争性抑制剂,对原发性高胆固醇血症、高甘油三酯血症、家族性高胆固醇血症和混和性高脂血症等各种类型的血脂异常均有效。阿托伐他汀钙(atorvastatin calcium)的商品名为立普妥(Lipitor),化学名为(R,R)-2-(4-氟苯基)-β,γ-二羟基-5-(1-甲基乙基)-3-苯基-4-苯胺基酰基-1H-吡咯-1-庚酸钙盐(2∶1)三水化合物,分子式C66H68CaF2N4O10·3H2O,相对分子质量为1 209.42。其化学结构由两部分组成,即有取代的吡咯环结构(主环)和手性3,5-顺式二羟基庚酸结构(侧链)。目前已有不少文献报道了阿托伐他汀钙的合成路线,归纳起来即两种主要的合成方法。
1 方法一(线性合成)[4-6]
1.1 取代的吡咯环的合成
以2-溴-对氟苯乙酸乙酯为原料,通过氨基化,酰胺化和皂化反应得到2-[N-异丁酰基-N-2-(1,3-二氧戊环-2-)乙基]氨基-对氟苯乙酸,然后与N,3-二苯基丙炔酰胺环合,水解,得到关键中间体3-[2-(4-氟苯基)-5-异丙基-3-苯基-4-苯胺基酰基]-1H-吡咯-丙醛(图1)。

图1 取代的吡咯环的合成(线性合成第一步)
1.2 苯乙胺拆分方法
关键中间体继续与乙酰乙酸甲酯在碱性条件下发生缩合反应,然后用硼氢化钠在三丁基硼的条件下还原羰基,经重结晶后得到反式的阿托伐他汀内酯。利用(R)-2-甲基-苄胺为拆分剂,经手性拆分得到光学纯的阿托伐他汀钙(图2)。
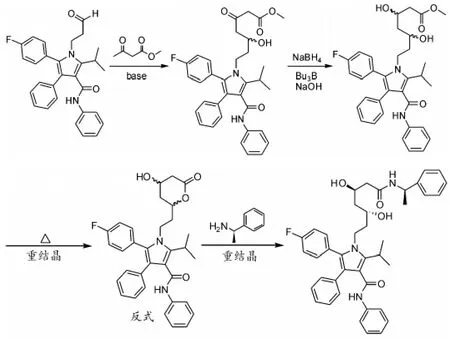
图2 苯乙胺拆分路线(线性合成第二步)
1.3 手性 Adoal缩合
关键中间体在手性乙酸酯和强碱二异丙胺基锂(LDA)的作用下发生手性的Adoal缩合反应,得到手性的羟基吡咯戊酸酯。该化合物甲基化后在LDA条件下与乙酸叔丁酯缩合,然后用硼氢化钠在三乙基硼的条件下对羰基进行手性还原,水解成盐后得到阿托伐他汀钙(图3)。

图3 手性Adoal缩合(线性合成第三步)
2 方法二
方法二是首先制备手性的3,5-顺式二羟基庚酸片断,然后与1,4-二羰基化合物环合得到吡咯环结构(汇聚合成)[7-10],合成路线见图4。也有文献报道用叠氮基取代的侧链与1,4-二羰基化合物环合得到吡咯环结构[11]。
化合物 4-氟-α-(2-甲基 -1-氧丙基)-γ-氧-N,β-二苯基-苯丁酰胺是采用汇聚式合成方法合成阿托伐他汀钙的一个重要中间体。根据文献报道,该化合物的合成方法主要有两种,但均需要异丁酰乙酰苯胺这样一个关键的中间体。以丙二酸和丙酮为原料,首先缩合得到Meldrum's acid,然后与异丁酰氯发生酰化反应,接着酯化,氨解,得到异丁酰乙酰苯胺(图5)。文献[12]在此基础上作了改进,苯胺可直接与中间体异丁酰基取代的Meldrum's acid在甲苯的条件下回流反应得到异丁酰乙酰苯胺,此步骤的收率达97%。
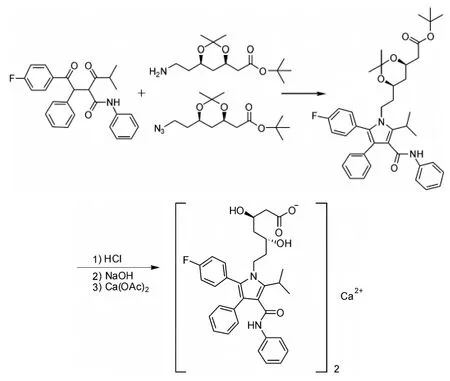
图4 汇聚合成路线

图5 异丁酰乙酰苯胺的合成
得到异丁酰乙酰苯胺后,第1种方法是以苯乙酸为原料,经傅-克酰基化、溴化,得到2-溴-1-(4-氟苯基)-苯乙酮,然后在碱性条件下与异丁酰乙酰苯胺发生α-碳上的取代反应,最终得到4-氟-α-(2-甲基 -1-氧丙基)-γ-氧-N,β-二苯基 -苯丁酰胺(图6),总收率为72%[13](以苯乙酰氯为原料计)。
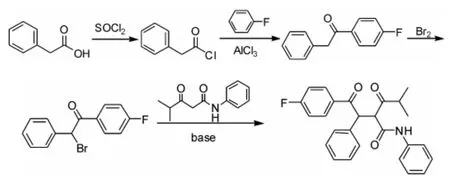
图6 汇聚合成重要中间体的合成方法一
第2种方法是以异丁酰乙酰苯胺为原料,在β-丙氨酸作用下与苯甲醛发生Knoevenagel缩合,得到α,β-不饱和酮衍生物[14-15]。然后在碱性条件下,利用噻唑衍生物为催化剂,与对氟苯甲醛发生Stetter反应,得到4-氟-α-(2-甲基-1-氧丙基)-γ-氧-N,β-二苯基-苯丁酰胺(图7),总收率为68%[13]。

图7 汇聚合成重要中间体的合成方法二
通过比较上述两种方法不难发现,第2种方法所需原料对氟苯甲醛价格昂贵,Stetter加成所需的催化剂不易得,且有恶臭味。第1种方法的合成步骤虽然较多,但原料价廉易得,各步副反应少,易于提纯,所用试剂均较常见,可为寻找一条适合大规模、工业化生产的工艺路线提供借鉴。
3 结语
随着我国人口老龄化进程和城市化发展的加速,我国高脂血症的发病率和发病人数将会继续增长。近年来,由于他汀类药物能降低冠心病患者的死亡率及减少脑卒中和心肌梗死的发生率,在调血脂药中仍处于主导地位。可以预见,在不断研究与开发具新作用机制的调血脂药的同时,开发与他汀类药物联用的复方制剂是今后调血脂药的主要研究方向。
[1]杨诗杰,苏汝好,项 岚,等.降血脂药的应用现状及研究进展[J].医药论坛杂志,2006,27(1):90-93.
[2]李玉鸣.他汀类药物的研究进展[J]中西医结合心脑血管病杂志,2007,5(10):987-988.
[3]邱国应.他汀类药物的临床应用新进展[J].中国心血管病研究,2006,4(8):638-640.
[4]Roth BD.Trans-6-[2-(3- or 4-carboxamido-substituted pyrrol-1-yl)alkyl]-4-hydroxypyran-2-one inhibitors of cholesterol synthesis,US4681893[P].1987-07-21.
[5]Roth BD,Blankley CJ,Chucholowski AW,et al.Inhibitors of Cholesterol Biosynthesis.3.Tetrahydro-4-hydroxy-6-[2-(1H-pyrrol-1-yl)ethyl]-2H-pyran-2-oneinhibitors of HMG-CoA reductase.2.Effects of introducting substituents at positions three and four of the pyrrole nucleus[J].J Med Chem,1991,34(1):357-366.
[6]Roth BD.[R-(R,R)]-2-(4-fluorophenyl)-β,γ-dihydroxy-5-(1-methylethyl-3-phenyl-4-[(phenylamino)carbonyl]-1H-pyrrole-1 heptanoic acid,its lactone from and salts thereof,US5273995[P].1993-12-28.
[7]ButlerDE,DeeringCF,MillerA,etal.Processfortrans-6-[2-(substituted-pyrrol-1-yl)alkyl]pyran-2-one inhibitors of cholesterol synthesis,US5003080[P].1991-03-26.
[8]Peter KN,Zoltan G,Jozsef B,et al.Salts of 2,2-dimethyl-1,3-dioxane intermediates and process for the preparation thereof,WO00/68221[P].2000-11-16.
[9]Butler DE,Le TV,Nanninga TN.Process for trans-6-[2- (substitutedpyrrol-1-yl)alkyl]pyran-2-one inhibitors of cholesterol synthesis,US5298627[P].1994-03-29.
[10]Butler DE,Le TV,Nanninga TN.Process for the synthesis of(5R)-1,1-dimethylethyl 6-cyano-5-hydroxy-3-oxo-hexanoate,US51-55251[P].1992-10-13.
[11]Ohrlein R,Baisch G.Chemo-enzymatic approach to statin side-chain building blocks[J].Advanced Synthesis & Catalysis,2003,345(6-7):713-715.
[12]Chen BC,Sundeen JE,Guo P,et al.Synthesis of deuterium-labeled atorvastatin and its metabolites for use as internal standards in a LC/MS/MS method developed for quantitation ofthe drug and its metabolites in human serum[J].J.Labelled Cpd Radiopharm,2000,43(3):261-270.
[13]范朋高,蒋妮丽.4-氟-α-(2-甲基 -1-氧丙基)-γ-氧-N,β-二苯基-苯丁酰胺的合成[J].中国药物化学杂志,2005,15(1):48-50.
[14]Kai-Uwe S,Jemima H.Preparation process for an inhibitor,WO03/004457 A2[P].2003-02-16.
[15]Baumann KL,Butler DE,Deering CF,et al.The convergent synthesis of CI-981,an optically active,highly potent,tissue selective inhibitor of HMG-CoA reductase[J].Tetrahedron Letters,1992,33(17):2 283-2 284.

