7S伴大豆球蛋白及其糖基化产物对大豆11S球蛋白热聚集的影响
孙炜炜,于淑娟*
(华南理工大学轻工与食品学院,广东 广州 510640)
7S伴大豆球蛋白及其糖基化产物对大豆11S球蛋白热聚集的影响
孙炜炜,于淑娟*
(华南理工大学轻工与食品学院,广东 广州 510640)
研究7S伴大豆球蛋白(β-伴大豆球蛋白)及其糖基化产物对大豆11S球蛋白热聚集的影响。从浊度、ξ-电位、粒度、SDS-PAGE测定得出在30mmol/L Tris-HCl缓冲溶液中(含β-巯基乙醇),7S球蛋白及其糖基化产物能够抑制11S球蛋白的热聚集,并且糖基化产物的抑制效果比未糖基化的7S球蛋白明显;7S球蛋白及其糖基化产物抑制11S球蛋白热聚集的机理不同,7S球蛋白糖基化产物对11S球蛋白热聚集的抑制不是由于电荷的作用。
7S伴大豆球蛋白;大豆11S球蛋白;糖基化;热聚集
Abstract :The effects of β-conglycinin and glycated β-conglycinin on the thermal aggregation of glycinin was studied. Evidence was presented to suggest that β-conglycinin and glycated β-conglycinin could both prevent thermal aggregation of glycinin in 30 mmol/L Tris-HCl buffer solution (β-Me exsisted). Further, addition of glycatedβ-conglycinin prevented thermal aggregation of glycinin more obviously than β-conglycinin. The results also indicated that the inhibitory mechanism of glycated βconglycinin on glycinin aggregation was not as same as that of β-conglycinin due to charge-charge interactions.
Key words:β-conglycinin;glycinin;glycosylation;thermal aggregation
热处理是大豆加工过程中常用的方法之一,大豆蛋白在热诱导过程中会不可避免的产生宏观聚集体[1]。7S伴大豆球蛋白(β-伴大豆球蛋白)和大豆11S球蛋白是大豆蛋白的主要储藏蛋白,分别占大豆蛋白总含量的37%和31%[2]。大豆11S球蛋白在有还原剂的溶液中会产生明显的热聚集现象,添加 7S伴大豆球蛋白可以通过电荷的作用抑制11S球蛋白的热聚集[3]。
食品中蛋白质的糖基化是指通过蛋白质的ε-氨基基团与多糖的还原性羰基末端反应得到共价复合物[4]。糖基化产物对于环境条件具有较高的适应性,与以次级力结合的蛋白质-多糖体系相比,其结合不受热或pH值的影响[5]。糖基化对蛋白质的表面荷电量、热稳定性、表面疏水性等均有影响,而这些性质往往是影响蛋白质热聚集的重要因素[6-7]。由于接入糖链的不同,糖基化对蛋白质热聚集的影响并非完全一样[8]。对7S球蛋白抑制11S球蛋白热聚集的性质,许多学者已经做过研究,但尚未见学者研究过糖基化的7S球蛋白对11S球蛋白热聚集的影响。
本实验主要从浊度、ξ-电位、粒度、SDS-PAGE电泳方面研究7S球蛋白及其不同分子质量的糖基化产物(G67、G150、G500)在有还原剂存在的Tris-HCl缓冲溶液中对11S球蛋白热聚集的抑制作用,为进一步开展通过糖基化抑制大豆蛋白热聚集的研究提供指导。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕(氮可溶性指数>80) 山东新嘉华公司;葡聚糖(67、150、500kD) Sigma公司。
所有化学试剂均为分析纯;实验用水为去离子水。
1.2 仪器与设备
CR22GⅡ高速冷冻离心机 Hitachi Koki 公司;UV-2300分光光度计 上海天美科学仪器有限公司;ECP3000 SDS-PAGE三恒电泳仪 北京市六一仪器厂;DNP-9082电热恒温培养箱 上海精宏试验设备有限公司;NaNo-Zs马尔文纳米粒度分布仪 英国Marlvern公司。
1.3 方法
1.3.1 7S球蛋白和11S球蛋白的分离纯化
7S球蛋白依照Nagano等[9]的方法制备,制备流程如下:

1.3.2 7S球蛋白糖基化产物的制备
将7S蛋白粉与葡聚糖以质量比1:1混合后,用水溶解调至6g/100mL后冷冻干燥。干燥后的粉状物过120目筛后放置于干燥器内于60℃条件下干热反应,保持相对湿度79%,并在容器底部放置饱和的KBr溶液,反应一周后即得糖基化产物[10]。7S球蛋白与分子质量为67、150、500kD的葡聚糖反应的糖基化产物分别记为G67、G150、G500。
1.3.3 热聚集实验
不同pH值的热聚集实验:11S球蛋白分别与等量的7S球蛋白及其糖基化产物(以7S球蛋白计)混合均匀后溶于不同pH值的30mmol/L Tris-HCl缓冲溶液中(含10 mmol/L β-巯基乙醇)于80℃水浴30min[11],冷却至室温测定浊度和ξ-电位。
不同离子强度的热聚集实验:11S球蛋白分别与等量的7S球蛋白及其糖基化产物(以7S球蛋白计)混合均匀后溶于不同离子强度(以NaCl 调节)Tris-HCl缓冲溶液中(pH8),于80℃水浴保温30min,冷却至室温测定浊度和ξ-电位。
1.3.4 浊度测定
根据Damodaran等[3]的方法,分别取1.3.3节热聚集实验中的样品液于波长540nm处测定浊度。
1.3.5 ξ-电位测定
采用马尔文纳米粒度分布仪测定添加7S球蛋白及其糖基化产物的11S球蛋白溶液热聚集后的ξ-电位。波长和散射角度分别固定在632nm和90°,操作温度为室温(25℃)。
1.3.6 粒度测定
采用马尔文纳米粒度分布仪测定添加7S球蛋白及其糖基化产物的11S球蛋白溶液热聚集前后的粒径分布。波长和散射角度分别固定在632nm和90°,操作温度为室温(25℃)。
1.3.7 SDS-PAGE电泳
按照Laemmli[11]的方法在不连续的缓冲体系中进行,使用12%分离胶和4%浓缩胶。样品以相同比例溶于还原性的缓冲液(10% SDS,2.5%β-巯基乙醇)中,然后在沸水中加热5min,于6000×g离心3min,以一定比例上样。电泳过程恒流,浓缩胶电流40mA,分离胶电流调至80mA,溴酚蓝前沿至封口胶时关闭电源。电泳结束后将凝胶进行考马斯亮蓝染色40min,使用脱色液(甲醇、冰乙酸、水体积比为1:1:8)脱色至透明,于凝胶成像系统进行成像处理。
2 结果与分析
2.1 浊度测定
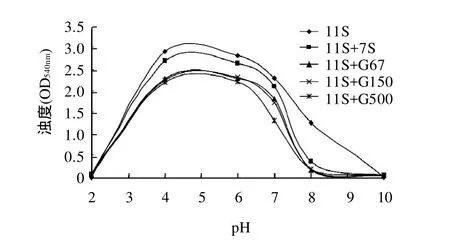
图1 不同pH值缓冲溶液中7S球蛋白及其糖基化产物对11S球蛋白热聚集的影响Fig.1 Effects of β -conglycinin and glygatedβ - conglycinin on the thermal aggregation of glycinin under different pH conditions
由图1可见,在还原剂存在下,11S球蛋白的宏观聚集主要是由碱性亚基发生聚集[4]。各组分的浊度都是随着pH值的增大,先升高后降低,在pH4.8附近浊度最大,偏酸或偏碱均不利于热聚集。加入7S球蛋白及其糖基化产物后的11S球蛋白溶液的浊度低于11S,且加入7S球蛋白的浊度高于加入其糖基化产物。相比较而言,G500的浊度低于G67和G150(二者浊度曲线相近)。此结果表明7S球蛋白具有抑制11S球蛋白热聚集的性质,由于大分子糖链的接入,导致7S球蛋白空间位阻增大,使得热聚集程度变得更小,难以形成可溶性的宏观聚集体,溶液浊度降低。接入到7S球蛋白肽链上的葡聚糖分子质量越大,空间位阻越大,因此G500比其他两种糖基化产物的浊度低。这说明糖基化有利于增强7S球蛋白对11S球蛋白热聚集的抑制作用。
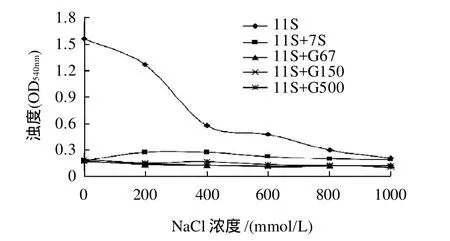
图2 不同离子强度(NaCl)的缓冲溶液中7S球蛋白及其糖基化产物对11S球蛋白热聚集的影响Fig.2 Effects of β -conglycinin and glygatedβ - conglycinin on the thermal aggregation of glycinin under different ionic strength conditions
由图2可知,11S球蛋白溶液浊度随着NaCl离子强度的增加而降低,盐离子浓度的增加有利于抑制11S球蛋白热聚集[4],其余组分浊度受离子强度影响不是很大。加入7S球蛋白及其糖基化产物溶液的浊度低于11S球蛋白溶液,并且加入7S球蛋白的浊度高于加入其糖基化产物浊度,3种糖基化产物的浊度曲线相近。此结果表明,7S球蛋白及其糖基化产物能够抑制11S球蛋白的热聚集,但离子强度不是影响其抑制效果的主要因素,糖基化产物的抑制效果比7S球蛋白好,其原因与2.1节中的原因相似。这同样说明糖基化有利于增强7S球蛋白对11S球蛋白热聚集的抑制作用。
2.2 ξ-电位测定
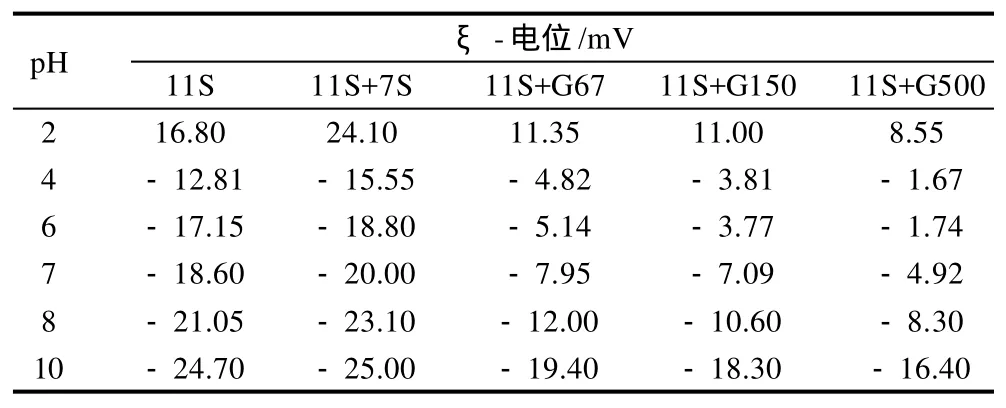
表1 不同pH值溶液中添加7S球蛋白及其糖基化产物的11S球蛋白溶液加热后ξ-电位的变化Table 1 Changes in z-potential of glycinin in the presence of βconglycinin or its glycated counter part under different pH conditions after heating at 80 ℃ for 30 min
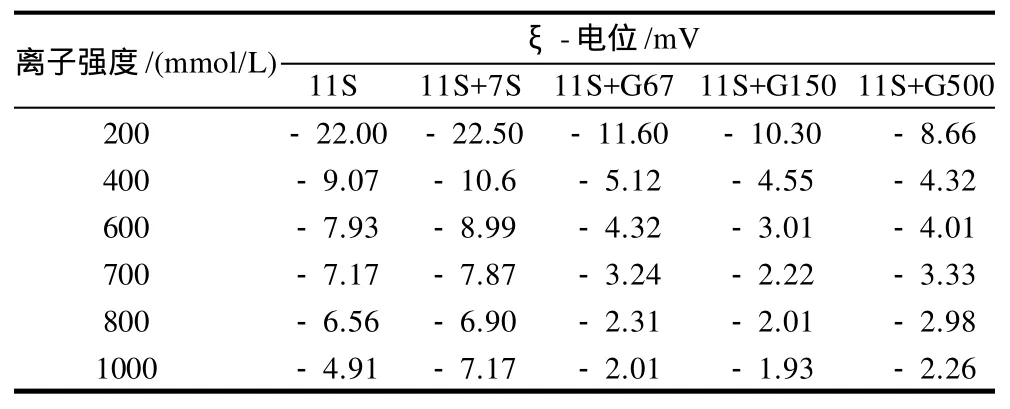
表2 不同离子强度溶液中添加7S球蛋白及其糖基化产物的11S球蛋白溶液加热后ξ-电位的变化Table 2 Changes in z-potential of glycinin in the presence of β-conglycinin or its glycated counter part under different ionic strength conditions after heating at 80 ℃ for 30 min
从表1、2可以看出,加入7S球蛋白的11S球蛋白溶液的ξ-电位比未加入7S球蛋白的偏低,7S球蛋白对11S球蛋白热聚集的抑制作用主要是由于电荷的作用[3],7S球蛋白的加入增加了体系中的负电荷量,ξ-电位的绝对值越大,说明溶液体系越稳定[12]。加入7S球蛋白糖基化产物的11S球蛋白溶液的ξ-电位绝对值始终低于加入11S球蛋白溶液的ξ-电位,然而由2.1节得出的结论是加入7S球蛋白糖基化产物的溶液体系比加入7S球蛋白的溶液稳定。这说明电荷不是决定其体系稳定性的主要因素,可能是由于接入长的糖链,使得体系空间位阻增大而抑制了11S球蛋白的热聚集;中性葡聚糖的接入屏蔽掉了7S球蛋白表面的部分电荷,使得其ξ-电位升高,表面疏水性降低。7S球蛋白糖基化产物抑制11S球蛋白热聚集的机理与7S球蛋白的抑制聚集机理存在一定差异。
2.3 粒度测定
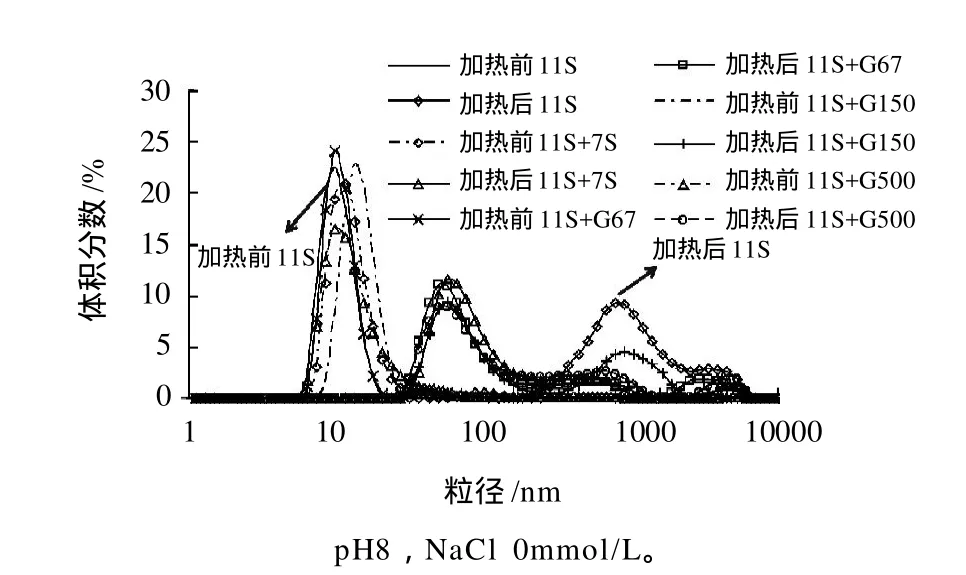
图3 添加7S及其糖基化产物的11S溶液加热后的粒度变化Fig.3 Changes in particle size of soybean glycinin solution in the presence of β-conglycinin or its glycated counter part after heating 30 min
由图3可见,11S球蛋白溶液加热后,粒径明显增加至1000nm左右,加入7S球蛋白及其糖基化产物的11S球蛋白溶液加热前的粒径和未加入的相差不大,但加热后的粒径仅增大至60nm左右,并且加入7S球蛋白糖基化产物的粒径略小于加入7S球蛋白,这说明加入7S球蛋白抑制了11S球蛋白的热聚集,糖链的接入进一步抑制了体系中宏观聚集体的生成,这也印证了2.1节浊度测定的结果。
2.4 SDS-PAGE电泳
取pH8、离子强度为0mmol/L(NaCl)的Tris-HCl缓冲溶液溶解大豆球蛋白[13],各溶液加热前、后上清液和沉淀的SDS-PAGE图谱见图3。
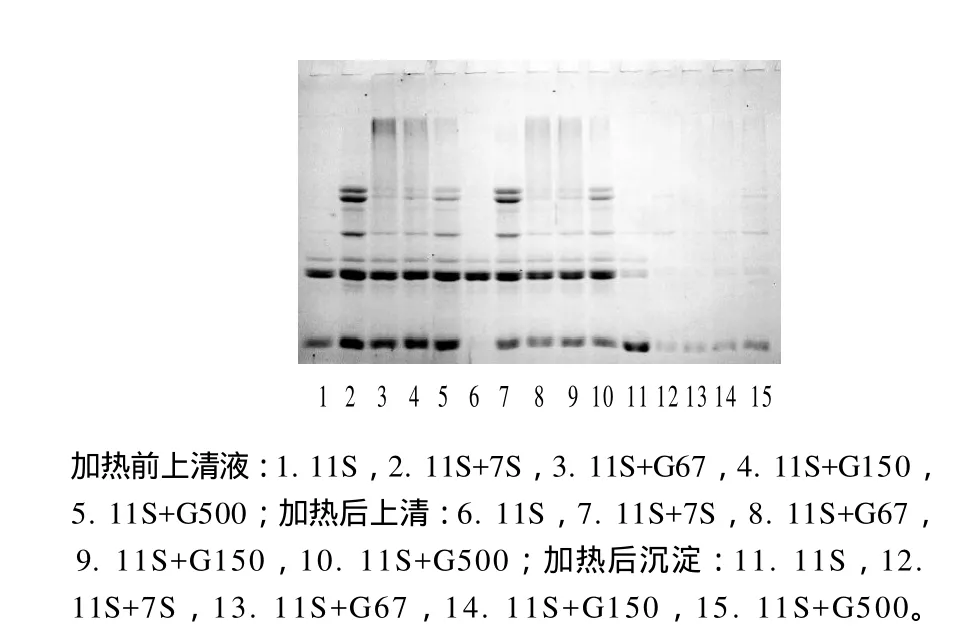
图4 加热前、后大豆球蛋白溶液的电泳图谱Fig.4 SDS-PAGE of soybean glycinin solution before and after thermal treatment at 80 ℃ for 30 min
图3显示,11S球蛋白溶液加热后,上清液中的碱性亚基消失而出现在沉淀的图谱中,11S球蛋白加热后产生的宏观聚集体主要由11S球蛋白的碱性亚基组成[14]。碱性亚基并未出现在加热后的沉淀中,7S球蛋白抑制了11S球蛋白碱性亚基的聚集,这与资料报道一致[15]。条带3、8、13显示了G67和7S球蛋白一样能够抑制11S的热聚集。同样,其他条带显示了G150和G500对11S的热聚集也具有抑制作用。
3 结 论
7S球蛋白及其糖基化产物都具有抑制11S球蛋白热聚集的性质,并且糖基化产物的抑制效果优于未糖基化的7S球蛋白;二者抑制11S球蛋白热聚集的机理不同,糖基化的7S球蛋白对11S球蛋白热聚集的抑制机理还有待于进一步研究。7S球蛋白糖基化可以作为一种抑制大豆蛋白热聚集的新方法,对于我国丰富的大豆资源来说,无疑是一种很好的拓宽其应用范围的途径。
[1] 周瑞宝, 周兵. 大豆7S和11S球蛋白的结构和功能性质[J]. 中国粮油学报, 1998, 6(13): 39-42.
[2] 李向红, 刘展, 李伟, 等. 干燥方法对大豆分离蛋白热诱导聚集体的影响[J]. 农业工程学报, 2008, 24(10): 258-261.
[3] DAMODARAN S, KINESELLA J E. Effect of conglycinin on the thermanl aggregation of glycinin[J]. Food Chemistry, 1982, 30: 812-817.
[4] 莫重文. 蛋白质化学与工艺学[M]. 北京: 化学工业出版社, 2007: 179-183.
[5] 齐军茹, 杨晓泉, 廖劲松, 等. 大豆蛋白与多糖的干热反应研究[J].食品科学, 2005, 26(12): 45-47.
[6] KATO Y, AOKI T, KATO N, et al. Improvement of protein heat stability and emulsifying activity[J]. Journal of Agricultural and Food Chemistry, 1995, 43: 301-305.
[7] AOKI T, HIIDOME Y, KITAHATA K, et al. Improvement of heat stability and emulsifying activity of ovalbumin by conjugation with glucuronic acid through the Maillard reaction[J]. Food Research International, 1999, 32: 129-133.
[8] LI Xianghong, CHENG Yunhui, YI Cuiping, et al. Effect of ionic strength on the heat-induced soy protein aggregation and the phase separation of soy protein aggregate/dextran mixtures[J]. Food Hydrocolloids, 2009,23(3): 1015-1023.
[9] NAGANO T, HIROTSUKA M, MORI H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Agric Food Chem, 1992, 40: 941-944.
[10] 齐军茹, 杨晓泉, 廖劲松, 等. 大豆球蛋白与葡聚糖的干热反应特性[J]. 中国粮油学报, 2005, 20(6): 79-82.
[11] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[12] 章莉娟. 胶体与界面化学[M]. 广州: 华南理工大学出版社, 2006: 97-100.
[13] 李云, 华欲飞, 李向红. 大豆蛋白预先热聚集对其凝胶性质的影响[J]. 食品科技, 2007(2): 29-32.
[14] 杨晓泉. 大豆蛋白的改性技术研究进展[J]. 广州城市职业学院学报,2008, 2(3): 37-44.
[15] 朱建华, 杨晓泉, 陈刚. 大豆7S球蛋白和11S球蛋白的研究[J]. 粮油加工与食品机械, 2003(8): 37-39.
Effects ofβ-Conglycinin and Glycatedβ-Conglycinin on the Thermal Aggregation of Glycinin
SUN Wei-wei,YU Shu-juan*
(College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
TS214.2
A
1002-6630(2010)15-0159-04
2010-03-23
国家自然科学基金项目(20776050);广东省自然科学基金项目(7006508)
孙炜炜(1988—),男,硕士研究生,主要从事大豆蛋白与多糖的糖基化反应研究。E-mail:sunweiwei409@yahoo.com.cn
*通信作者:于淑娟(1955—),女,教授,博士,主要从事制糖工程、碳水化合物分子修饰研究。E-mail:lfshjyu@scut.edu.cn

