大粒车前子多糖酸碱稳定性和热稳定性研究
殷军艺,聂少平*,林慧霞,李 昌,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
大粒车前子多糖酸碱稳定性和热稳定性研究
殷军艺,聂少平*,林慧霞,李 昌,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
探讨大粒车前子多糖在不同条件下的稳定性。从大粒车前子中提取、分离和纯化得到均一多糖(Plantago asiatica L. polysaccharide,PLP),考察PLP经酸碱(HCl溶液或NaOH溶液)处理后其表观黏度、粒度和单糖组成等方面的变化,并采用热重-差热同步分析仪(TG-DTA)考察PLP的热稳定性。结果表明:酸碱处理对PLP表观黏度、粒度和单糖组成等方面有一定影响。酸处理后(pH值约为2.7),PLP表观黏度和粒度增加,阿拉伯糖和木糖的物质的量的比值变化不大;碱处理后(pH值约为11.4),PLP表观黏度和粒度减小,木糖比例有一定程度下降。PLP原液加热后再冷却,粒度增大。热稳定性分析表明PLP在250℃开始发生降解,550℃基本结束。
大粒车前子;多糖;稳定性
Abstract:In this study, the effect of acidic and alkaline treatments on the monosaccharide composition, apparent viscosity and granularity on a polysaccharide fraction (detected to contain a single component) purified from Plantago asiatica L. seeds.Meanwhile, the thermal stability of the polysaccharide fraction was analyzed using thermal gravity-differential thrermal analysis(TG-DTA). The results showed that acidic and alkaline treatments both had certain effect on the apparent viscosity and monosaccharide composition of the polysaccharide fraction. After acidic treatment (approximately pH 2.7), the apparent viscosity and average granularity diameter of the polysaccharide fraction both increased, but the xylose/arabinose molar ratio changed little.However, alkaline treatment (approximately pH 11.4) resulted in a decrease in apparent viscosity, average granularity diameter and xylose/arabinose molar ratio. Heating followed by cooling resulted in an increase in average granularity diameter. The TG-DSC analysis showed that the polysaccharide fraction began to degrade at 250 ℃ and the degradation ended at 550 ℃.
Key words:Plantago asiatica L. seeds;polysaccharide;stability
车前子为大粒车前(Plantago asiatica L.)或平车前(Plantag depressa Willd.)的干燥成熟种子[1], 夏、秋二季种子成熟时采收果穗,晒干,搓出种子,除去杂质。车前子被我国卫生部列为可用于保健食品的物品,也是我国传统中医用药之一。车前子多糖具有良好的润肠通便[2]、降血脂[3]、补体[4]、抑菌[5]等生物活性。近期研究表明,车前子多糖还具有良好免疫活性[6-7]。此外,车前子多糖还可以作为面包中谷蛋白替代品[8],或者用于城市景观设计、治理环境污染等[9-10]。
研究发现,多糖受热会发生一定程度降解[11];车前子胶(多糖)流变性也受到温度和pH值等因素的影响[12],但未进行深入研究。本实验室已从大粒车前子中提取、分离和纯化得到均一多糖组分(Plantago asiatica L. polysachanide,PLP),现拟考察PLP在不同酸碱作用下,粒度、表观黏度和单糖组成变化等,并考察PLP的热稳定性,以期为车前子和车前子多糖的基础研究以及产品开发提供参考。
1 材料与方法
1.1 材料与试剂
大粒车前子 江西吉安。
SephacrylTMS-400 HR葡聚糖凝胶填料 Amersham Biosciences公司;D-半乳糖、鼠李糖、D-甘露糖、D-木糖、D-核糖、L-岩藻糖和D-阿拉伯糖 上海国药试剂公司;葡萄糖、无水乙醇、丙酮、乙醚、氯仿、正丁醇、氯化钠、盐酸羟胺、吡啶等均为国产分析纯。
1.2 仪器与设备
6890N 型气相色谱仪(GC) 美国Agilent公司;ALPHA 1-2冷冻干燥机 德国Martin Christ公司; TPYRIS DIAMOND同步热分析仪 美国PE公司;Brookfield DVIII ULTRA程序流变仪、CPE-40转子 美国Brookfield公司;PSSNICOMP 380 ZLS激光纳米粒度测定仪 美国PSS公司;AL 104电子天平 上海梅特勒-托利多仪器公司;PHS-3B精密pH计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 PLP的制备
称取干燥车前子100g加入80%乙醇浸泡24h,双层滤布过滤后挥干乙醇。加500mL蒸馏水,沸水浴回流提取3h,离心分离后双层滤布过滤,滤渣重复提取一次,合并滤液,真空浓缩。加入质量分数0.15%木瓜蛋白酶作用2h后,再用Sevag法脱蛋白,反复进行3次至无蛋白层,然后用流动自来水透析48h,蒸馏水透析24h,透析液真空浓缩。于4℃冰箱中醇沉过夜(80%乙醇),离心分离,沉淀依次用无水乙醇、丙酮、乙醚各洗两次,冷冻干燥得粗制车前子多糖(Plantago asiatica L. crude polysaccharide,PLCP)。
SephacrylTMS-400 HR(2.4cm ×60cm)葡聚糖凝胶层析柱分离纯化PLCP。流动相:0.15mol/L NaCl;流速:1.25mL/min,按4mL/管收集。苯酚-硫酸法跟踪检测多糖,绘制洗脱曲线,收集峰尖部分记为PLP,经检测为单一组分。
1.3.2 酸碱处理对PLP单糖组成的影响
取PLP溶液(2mg/mL)用0.1mol/L NaOH溶液或0.1mol/L HCl溶液分别调至酸性(pH2.72)或碱性(pH11.44),作用3h后充分透析后冻干样品。气相分析单糖组成[13]。色谱柱:DB1701石英毛细管柱(30m×0.25mm,0.2μm),固定液为SE-54;FID检测器,载气为N2。程序升温:初始温度170℃,保持2min,以10℃/min升至250℃,250℃维持20min;色谱柱温度:250℃;进样口和检测器温度:250℃;进样量1μL,分流比20:1。
1.3.3 酸碱处理对PLP粒度的影响
用HCl溶液或NaOH溶液调节PLP溶液(2mg/mL)的pH值,激光粒度分布仪测定多糖粒度变化。
1.3.4 酸碱处理对PLP表观黏度的影响
用HCl溶液或NaOH溶液调节PLP溶液(2mg/mL)的pH值,程序流变仪(转子为CPE-40)测定流变性。
1.3.5 车前子多糖热稳定性分析
采用同步热分析仪分析PLP粉末热稳定性。分析条件为:扫描温度为30~700℃,升温速度为20℃/min,N2流量为100mL/min。
2 结果与分析
2.1 酸碱处理对PLP单糖组成影响
将衍生得到的糖腈乙酸酯进行GC分析[13],混合标样衍生物的气相色谱图见图1。8种单糖衍生物除岩藻糖衍生物和阿拉伯糖衍生物没有完全分离外,其他均得到较好地分离。
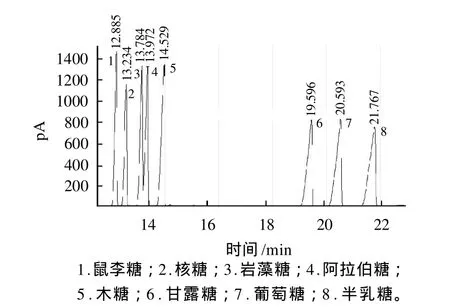
图1 标准单糖糖腈乙酸酯衍生物的GC图Fig.1 GC chromatogram of aldoononitrile acetate derivatives of monosaccharide standards
表1 酸碱处理对PLP单糖组成的影响(±s,n=3)Table 1 Effect of acidic and alkaline treatments on the monosaccharide composition of the polysaccharide fraction from Plantago asiatica L. seeds(±s,n=3)

表1 酸碱处理对PLP单糖组成的影响(±s,n=3)Table 1 Effect of acidic and alkaline treatments on the monosaccharide composition of the polysaccharide fraction from Plantago asiatica L. seeds(±s,n=3)
项目 原液 pH2.72处理 pH11.44处理木糖与阿拉伯糖物质的量比 1.84±0.05 1.88±0.03 1.50±0.05
PLP主要组成单糖为阿拉伯糖和木糖,因此本实验主要考察了酸碱处理对PLP中木糖和阿拉伯糖含量变化的影响。从表1看出,酸碱处理对PLP中的木糖与阿拉伯糖物质的量比影响有所不同,在酸性条件下,两者相对含量变化不大,但是在碱性条件下,阿拉伯糖相对含量升高,说明碱性条件很有可能使PLP中木糖发生了降解。
2.2 酸碱及热处理对PLP粒度的影响
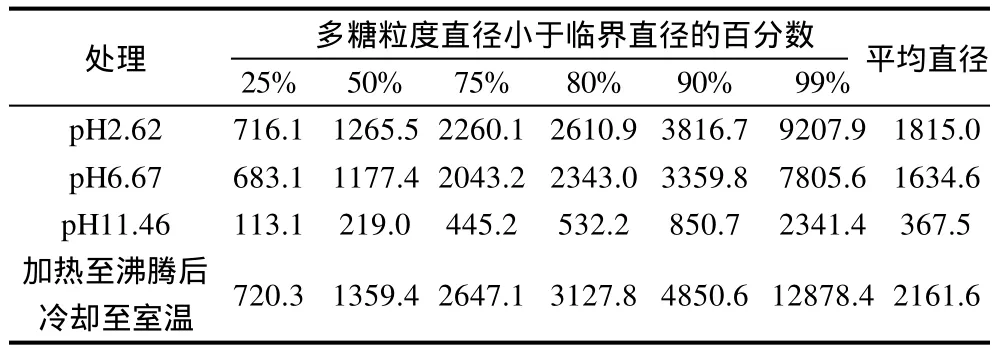
表2 不同处理对PLP粒度的影响Table 2 Effect of acidic and alkaline treatments on the granularity of the polysaccharide fraction from Plantago asiatica L. seeds nm
由表2可知,由于PLP分散性差,即使在较低质量浓度(1.09×10-2mg/mL)下,多糖粒度较大,所得到的粒度分布图不对称,有一定的波动,测定结果仍不是很理想。但不同酸碱条件下PLP的粒度分布发生了一定改变,特别是当pH值为11.46时,PLP粒度分布变化最大,主要集中在113.1~532.2nm。PLP原液加热后再冷却,粒度分布有一定变化,主要集中在720.3~3127.8nm,这可能是由于PLP中存在大量的羟基和羧基,在加热条件下多糖原先聚集的分子解缠绕后发生伸展,使分子相互作用的位点增加,当冷却时这些分子又重新聚集,形成更大的聚集体[14]。
2.3 酸碱处理对PLP表观黏度的影响

图2 酸碱处理对PLP溶液表观黏度的影响Fig.2 Effect of acidic and alkaline treatments on the apparent viscosity of solution of the polysaccharide fraction from Plantago asiatica L. seeds
由图2可以看出,pH值对PLP溶液表观黏度影响很大,基本上随着溶液pH值的增加而降低。当pH值为2.72时,溶液为黏稠状,有着很高的表观黏度;而在碱性条件(pH11.44)时,表观黏度比原液(pH5.72)低,为各测定条件下最小。因此在后续实验中主要考察PLP原液、酸性(pH2.7左右)和碱性(pH11.4左右)等条件下的稳定性情况。PLP为一种阴离子多糖,糖醛酸含量为14.7%,原始溶液(2mg/mL)pH值为5.72。在酸性条件下,可能由于PLP的羧基被质子化,减少了多糖分子间的排斥力,因此增加了多糖分子之间相互聚合的概率,导致表观黏度上升。而当在碱性条件时,PLP可能发生解聚或者羧基被解离,分子带有较多的负电荷,产生较大的静电排斥力,使之不易聚集,因而聚集体显著减小,从而导致溶液黏度降低。
2.4 PLP热稳定性分析
利用同步热分析仪测定PLP的热特性,在30~700℃范围内程序升温,考察PLP粉末热稳定性(图3)。123.8℃之前,有轻微的失重现象(失重率为9.9%),可能为干燥过程中残留的水分或其他挥发性物质挥发。随着温度上升,大约在250℃到350℃间,PLP粉末质量急剧降低,至550℃时基本结束。在这一阶段,当温度为288.6℃时,失重速率达到最大值为281.7μg/min,在这一附近,DTA曲线出现一个小峰,应该为放热峰,说明PLP发生了降解,与文献[15]报道较为一致。说明PLP有着较好的热稳定性。
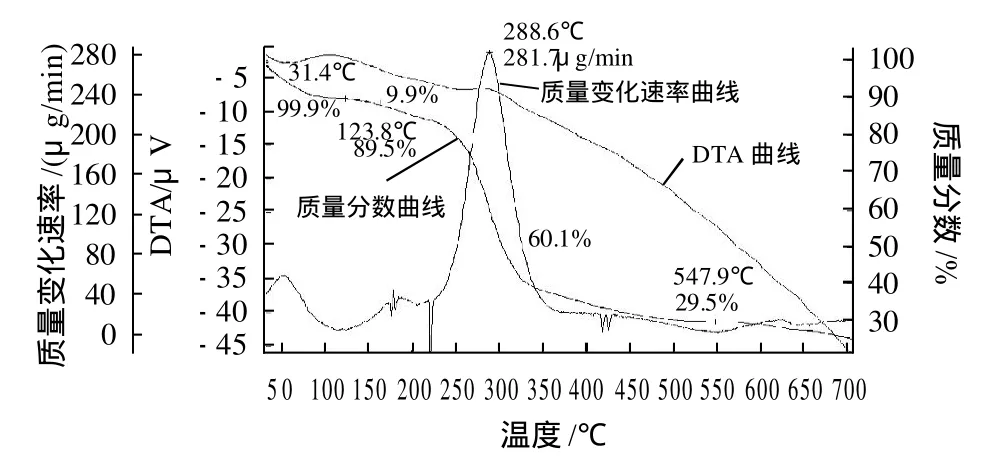
图3 PLP热分析曲线Fig.3 TG-DSC curve of the polysaccharide fraction from Plantago asiatica L. seeds
3 结 论
从大粒车前子中提取、分离和纯化得到均一多糖PLP,考察PLP经酸碱处理后其表观黏度、粒度和单糖组成等方面的变化,并采用TG-DTA考察PLP热稳定性。结果表明,酸碱处理对PLP表观黏度、粒度和单糖组成等方面有一定影响。酸处理后(pH值约为2.7),PLP表观黏度,阿拉伯糖和木糖的物质的量比变化不大;碱处理后(pH值约为11.4),PLP表观黏度和粒度减小,木糖比例有一定程度下降,但是碱处理对PLP单糖组成比例的改变,其具体方式和过程、对特定糖苷键作用降解机理有待于进一步研究。PLP原液加热后再冷却,粒度增大。热稳定性分析表明PLP在250℃开始发生降解,550℃基本结束。
[1] 中华人民共和国卫生部药典委员会. 中华人民共和国药典: 一部[M].北京: 化学工业出版社, 2005: 46.
[2] ROMERO A L, WEST K L, ZEM T, et al. The seeds from Plantago ovata lower plasma lipids by altering hepatic and bile acid metabolism in guinea pigs[J]. The Journal of Nutrition, 2002, 132: 1194-1198.
[3] FANG Chenshun. Dietary Psyllium reverses hypercholesterolemic effect of trans fatty in rats[J]. Nutrition Research, 2000, 20(5): 695-705.
[4] MICHAELSEN T E, GILJE A, SAMUELSEN A B, et al. Interaction between human complement and a pectin type polysaccharide fraction,PMII, from the leaves of Plantago major L.[J]. Scandinavian Journal of Immunology, 2008, 52(5): 483-490.
[5] HETLAND G, SAMUELSEN A B, LOVIK M, et al. Protective effect of Plantago major L. pectin polysaccharide against systemic Streptococcus pneumoniae infection in mice[J]. Scandinavian Journal of Immunology, 2000, 52: 348-355.
[6] 唐永富, 黄丹菲, 殷军艺, 等. 车前子多糖对骨髓来源树突状细胞表型和吞噬功能的影响[J]. 食品科学, 2007, 28(10): 517-519.
[7] HUANG Danfei, TANG Yongfu, WAN Yin, et al. Effect of phenylethanoid glycosides and polysaccharides from the seed of Plantago asiatica L. on the maturation of murine bone marrow-derived dendritic cells[J]. European Journal of Pharmacology, 2009, 620: 105-111.
[8] ZANDONADI R P, BOTELHO R B A, ARAUJO W M C, et al.Psyllium as a substitute for gluten in bread[J]. Journal of the American Dietetic Association, 2009, 109(10): 1781-1784.
[9] AGARWAL M, SRINIVASAN R, MISHRA A, et al. Synthesis of Plantago psyllium mucilage grafted polyacrylamide and its flocculation efficiency in tannery and domestic wastewater[J]. Journal of Polymer Research, 2002, 9(1): 1022-9760.
[10] GUO Q, CUI S W, WANG Q, et al. Microstructure and rheological properties of Psyllium polysaccharide gel[J]. Food Hydrocolloids, 2009,23(6): 1542-1547.
[11] CHEN Xiaoqiang, YE Yang, CHENG Hao, et al. Thermal effects on the stability and antioxidant activity of an acid polysaccharide conjugate derived from green tea[J]. Journal of Agricultural and Food Chemistry,2009, 57(13): 5795-5798.
[12] 周超, 杨美艳, 谢明勇, 等. 车前子胶的流变特性研究[J]. 食品科学,2007, 28(10): 130-133.
[13] 殷军艺, 聂少平, 林慧霞, 等. 大粒车前子多糖乙醇分级及其理化性质研究[J]. 食品科学, 2009, 30(17): 34-37.
[14] 陈海霞. 高活性茶多糖一级结构表征、空间构象及生物活性的研究[D]. 武汉: 华中农业大学, 2002: 11.
[15] 周超. 车前子多糖的分离纯化及其功能性质研究[D]. 南昌: 南昌大学, 2007: 12.
pH and Thermal Stability of a Polysaccharide Fraction from Plantago asiatica L. Seeds
YIN Jun-yi,NIE Shao-ping*,LIN Hui-xia,LI Chang,XIE Ming-yong
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
O652.4;R284.2
A
1002-6630(2010)15-0001-03
2009-12-17
国家自然科学基金项目(20802032);高等学校博士学科点专项科研基金项目(200804030001);
江西省自然科学基金项目(2008GZH 0050);江西省教育厅2008年度科技计划项目(GJJ08056)
殷军艺(1986—),男,博士研究生,研究方向为食品化学与食品分析。E-mail:hongyu112233@163.com
*通信作者:聂少平(1978—),男,副教授,博士,研究方向为食品科学与工程、食品营养与安全及糖生物学。
E-mail:spnie@ncu.edu.cn

