多糖化学改性方法及其生物活性研究进展*
张华,王振宇,2,王雪,姚磊,吴志光,杨鑫
1(哈尔滨工业大学食品科学与工程学院,黑龙江 哈 尔滨,150090)
2(东北林业大学,黑龙江哈尔滨,150040)
3(德之馨(上海)有限公司,上海,201206)
4(国家大豆工程技术研究中心,黑龙江哈尔滨,150050)
多糖化学改性方法及其生物活性研究进展*
张华1,王振宇1,2,王雪3,姚磊4,吴志光1,杨鑫1
1(哈尔滨工业大学食品科学与工程学院,黑龙江 哈 尔滨,150090)
2(东北林业大学,黑龙江哈尔滨,150040)
3(德之馨(上海)有限公司,上海,201206)
4(国家大豆工程技术研究中心,黑龙江哈尔滨,150050)
多糖的化学修饰是一种重要的多糖结构修饰方法,是增强多糖生物活性、降低其副作用的有效途径。文中综述了几种目前多糖化学改性常用的无机酸酯化方法,以及目前国内外对于化学改性多糖制备及其生物活性的研究现状。
多糖,化学改性,生物活性,研究进展
多糖是存在于众多有机体中一类具有丰富结构多样性的特殊生物高分子,多糖作为某些生物转化识别过程中的关键物质已被人们深入地认识,天然多糖已具有许多优异性能,如抗肿瘤、抗病毒、抗感染、抗氧化、抗诱变等,多糖这些生物活性的发挥与其结构有关,利用糖残基上的羟基、羧基、氨基等基团,对多糖进行分子表面修饰,可以进一步改善多糖的诸多性能,甚至获得具有特定结构的功能新材料[1]。多糖衍生物的强抗病毒活性已经在临床应用上得到了充分的证明,因而对多糖结构进行适当修饰是多糖领域研究的重点之一。
多糖醚化和酯化反应是最具多样性的多糖改性方法,因为通过这两种方法可以很容易获得各种性能优异具有生物来源的新材料[1]。本文主要介绍多糖无机酸酯化方法及其生物活性,将新颖的酯化方法、全面的结构解析和明确的的构效关系相结合必将推动多糖在生物工程、医药等诸多领域的应用。
1 多糖结构表征方法及部分多糖结构
多糖含有易于发生酯化反应的伯羟基、仲羟基和羧基,以及可以转化为氨基化合物的-NH2。要了解衍生化过程中多糖骨架可能发生的所有结构变化,需在改性前尽可能全面地对多糖结构进行分析。因为即使多糖类型相同,多糖的化学结构包括分支、糖原连接顺序、链中的氧化部分(如葡聚糖中的醛基、酮基和羧基)和残余的天然杂质均可能存在差异,尤其是在真菌和植物多糖中。
1.1 多糖结构表征方法
要完全阐明一个糖的结构一般需要提供以下几方面的信息:⑴分子量及组成单糖的种类与摩尔比;⑵各糖环的构象(呋喃型或吡喃型)与异头碳的构型;⑶各糖残基间的连接方式;⑷糖残基的连接顺序;⑸二级结构及空间构象等;以及常用到的方法(见表1)。

表1 多糖结构表征中常用的方法
1.2 部分多糖的结构
对多糖高级结构和空间构象的研究,是开发和利用多糖类物质的关键,也是对多糖进行化学改性的基础。研究人员已阐明部分真菌多糖的结构[2-8]。
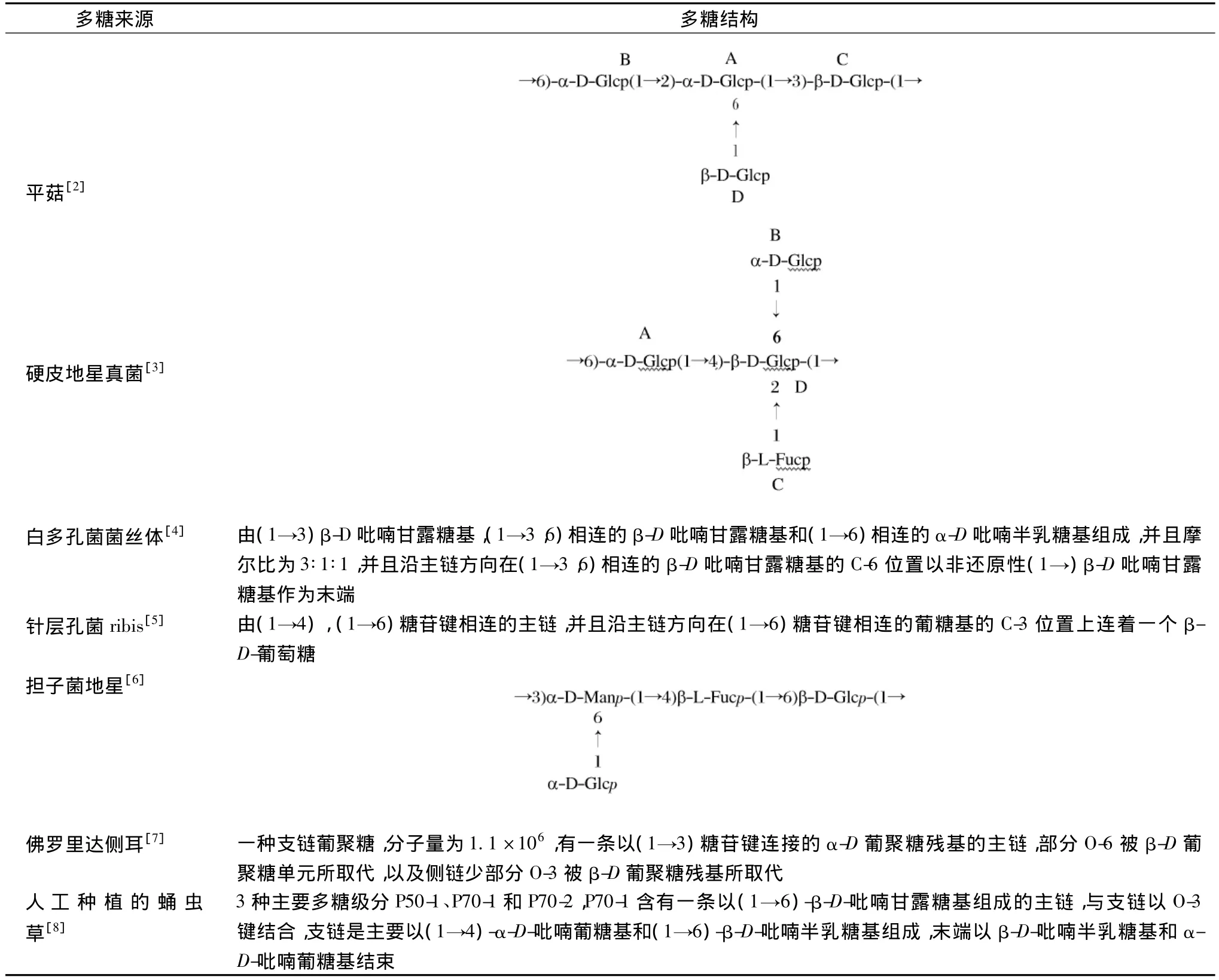
表2 部分多糖的结构
2 多糖硫酸酯化
硫酸酯化多糖(sulfated polysaccharides,SPS)也称多糖硫酸酯(polysaccharides sulfate,PSS),是指糖羟基上带有硫酸根的多糖,是抗病毒多糖中研究最多的一类天然或化学修饰多糖,包括从动、植物中提取的各种硫酸多糖、肝素、天然中性多糖的硫酸衍生物及人工合成、半合成的各种硫酸多糖,具有免疫增强、抗凝血、抗氧化等活性,尤其具有突出的抗病毒(艾滋病毒、巨噬细胞病毒、流感病毒等)活性。具有高生物活性的硫酸酯多糖一般具有[9]:(1)均一多糖硫酸酯化产物抑制病毒的作用优于杂多糖的硫酸酯化产物;(2)每个单糖单位需要2~3个才能有好的抗HIV活性,但每个单糖单位含有有1.5~2个有良好的抗病毒活性;(3)多糖分子质量越小,生物活性越高,在分子质量10000~500000之间保持最大活性。
2.1 硫酸酯化多糖合成方法
多糖硫酸酯化常用的方法有Wolfrom法、Ngasawa法、浓硫酸法、三氧化硫-吡啶法及三氧化硫-二甲基甲酰胺法等。中性多糖一般能溶于有机溶剂,可直接对其硫酸酯化。一般毗喃型多糖的硫酸酯化常采用Wolfrom法,呋喃型多糖常采用Ngasawa法。硫酸化方法的原理为:溶于一定溶剂系统中的多糖与相应的硫酸化试剂在一定的条件下反应,使得多糖残基上的某些羟基接上硫酸基团。以氯磺酸试剂为例,多糖的硫酸酯化反应是在路易斯碱溶液中由SO3H+取代多糖羟基中的H+,经中和得到硫酸酯盐。
2.2 硫酸酯化多糖生物活性
硫酸多糖的活性不仅与硫酸根的存在与否关系密切,还受硫酸取代度大小的影响。硫酸基的取代位置也是影响硫酸多糖活性的重要因素。尽管硫酸根与硫酸多糖的抗病毒活性密切相关,但并不是硫酸根越多活性越强,分子中硫酸根过多会产生抗凝血等副作用。一些海洋硫酸多糖因硫酸基过多而显示一定的毒性,经过脱去部分硫酸基(称多糖的脱硫修饰),可降低其毒性。
2.2.1 天然产物中提取
Anthony Josephine等研究从羊栖菜中分离的硫酸酯化多糖能阻止因环孢霉素而引发的大鼠肾脏线粒体功能缺失,起到对环孢霉素引起大鼠肾脏线粒体抗突变的生物学效应[10]。Mahanama De Zoysa等通过测定主动脉血栓形成时间研究从发酵的褐藻中分离得到的硫酸酯化多糖的抗凝血活性,这种硫酸酯化褐藻多糖得率是1.32%,是一种酸性多糖,虽然抗凝活性弱于肝素,但是对今后海洋藻类资源的开发具有指导意义[11]。Mao等研究从绿藻袋礁膜中分离多糖的结构和抗辐射作用,具有与其它富含鼠李糖的绿藻多糖不同的化学组成,硫酸酯化含量约为21.8%,能激活因辐射受损的老鼠的白细胞和造血功能[12]。
2.2.2 人工合成
硫酸化葡聚糖抗凝血活性的提高和硫酸基团的取代度(DS)和分子量有关,而且取决于2,3,4位的葡萄糖单体上是否有硫酸基取代。Cui等研究野生葛根中(1→6)-α-D-葡萄糖的结构和构象,并采用MTT法评价硫酸酯化衍生物能够减轻过氧化氢对大鼠肾上腺嗜铬细胞瘤细胞的损伤作用[13]。Guo-Guang Liu合成硫酸酯化紫云英属多糖具有很高的抗HIV活性[14]。Ronghua Huang等研究适用于制备硫酸酯化壳聚糖的一种新方法及其抗凝血性[15]。Li Wang用氯磺酸-吡啶(CSA-Pyr)法制备九种脱脂米麸多糖硫酸化衍生物,经MTT体外实验评价其抗肿瘤活性,当硫酸化程度在0.81~1.29,糖含量在41.41%~78.56%时,硫酸化衍生物体外的抗肿瘤活性相对较高[16]。因此硫酸化修饰是目前多糖结构修饰中研究得最多而且效果突出的一种修饰手段。
2.3 多糖的脱硫修饰
硫酸根具有抗凝血作用,因而部分脱硫,可降低多糖的抗凝活性,从某种意义上降低了毒性。脱硫的研究还有助于探讨硫酸根对海洋多糖的构效关系的影响。此外,在海洋多糖的结构测定中定位脱硫非常重要。目前脱硫法有酸脱硫法、碱脱硫法和有机溶剂脱硫法。最初主要用浓H2SO4和无水乙酸进行脱硫,但反应条件剧烈,易引起糖苷键的断裂,容易引起多糖构象的改变。人们对此法稍进行改进,用甲醇分解法在比较温和的条件下进行脱硫。有机溶剂脱硫法不易引起多糖中糖苷键的断裂,也不易引起多糖分子结构改变,对多糖化学结构分析测定的研究具有重大意义。
3 多糖羧甲基化
多糖与羧酸或羧酸衍生物的酯化反应是目前应用最广泛的多糖改性方法之一。羧甲基化增加多糖溶解度和电负性,向多糖中引入羧甲基可以提高多糖的水溶性,能给多糖增强活性或带来新的活性,因而羧甲基化也是常用的对多糖进行化学修饰的方法。
3.1 羧甲基化多糖合成方法
目前多糖常用的羧甲基化方法是将多糖在NaOH中碱化,再加异丙醇、氯乙酸,获得羧甲基化衍生物。Katrin Petzold等分别采用乙醇/甲苯,乙醇,异丙醇作为反应媒介合成羧甲基化木聚糖并表征其结构[17]。壳聚糖作为一种医用生物材料有着广泛的用途,但是由于其难溶性限制其的广泛应用,而羧甲基化壳聚糖是将其转化成水溶性的有效方法,Hua-Cai Ge等研究微波辅助制备羧甲基化壳聚糖的新工艺,微波辐射会促进反应体系质的传递,会增加氯乙酸和壳聚糖活性基团的反应,从而提高羧甲基取代度[18]。
3.2 羧甲基化多糖生物活性
近两年,关于多糖的羧甲基化报道较多,Wang YF等对从茯苓菌中获得的水不溶性的β-葡聚糖分别进行硫酸化、羧甲基化、甲基化、羟乙基化和羟丙醇化,得到5种水溶性的衍生物,研究发现硫酸化和羧甲基化衍生物均有显著的抗S-180肿瘤细胞和胃癌瘤细胞活性,而原多糖并没有此活性[19]。Chen等制备羧甲基化壳聚糖,可以促进正常皮肤纤维原细胞及瘢痕瘤皮肤纤维原细胞中胶原的分泌[20]。El-Sherbiny研究新的羧甲基化壳聚糖的合成、表征及其吸附金属离子的能力,可以应用在废水处理领域[21]。
4 多糖乙酰基化
多糖中乙酰基对多糖活性有影响,多糖部分乙酰化后而具有抗肿瘤活性,因为乙酰基能改变多糖分子的定向性和横次序,从而改变多糖的物理性质,乙酰基的引入使分子的伸展变化,最终导致多糖羧基基团的暴露,增加在水中的溶解性。乙酰基的数量和位置对多糖活性有显著影响。纤维素经过乙酰化,乙酰基取代度低于0.5,以这种低乙酰基取代度的纤维素衍生物为原料进行硫酸化修饰,然后脱乙酰基,可得到高硫酸取代度且取代基分布均匀、抗HIV活性更高的硫酸化纤维素。
多糖乙酰化的主要试剂是乙酸和乙酸酐。一般是将多糖置于一定的溶剂如吡啶、甲醇、DMAc/LiCl中,然后加入乙酰化试剂来完成酰化反应,乙酰化部位可以发生在羟基氧和胺基氮上[22]。Jing Wang等合成了过硫酸化,乙酰化和苯甲基化三种褐藻多糖衍生物,并且研究其体外抗氧化活性。在乙酰化和苯甲酰化反应中,使用了新型催化剂(NBS),同时用红外光谱和核磁共振光谱研究了其乙酰化程度。乙酰化和苯甲酰化褐藻多糖衍生物具有很强的抗氧化活性,并且明显高于褐藻多糖。苯甲基化褐藻多糖清除超氧和羟基自由基活性最强,而乙酰化的褐藻多糖硫酸酯清除DPPH自由基和还原能力最强。硫酸基、乙酰基和苯甲酰取代基对于褐藻多糖体外抗氧化活性起着重要作用,而且抗氧化活性机制不同[23]。
5 多糖磷酸酯化
在多糖生物合成过程中,向糖原引入磷酸酯基是一个非常重要的活化步骤,形成糖苷键时磷酸酯基断裂,糖的磷酸酯类也是一类比较重要的糖类衍生物,多糖磷酸酯化后一般是为了降低多糖的溶解性或增强生物活性,磷酸酯化改性可增加纺织材料的阻燃性,纤维素磷酸酯可用作弱阴离子交换剂。
5.1 磷酸酯化多糖合成方法
磷酸酯化试剂有磷酰氯、磷酸酐、磷酸或其盐。磷酸及磷酸酐或两者的混合物是最早采用的磷酰化试剂,但一般糖苷键在酸性条件下极易水解,而此反应又是在高温下进行,此条件下糖易降解,从而使产物收率和DS均不高,大大限制了该法的应用。但一些对酸稳定的多糖或寡糖,用此法进行磷酰化就比较简单易行。磷酸盐廉价、易得,但反应活性低,不易获得高DS的产物。与磷酸相比其优点是一般不会引起多糖的降解。常用的磷酸盐有磷酸氢钠、磷酸二氢钠、偏磷酸钠或它们的混合盐。磷酰氯作为磷酰化试剂可获得高DS的磷酰化产物,但反应激烈、收率低、副产物多、有多种取代磷酸酯,因而限制了它的广泛应用,往往只用于合成简单的磷酰酯。一般常用的试剂是三氯氧磷(POCl3),Yuan等用POCl3作为磷酸化试剂,以吡啶为溶剂制备磷酸酯化多糖[22]。
5.2 磷酸酯化多糖生物活性
采用磷酸化修饰得到的多糖磷酸酯衍生物具有抗病毒、抗菌、免疫调节、抗肿瘤等活性,并且糖链的长短及磷酸根的数目与抗肿瘤活性有着密切的关系。Wang采用三氯氧磷法和多聚磷酸法分别合成两种褐藻多糖磷酸酯化衍生物,采用环氧氯丙烷和氨水合成褐藻胺基化衍生物,并分别选取超氧自由基、羟自由基和DPPH清除活性评价3种褐藻多糖衍生物体外抗氧化活性,结果显示磷酸酯化的褐藻多糖衍生物表现出更强的羟自由基和DPPH清除活性,揭示不同取代基团与抗氧化能力之间的关系[25]。目前关于糖磷酸酯化修饰的研究报道还比较少,而且对于多糖、寡糖及其类似物的磷酸酯衍生物的生物活性、磷酸基在其中的作用及作用机制还不明确,尚待进一步深入研究。
6 多糖硝酸酯化
多糖硝酸酯通常由多糖与硝酸和硫酸的混合硝化剂按一定的比例反应制备,几乎完全衍生化的淀粉硝酸酯(DS3)可用作炸药,其制备过程与纤维素的硝酸酯化过程类似。此外,将淀粉溶解在N2O4/DMF中,在甲醇存在下,继续加热中间体淀粉亚硝酸酯,也可制得淀粉硝酸酯。纤维素硝酸酯是迄今最重要的多糖硝酸酯,简称为“硝化棉”,已应用到许多领域(见表3)。采用不同硝化试剂,可以获得不同DS的产物。采用90%HNO3与磷酸和脱水剂P2O5的混合物,或者90%HNO3与乙酸酐的混合物,均可对纤维素进行完全硝酸酯化改性(DS=3),中间体乙酰硝酸酯是高反应活性的硝化试剂。DS3的纤维素硝酸酯可用于分析领域,用于黏度法或SEC法测定分子量和分子量分布。在无水条件下,消化反应不影响多糖的平均聚合度(DP)[1]。

表3 具有不同DS值的纤维素硝酸酯的溶解性及应用领域[1]
7 小结
自然界中存在的多糖并不都具有活性。有些多糖由于结构或理化性质等障碍而不利于其生物学活性的发挥。有些从天然生物体内分离的多糖活性较弱,有待进一步提高。有些多糖不溶于水,影响进一步的药理研究。多糖的活性与多糖的结构、分子量、溶解性等诸多因素紧密相关。因此,采取一定的化学方法对多糖结构进行适当修饰是解决以上问题的根本途径。笔者在实验室制备了一些硫酸化、乙酰化、羧甲基化的黑木耳多糖,目前正在研究其抗癌活性。但是多糖的衍生化也有使原有活性减弱或丧失,因此多糖的衍生化关键在于确定多糖的结构与活性关系,确保多糖在衍生化后活性中心的立体构象处于最佳状态。
[1]Heinze T,Liebert T,Koschella A著;尹学琼,林强译.多糖酯化反应[M].北京:化学工业出版社,2008.1-3.
[2]Malay Pramanik,Indranil Chakraborty,Soumitra Mondal.Structural analysis of a water-soluble glucan(Fr.I)of an edible mushroom,Pleurotus sajor-caju[J].Carbohydrate Research,2007,342:2670-2675.
[3]Indranil Chakraborty,Soumitra Mondal,Dilip Rout,et al.Structural investigation of a heteroglycan isolated from the fruit bodies of an ectomycorrhizal fungus Astraeus hygrometricus[J].Carbohydrate Research,2007,342:982-987.
[4]Sun Yongxu,Wang Shusheng,Li Tianbao.Purification,structure and immunobiological activity of a new water-soluble polysaccharide from the mycelium of Polyporus albicans(Imaz.)Teng[J].Bioresource Technology,2008,99:900-904.
[5]Liu Yuhong,Wang Fengshan.Structural characterization of an active polysaccharide from Phellinus ribis[J].Carbohydrate Polymers,2007,70:386-392.
[6]Debabrata Maiti,Krishnendu Chandra,Subhas Mondal,et al.Isolation and characterization of a heteroglycan from the fruits of Astraeus hygrometricus[J].Carbohydrate Research,2008,343:817-824.
[7]Juliana C Santos-Neves,Maria Izabel Pereira,Elaine R Carbonero,et al.novel branched α β-glucan isolated from the basidiocarps of the edible mushroom Pleurotus florida[J].Carbohydrate Polymers,2008,73:309-314.
[8]Yu Rongmin,Yang Wei,Song Liyan.Structural characterization and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps militaris[J].Carbohydrate Polymers,2007,70:430-436.
[9]Nakano M,Itoh Y,Mizumo T,et al.Poltsaccharide from Aspalathus linearis with strong anti-HIV acticity[J].Biosci Biatechnol Biochem,1997,61(2):267-271.
[10]Anthony Josephine,Ganapathy Amudha,Coothan Kandaswamy Veena,et al.Beneficial effects of sulfated polysaccharides from Sargassum wightii against mitochondrial alterations induced by Cyclosporine A in rat kidney[J].Mol Nutr Food Res,2007,51:1413-1422.
[11]Mahanama De Zoysa,Chamilani Nikapitiya,You-Jin Jeon,et al.Anticoagulant activity of sulfated polysaccharide isolated from fermented brown seaweed Sargassum fulvellum[J].Appl Phycol,2008,20:67-74.
[12]Mao Wenjun,Li Yi,Wu Ligen,et al.Chemical characterization and radioprotective effect of polysaccharide from Monostroma angicava(Chlorophyta)[J].Journal of Applied Phycology,2005,17:349-354.
[13]Cui Hengxiang,Liu Qin,Tao Yongzhen,et al.Structure and chain conformation of a(1→6)-α-D-glucan from the root of Pueraria lobata(Willd.)Ohwi and the antioxidant activity of its sulfated derivative[J].Carbohydrate-Polymers,2008(74):771-778.
[14]Liu Guo-Guang,Gereltu Borjihan,Huricha Baigude,et al.Synthesis and anti-HIV activity of sulfated Astragalus polysaccharide[J].Polymers for Advanced Technologies,2003,14:471-476.
[15]Huang Ronghua,Du Yumin,Yang Jianhong,et al.Influence of functional groups on the in vitro anticoagulant activity of chitosan sulfate[J].Carbohydrate Research,2003,338:483-489.
[16]Wang Li,Li Xiaoxuan,Chen Zhengxing.Sulfated modification of the polysaccharides obtained from defatted rice bran and their antitumor activities[J].International Journal of Biological Macromolecules,2009,44:211-214.
[17]Katrin Petzold,Katrin Schwikal,Thomas Heinze.Carboxymethyl xylan-synthesis and detailed structure characterization[J].Carbohydrate Polymers,2006,(64):292-298.
[18]Ge Hua-cai,Luo Deng-ke.Preparation of carboxymethyl chitosan in aqueous solution under microwave irradiation[J].Carbohydrate Research,2005,340:1351-1356.
[19]Wang Yi-feng,Zhang Li-na,Li Yun-qiao,et al.Correlation of structure to antitumor activities of five derivatives of β-glucan from poria cocos sclerotium[J].Carbohydr Res,2004,339(15):2567-2574.
[20]Chen Xi-guang,Zhen-wang,Liu Wan-shun,et al.The effect of carboxymethyl-chitosan on proliferation and collagen secretion of normal and keloid skin fibroblasts[J].Biomaterials,2002,23:4609-4614.
[21]El-Sherbiny I M.Synthesis,characterization and metal uptake capacity of a new carboxymethyl chitosan derivative[J].European Polymer Journal,2009,45:199-210.
[22]Yuan Huamao,Zhang Wei-wei,Li Xue-gang,et.al.Preparation and in vitro antioxidant activity ofκ-carrag-eenan oligosaccharides and their oversulfated,acetylated,and phosphorylated derivatives[J].Carbohydrate Research,2005,340:685-692.
[23]Wang Jing,Liu Li,Zhang Quan-bin,et al.Synthesized oversulphated,acetylated and benzoylated derivatives of fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro[J].Food Chemistry,2009,114:1285-1290.
[24]Jayakumar R,Selvamurugan N,Nair S V,et al.Preparative methods of phosphorylated chitin and chitosan An overview[J].International Journal of Biological Macromolecules,2008,43:221-225.
[25]Wang Jing,Zhang Quan-bin,Zhang Zhong-shan,et al.Synthesized phosphorylated and aminated derivatives of fucoidan and their potential antioxidant activity in vitro[J].International Journal of Biological Macromolecules,2009,44:170-174.
ABSTRACTChemical modification is an important method of structural modification for polysaccharides.It is an effective way to enhance the biological activities of polysaccharide and reduce their side effects.In this paper,several inorganic ester methods commonly used for polysaccharide and their activities of modified polysaccharides were summarized at present.
Key wordspolysaccharide,chemical modification,biological activity,research advancements
Research Advancements of Chemical Modification of Polysaccharide and Their Biological Activities
Zhang Hua1,Wang Zhen-yu1,2,Wang Xue3,Yao Lei4,Wu Zhi-guang1,Yang Xin1
1(Shool of Food Science and Engneering,Harbin Institute of Technology,Harbin 150090,China)
2(Northeast Forestry University,Harbin 150040,China))
3(Symrise(Shanghai)Co.,Ltd.,Shanghai 201206,China)
4(National Research Soybean Engineering and Technology Center,Harbin 150050,China)
博士研究生,讲师(王振宇博士生导师为通讯作者)。
*国家863项目(2007AA100404)
2010-01-28,改回日期:2010-04-13

